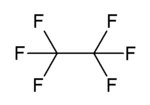
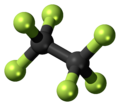
heksafluoroetan
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
heksafluoroetan |
|||
| Inne nazwy Sześciofluorek węgla, 1,1,1,2,2,2-heksafluoroetan, Perfluoroetan, Ethforan, Halocarbon 116, PFC-116, CFC-116, R-116, Arcton 116, Halon 2600, UN 2193
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.000.855 | ||
| Numer WE |
|
||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS |
|
||
| UNII | |||
| Numer ONZ | 2193 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| do 2 do 6 | |||
| Masa cząsteczkowa | 138,01 g.mol -1 | ||
| Wygląd | Bezbarwny bezwonny gaz | ||
| Gęstość | 5,734 kg·m -3 w temperaturze 24°C | ||
| Temperatura topnienia | -100,6 ° C (-149,1 ° F; 172,6 K) | ||
| Temperatura wrzenia | -78,2 ° C (-108,8 ° F; 195,0 K) | ||
| 0,0015% | |||
| dziennik P | 2 | ||
|
Stała prawa Henry'ego
( k H ) |
0,000058 mol.kg -1 .bar -1 | ||
| Zagrożenia | |||
| NFPA 704 (ognisty diament) | |||
| Punkt zapłonu | Nie palne | ||
| Strona danych uzupełniających | |||
| Heksafluoroetan (strona danych) | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Heksafluoroetan jest odpowiednikiem perfluorowęglowodoru etanu węglowodorowego . Jest gazem niepalnym, słabo rozpuszczalnym w wodzie i słabo rozpuszczalnym w alkoholu . Jest to niezwykle silny i długotrwały gaz cieplarniany .
Właściwości fizyczne
Faza stała heksafluoroetanu ma dwa polimorfy . W literaturze naukowej podaje się różne temperatury przemian fazowych . Najnowsze prace przypisują ją temperaturze 103 K (-170 ° C). Poniżej 103 K ma nieco nieuporządkowaną strukturę, a powyżej punktu przejścia ma sześcienną strukturę skupioną na ciele . Punkt krytyczny to 19,89 °C (293,04 K) i 30,39 bara.
Tabela gęstości:
| Stan, temperatura | Gęstość (kg.m -3 ) |
|---|---|
| ciecz, -78,2 ° C | 16.08 |
| gaz, -78,2 ° C | 8.86 |
| gaz, 15°C | 5,84 |
| gaz, 20,1°C | 5.716 |
| gaz, 24°C | 5.734 |
Gęstość par wynosi 4,823 (powietrze = 1), ciężar właściwy w temperaturze 21 °C wynosi 4,773 (powietrze = 1), a objętość właściwa w temperaturze 21 °C wynosi 0,1748 m 3 /kg.
Używa
Heksafluoroetan jest używany jako wszechstronny środek wytrawiający w produkcji półprzewodników . Może być stosowany do selektywnego wytrawiania krzemków i tlenków metali względem ich podłoży metalowych, a także do wytrawiania dwutlenku krzemu na krzemie . Przemysł produkujący aluminium pierwotne i półprzewodniki jest głównym emitentem heksafluoroetanu wykorzystującego proces Halla-Héroulta .
Wraz z trifluorometanem jest stosowany w czynnikach chłodniczych R508A (61%) i R508B (54%).
Efekty środowiskowe
Ze względu na wysoką energię wiązań CF, heksafluoretan jest prawie obojętny i dlatego działa jako niezwykle stabilny gaz cieplarniany , którego czas życia w atmosferze wynosi 10 000 lat (inne źródła: 500 lat). Ma współczynnik ocieplenia globalnego (GWP) równy 9200 i potencjał niszczenia warstwy ozonowej (ODP) równy 0. Heksafluoroetan znajduje się na liście gazów cieplarnianych IPCC .
Heksafluoretan nie występował w środowisku w znaczących ilościach przed rozpoczęciem produkcji na skalę przemysłową. Atmosferyczne stężenie heksafluoroetanu osiągnęło 3 pptv na początku XXI wieku. Jego pasma absorpcyjne w podczerwonej części widma powodują wymuszenie radiacyjne o wartości około 0,001 W/ m2 .
Zagrożenia dla zdrowia
Ze względu na dużą gęstość względną gromadzi się na terenach nisko położonych, a przy wysokich stężeniach może powodować uduszenie . Inne skutki zdrowotne są podobne do tetrafluorometanu .
Zobacz też
- Bozin SE i in. (1968). „Wzrost prądów jonizacji w tetrafluorku węgla i heksafluoroetanie”. J. Fiz. D: Zał. fizyka . 1 (3): 327–334. Bibcode : 1968JPhD....1..327B . doi : 10.1088/0022-3727/1/3/309 .
Linki zewnętrzne
- Proces oczyszczania heksafluoroetanu
- Protokół pomiaru tetrafluorometanu i heksafluoroetanu z produkcji aluminium pierwotnego
- De Maré, GR; Panczenko, Yu. N. (marzec 2006). drgań Ab initio heksafluoroetanu C2F6 ” . Dziennik Chemii Strukturalnej . 47 (2): 232–240. doi : 10.1007/s10947-006-0291-y . S2CID 96363970 .
- Protokół pomiaru emisji tetrafluorometanu ( CF
4 ) i heksafluoroetanu ( C
2 F
6 ) z produkcji aluminium pierwotnego - Tabela danych termochemicznych na chemnet.ru