tetrafluoroboran trimetyloksoniowy
|
|

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
tetrafluoroboran trimetyloksoniowy
|
|
| Inne nazwy Sól Meerweina Fluoroboran trimetyloksoniowy |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.006.360 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
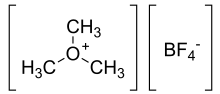
| [(CH 3 ) 3 O] + [BF 4 ] - | |
| Masa cząsteczkowa | 147,91 g·mol -1 |
| Wygląd | Białe ciało stałe |
| Temperatura topnienia | 179,6–180 ° C (355,3–356,0 ° F; 452,8–453,1 K) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Tetrafluoroboran trimetyloksoniowy jest związkiem organicznym o wzorze [(CH 3 ) 3 O] + [BF 4 ] − . (Czasami nazywana jest „solą Meerweina” od nazwiska Hansa Meerweina .) Sól ta jest silnym środkiem metylującym , będącym syntetycznym odpowiednikiem CH + 3 . Jest to biała substancja stała, która szybko rozkłada się pod wpływem wilgoci atmosferycznej, chociaż jest wystarczająco wytrzymała, aby można ją było szybko zważyć bez ochrony w atmosferze obojętnej. Tetrafluoroboran trietyloksoniowy jest blisko spokrewnionym związkiem.
Przygotowanie i reakcje
Związek otrzymuje się w reakcji trifluorku boru z eterem dimetylowym i epichlorohydryną :
- 4 Me 2 O·BF 3 + 2 Me 2 O + 3 C 2 H 3 OCH 2 Cl → 3 [Me 3 O] + [BF 4 ] − + B [(OCH (CH 2 Cl) CH 2 OMe] 3
Sól łatwo hydrolizuje:
- [Me 3 O] + [BF 4 ] − + H 2 O → Me 2 O + MeOH + H + [BF 4 ] −
Tetrafluoroboran trimetyloksoniowy jest ogólnie uznawany za najsilniejszy dostępny na rynku odczynnik do metylacji elektrofilowej , będąc silniejszym niż estry sulfonianu metylu, w tym triflat metylu i fluorosulfonian metylu („magiczny metyl”). Tylko egzotyczne odczynniki dimetylohaloniowe ( [Me 2 X] + [SbF 6 ] - , X = Cl, Br, I), odczynniki karboranianu metylu i przejściowo generowany kation metylodiazoniowy ( MeN + 2 ) są silniejszymi źródłami elektrofilowego metylu.
Ze względu na swoją wysoką reaktywność jest szybko niszczony przez wilgoć atmosferyczną i najlepiej przechowywać go w komorze rękawicowej z atmosferą obojętną w temperaturze -20 ° C. Jego produkty rozkładu są żrące, chociaż jest znacznie mniej niebezpieczny niż triflat metylu lub fluorosulfonian metylu ze względu na brak lotności.