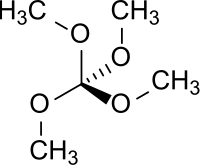
tetrametoksymetan
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
tetrametoksymetan |
|
| Inne nazwy Ortowęglan tetrametylu
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.015.853 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
| Numer ONZ | 3272 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C5H12O4 _ _ _ _ _ | |
| Masa cząsteczkowa | 136,15 g · mol -1 |
| Wygląd | bezbarwna ciecz |
| Gęstość | 1,023 g/cm3 ( 25°C) |
| Temperatura topnienia | −5,5 °C |
| Temperatura wrzenia | 114°C |
| Zagrożenia | |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| H225 , H315 , H319 , H335 | |
| P210 , P261 , P305+P351+P338 | |
| Związki pokrewne | |
|
Inne kationy
|
tetrametoksysilan |
|
Związki pokrewne
|
tetraetoksymetan |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Tetrametoksymetan jest związkiem chemicznym , który formalnie powstaje w wyniku całkowitej metylacji hipotetycznego kwasu ortokarboksylowego C(OH) 4 (kwas ortokarboksylowy łamie regułę Erlenmeyera i jest nietrwały w stanie wolnym).
Przygotowanie
Oczywista droga syntezy z tetrachlorometanu nie daje pożądanego produktu. Pierwotny preparat tetrametoksymetanu był zatem oparty na chloropikrynie :
Ze względu na nieprzyjemne właściwości chloropikryny zbadano inne tetrapodstawione reaktywne pochodne metanu jako materiał wyjściowy dla tetrametoksymetanu. Na przykład chlorek trichlorometanosulfenylu (stosowany również jako chemiczny środek bojowy i łatwo dostępny z wodorosiarczku węgla i chloru ) był używany:
Mniej problematyczna synteza oparta jest na trichloroacetonitrylu , z wydajnością około 70%:
Dalsze metody preparatywne opisano w literaturze.
Nieruchomości
Tetrametoksymetan jest przezroczystą jak woda cieczą o aromatycznym zapachu i niskiej lepkości, która jest odporna na powstawanie nadtlenków.
Używać
Oprócz zastosowania jako rozpuszczalnik , tetrametoksymetan jest używany jako paliwo w polimerowych ogniwach paliwowych , jako czynnik alkilujący w podwyższonych temperaturach (180-200°C), jako odczynnik do transestryfikacji (ale wykazujący mniejszą reaktywność niż trimetoksymetan) oraz jako odczynnik do syntezy 2-aminobenzoksazoli, które są wykorzystywane jako budulec molekularny w farmaceutycznych składnikach aktywnych stosowanych w neuroleptykach , uspokajających , przeciwwymiotnych , zwiotczających mięśnie , fungicydach i innych.
W zależności od podstawników, reakcja w jednym naczyniu przebiega z wydajnością „od umiarkowanej do doskonałej”.
- ^ a b c d H. v. Hartel, Über Existenz und Darstellung des Orthokohlensäure-tetramethylesters , Ber.dtsch.chem.Ges., 60 (8), 1841 (1927), doi : 10.1002/cber.19270600821 .
- ^ a b RH De Wolfe, pochodne ortokwasów karboksylowych: preparatyka i zastosowania syntetyczne , Organic Chemistry, tom. 14, Academic Press, Inc. Nowy Jork – Londyn, 1970, ISBN 978-0-12-214550-6 .
- ^ H. Tieckelmann, HW Post, Przygotowanie ortowęglanów metylu, etylu, propylu i butylu , J. Org. Chem., 13 (2), 265-267 (1948), doi : 10.1021/jo01160a014 .
- Referencje _ _ _ Listopad 1974.
- ^ Patent USA US 3,876,708, Estry kwasu ortowęglowego , Erfinder: R. Speh, W. Kantlehner, Anmelder: Akzo BV, wydany 8 kwietnia 1975.
- ^ Patent USA US 6,825,385 B2, Proces przygotowania ortowęglanów , Erfinder: G. Fries, J. Kirchhoff, Anmelder: Degussa AG, opublikowany 30 listopada 2004.
- ^ W. Kantlehner i in., Die praparative Chemie der O- und N-funktionellen Orthokohlensäure-Derivate , Synthesis ; 1977(2): 73-90, doi : 10.1055/s-1977-24283 .
- ^ KR Kopecki; J. Molina (1987). „Nadtlenek bis (dimetoksymetylu) i nadtlenek bis (1,1-dimetoksyetylu)”. Kanadyjski Dziennik Chemii . 65 (10): 2350. doi : 10.1139/v87-392 .
- Referencje _ _ _
- ^ M. Selva i in., Estry i ortoestry jako środki alkilujące w wysokiej temperaturze. Applications to Continuous-flow Processes , J. Chem. Soc., Perkin Trans. 2, 519 (1992), doi : 10.1039/P29920000519 .
- ^ CL Cioffi i in., Synthesis of 2-Aminobenzoxazoles using Tetramethyl Orthocarbonate or 1,1-dichloro-difenoxymethane , J. Org. Chem., 75 (2), 7942-7945 (2010), doi : 10.1021/jo1017052 .
