Białko podobne do ubikwityny
| Rodzina ubikwityny | |||||||||
|---|---|---|---|---|---|---|---|---|---|
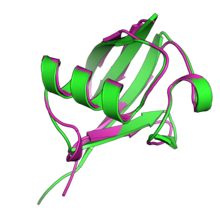 Superpozycja struktur ubikwityny (, zielony) i NEDD8 (, magenta)
| |||||||||
| Identyfikatory | |||||||||
| Symbol | Ubikwityna | ||||||||
| Pfam | PF00240 | ||||||||
| InterPro | IPR029071 | ||||||||
| MĄDRY | SM00213 | ||||||||
| |||||||||
Białka podobne do ubikwityny (UBL) to rodzina małych białek zaangażowanych w potranslacyjną modyfikację innych białek w komórce , zwykle pełniących funkcję regulatorową . Rodzina białek UBL wywodzi swoją nazwę od pierwszego odkrytego członka klasy, ubikwityny (Ub), najlepiej znanej ze swojej roli w regulowaniu degradacji białek poprzez kowalencyjne modyfikacja innych białek. Po odkryciu ubikwityny opisano wielu dodatkowych ewolucyjnie spokrewnionych członków grupy, obejmujących równoległe procesy regulacyjne i podobną chemię. UBL biorą udział w wielu różnych funkcjach komórkowych, w tym w autofagii , transporcie białek , stanach zapalnych i odpowiedziach immunologicznych , transkrypcji , naprawie DNA , splicingu RNA i różnicowaniu komórkowym .
Odkrycie
Sama ubikwityna została po raz pierwszy odkryta w latach 70. XX wieku i pierwotnie nazwana „wszechobecnym polipeptydem immunopoetycznym”. Następnie w literaturze sporadycznie opisywano inne białka o sekwencji podobieństwa do ubikwityny, ale pierwszym, w którym wykazano, że ma wspólną kluczową cechę kowalencyjnej modyfikacji białka, było ISG15 , odkryte w 1987 r. Seria doniesień z połowy lat 90. jest uznawana za punkt zwrotny w terenie, wraz z odkryciem SUMO ( s mall u biquitin-like mo difier, znany również jako Sentrin lub SENP1) zgłoszony mniej więcej w tym samym czasie przez różnych badaczy w 1996 r., NEDD8 w 1997 r. I Apg12 w 1998 r. Od tego czasu systematyczne badanie zidentyfikowało ponad 10 000 różnych genów dla ubikwityny lub białek podobnych do ubikwityny reprezentowanych w genomy eukariotyczne .
Struktura i klasyfikacja
Członkowie rodziny UBL to małe, nieenzymatyczne białka , które mają wspólną strukturę, czego przykładem jest ubikwityna, która ma 76 reszt aminokwasowych ułożonych w fałd białkowy „chwytu beta”, składający się z pięcioniciowego antyrównoległego arkusza beta otaczającego helisę alfa . Fałd beta-chwytu jest szeroko rozpowszechniony w innych białkach zarówno pochodzenia eukariotycznego, jak i prokariotycznego. Łącznie ubikwityna i białka podobne do ubikwityny są czasami określane jako „ubikwitony”.
UBL można podzielić na dwie kategorie w zależności od ich zdolności do kowalencyjnego sprzężenia z innymi cząsteczkami. UBL zdolne do koniugacji (czasami znane jako Typ I) mają charakterystyczny motyw sekwencji składający się z jednej do dwóch reszt glicyny na C-końcu , przez który zachodzi koniugacja kowalencyjna. Zazwyczaj UBL są wyrażane jako nieaktywne prekursory i muszą być aktywowane przez proteolizę C-końca, aby odsłonić aktywną glicynę. Prawie wszystkie takie UBL są ostatecznie połączone z innym białkiem, ale jest co najmniej jeden wyjątek; ATG8 jest połączony z fosfatydyloetanoloaminą . UBL, które nie wykazują koniugacji kowalencyjnej (typ II), często występują jako domeny białkowe genetycznie połączone z innymi domenami w jednym większym łańcuchu polipeptydowym i mogą być przetwarzane proteolitycznie w celu uwolnienia domeny UBL lub mogą działać jako domeny interakcji białko-białko . Domeny UBL większych białek są czasami nazywane domenami UBX .
Dystrybucja
Ubikwityna jest, jak sama nazwa wskazuje, wszechobecna u eukariontów ; tradycyjnie uważa się, że nie występuje u bakterii i archeonów , chociaż kilka przykładów opisano u archeonów . UBL są również szeroko rozpowszechnione u eukariontów, ale ich rozmieszczenie różni się w zależności od linii; na przykład ISG15 , zaangażowany w regulację układu odpornościowego , nie występuje u niższych eukariotów. Inne rodziny wykazują zróżnicowanie w niektórych liniach; drożdżach znajduje się pojedynczy członek rodziny SUMO genomu, ale są co najmniej cztery w genomach kręgowców , które wykazują pewną redundancję funkcjonalną, i jest co najmniej osiem w genomie rośliny modelowej Arabidopsis thaliana .
W ludziach
Ludzki genom koduje co najmniej osiem rodzin UBL, nie licząc samej ubikwityny, które są uważane za UBL typu I i są znane z kowalencyjnej modyfikacji innych białek: SUMO , NEDD8 , ATG8 , ATG12 , URM1 , UFM1 , FAT10 i ISG15 . Jedno dodatkowe białko, znane jako FUBI, jest kodowane jako białko fuzyjne w FAU gen i jest przetwarzany proteolitycznie w celu wytworzenia wolnego C-końca glicyny, ale nie wykazano eksperymentalnie, że tworzy kowalencyjne modyfikacje białka.
W roślinach
Wiadomo, że genomy roślin kodują co najmniej siedem rodzin UBL oprócz ubikwityny: SUMO , RUB (roślinny homolog NEDD8 ), ATG8 , ATG12 , MUB, UFM1 i HUB1, a także szereg UBL typu II . Niektóre rodziny UBL i związane z nimi białka regulatorowe w roślinach przeszły dramatyczną ekspansję, prawdopodobnie z powodu zarówno duplikacji całego genomu , jak i innych form duplikacji genów ; szacuje się, że rodziny ubikwityny, SUMO, ATG8 i MUB stanowią prawie 90% genów UBL roślin. Białka związane z ubikwityną i sygnalizacją SUMO są silnie wzbogacone w genomy embrionów .
U prokariotów

W porównaniu z eukariontami białka prokariotyczne związane z UBL są filogenetycznie ograniczone. Prokariotyczne białko podobne do ubikwityny (Pup) występuje w niektórych promieniowcach i pełni funkcje ściśle analogiczne do ubikwityny w znakowaniu białek do degradacji proteasomów ; jest jednak wewnętrznie nieuporządkowany , a jego ewolucyjny związek z UBL jest niejasny. Niedawno opisano pokrewne białko UBact w niektórych liniach Gram-ujemnych . Natomiast białko TtuB u bakterii z rodzaju Thermus dzieli fałd beta-chwytu z eukariotycznymi UBL; podaje się, że ma podwójną funkcję zarówno jako siarki , jak i kowalencyjnie sprzężona modyfikacja białka. U archeonów małe białka modyfikujące archeony (SAMP) dzielą fałd beta-chwytu i wykazano, że odgrywają podobną do ubikwityny rolę w degradacji białek. Niedawno w niehodowanym archeonie w 2011 roku zidentyfikowano pozornie kompletny zestaw genów odpowiadający szlakowi ubikwitynowemu podobnemu do eukarionta , a co najmniej trzy linie archeonów — „ Euryarchaeota ”, Thermoproteota (dawniej Crenarchaeota) i „ Aigarchaeota ” — uważa się, że posiadają takie systemy. Ponadto niektóre chorobotwórcze wyewoluowały białka, które naśladują te w eukariotycznych szlakach UBL i oddziałują z UBL w komórce gospodarza , zakłócając ich funkcję sygnalizacyjną.
Rozporządzenie

Regulacja UBL, które są zdolne do koniugacji kowalencyjnej u eukariontów, jest skomplikowana, ale zazwyczaj równoległa dla każdego członka rodziny, najlepiej scharakteryzowana dla samej ubikwityny. Proces ubikwitynacji jest ściśle regulowaną sekwencją trzech etapów: aktywacja, przeprowadzana przez enzymy aktywujące ubikwitynę (E1); koniugacja przeprowadzana przez enzymy sprzęgające ubikwitynę (E2); i ligacja, przeprowadzona przez ligazy ubikwitynowe (E3). Wynikiem tego procesu jest utworzenie wiązania kowalencyjnego między C-końcem ubikwityny a resztą (zwykle lizyna ) na białku docelowym. Wiele rodzin UBL ma podobny trzyetapowy proces katalizowany przez odrębny zestaw enzymów specyficznych dla tej rodziny. Deubikwitynacja lub dekoniugacja - to jest usuwanie ubikwityny z substratu białkowego - jest przeprowadzana przez enzymy deubikwitynujące (DUB); UBL mogą być również degradowane przez działanie proteaz specyficznych dla ubikwityny (ULP). Zakres UBL, na które te enzymy mogą działać, jest zmienny i może być trudny do przewidzenia. Niektóre UBL, takie jak SUMO i NEDD8, mają specyficzne dla rodziny DUB i ULP.
Ubikwityna jest zdolna do tworzenia łańcuchów polimerowych, z dodatkowymi cząsteczkami ubikwityny kowalencyjnie przyłączonymi do pierwszego, który z kolei jest przyłączony do swojego substratu białkowego. Łańcuchy te mogą być liniowe lub rozgałęzione, a różne sygnały regulacyjne mogą być wysyłane przez różnice w długości i rozgałęzieniu łańcucha ubikwityny. Chociaż wiadomo, że nie wszystkie rodziny UBL tworzą łańcuchy, wszystkie łańcuchy SUMO, NEDD8 i URM1 zostały wykryte eksperymentalnie. Ponadto sama ubikwityna może być modyfikowana przez UBL, o których wiadomo, że występują w przypadku SUMO i NEDD8. Najlepiej scharakteryzowane przecięcia między różnymi rodzinami UBL obejmują ubikwitynę i SUMO.
Funkcje komórkowe
UBL jako klasa biorą udział w bardzo dużej różnorodności procesów komórkowych. Ponadto poszczególne rodziny UBL różnią się zakresem swojej aktywności oraz różnorodnością białek, z którymi są skoniugowane. Najbardziej znaną funkcją ubikwityny jest identyfikacja białek, które mają być degradowane przez proteasom , ale ubikwitynacja może odgrywać rolę w innych procesach, takich jak endocytoza i inne formy transportu białek , regulacja transkrypcji i czynników transkrypcyjnych , sygnalizacja komórkowa , modyfikacja histonów i naprawa DNA . Większość innych UBL ma podobne role w regulowaniu procesów komórkowych, zwykle z bardziej ograniczonym znanym zakresem niż sama ubikwityna. SUMO mają najszerszą gamę docelowych białek komórkowych po ubikwitynie i biorą udział w procesach obejmujących transkrypcję , naprawę DNA i komórkową odpowiedź stresową . NEDD8 jest najbardziej znany ze swojej roli w regulacji kulliny białka, które z kolei regulują degradację białek za pośrednictwem ubikwityny, chociaż prawdopodobnie pełni również inne funkcje. W procesie autofagii biorą udział dwa UBL, ATG8 i ATG12 ; oba są niezwykłe, ponieważ ATG12 ma tylko dwa znane substraty białkowe, a ATG8 jest sprzężony nie z białkiem, ale z fosfolipidem , fosfatydyloetanoloaminą .
Ewolucja
Ewolucja UBL i związanych z nimi zestawów białek regulatorowych była przedmiotem zainteresowania od czasu, gdy uznano je za rodzinę. Badania filogenetyczne nadrodziny fałdów białka beta-chwytu sugerują, że eukariotyczne UBL są monofiletyczne , co wskazuje na wspólne pochodzenie ewolucyjne. Uważa się, że systemy regulacyjne UBL – w tym same UBL i kaskada enzymów, które z nimi oddziałują – mają wspólne pochodzenie ewolucyjne z prokariotycznymi biosyntezy dla kofaktorów tiaminy i molibdopteryny ; bakteryjne białka przenoszące siarkę ThiS i MoaD z tych szlaków dzielą fałd beta-chwytu z UBL, podczas gdy podobieństwo sekwencji i wspólny mechanizm katalityczny łączą elementy szlaku ThiF i MoeB z enzymami aktywującymi ubikwitynę . Co ciekawe, eukariotyczne białko URM1 działa zarówno jako białko UBL, jak i białko przenoszące siarkę i zostało opisane jako molekularna skamielina ustanawiająca to ewolucyjne powiązanie.
Porównawcze badania genomiki rodzin UBL i pokrewnych białek sugerują, że sygnalizacja UBL była już dobrze rozwinięta u ostatniego wspólnego przodka eukariotycznego i ostatecznie pochodzi od archeonów przodków , teoria poparta obserwacją, że niektóre genomy archeologiczne posiadają geny niezbędne do w pełni funkcjonującej ubikwitynacji ścieżka. W liniach eukariotycznych zidentyfikowano dwa różne zdarzenia dywersyfikacji w obrębie rodziny UBL, odpowiadające pochodzeniu wielokomórkowości zarówno w liniach zwierzęcych, jak i roślinnych.