UBE2G2
| UBE2G2 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , UBC7, enzym sprzęgający ubikwitynę E2 G2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Enzym sprzęgający ubikwitynę E2 G2 jest białkiem , które u ludzi jest kodowane przez gen UBE2G2 .
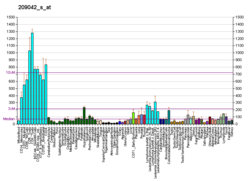
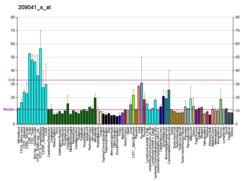
Modyfikacja białek za pomocą ubikwityny jest ważnym mechanizmem komórkowym ukierunkowanym na degradację nieprawidłowych lub krótkotrwałych białek. Ubikwitynacja obejmuje co najmniej trzy klasy enzymów: enzymy aktywujące ubikwitynę lub E1, enzymy sprzęgające ubikwinę lub E2 oraz ligazy ubikwitynowo-białkowe lub E3. Ten gen koduje członka rodziny enzymów koniugujących ubikwitynę E2. Zakodowane białko ma 100% identyczności sekwencji z mysim odpowiednikiem. Ten gen jest wszechobecny, z wysoką ekspresją obserwowaną w dorosłych mięśniach . Dwa łączone alternatywnie dla tego genu znaleziono warianty transkryptu kodujące różne izoformy . Wiadomo, że Ube2g2 oddziałuje z wieloma innymi białkami, w tym z ubikwityną, E3 gp78 i Hrd1 RING.
Dalsza lektura
- Chen P, Johnson P, Sommer T i in. (1993). „Wiele enzymów koniugujących ubikwitynę uczestniczy w degradacji in vivo drożdżowego represora MAT alfa 2”. komórka . 74 (2): 357–69. doi : 10.1016/0092-8674(93)90426-Q . PMID 8393731 . S2CID 205020910 .
- Moynihan TP, Ardley HC, Nuber U i in. (1999). „Enzymy sprzęgające ubikwitynę UbcH7 i UbcH8 oddziałują z domenami HHARI i H7-AP1 zawierającymi motyw palca RING / IBR” . J. Biol. chemia . 274 (43): 30963–8. doi : 10.1074/jbc.274.43.30963 . PMID 10521492 .
- Huang L, Kinnucan E, Wang G i in. (1999). „Struktura kompleksu E6AP-UbcH7: wgląd w ubikwitynację przez kaskadę enzymów E2-E3”. nauka . 286 (5443): 1321-6. doi : 10.1126/science.286.5443.1321 . PMID 10558980 .
- Hattori M, Fujiyama A, Taylor TD i in. (2000). „Sekwencja DNA ludzkiego chromosomu 21” . Natura . 405 (6784): 311–9. Bibcode : 2000Natur.405..311H . doi : 10.1038/35012518 . PMID 10830953 .
- Lenk U, Sommer T (2001). „Proteoliza za pośrednictwem ubikwityny krótkotrwałego białka regulatorowego zależy od jego lokalizacji komórkowej” . J. Biol. chemia . 275 (50): 39403–10. doi : 10.1074/jbc.M006949200 . PMID 10991948 .
- Joazeiro CA, Hunter T (2000). „Biochemia. Ubikwitynacja - więcej niż dwoje do tanga”. nauka . 289 (5487): 2061–2. doi : 10.1126/science.289.5487.2061 . PMID 11032556 . S2CID 83324199 .
- Tiwari S, Weissman AM (2001). „Degradacja podjednostek receptora komórek T związana z retikulum endoplazmatycznym (ER). Zaangażowanie enzymów koniugujących ubikwitynę (E2) związanych z ER” . J. Biol. chemia . 276 (19): 16193–200. doi : 10.1074/jbc.M007640200 . PMID 11278356 .
- Fang S, Ferrone M, Yang C i in. (2002). „Receptor autokrynnego czynnika ruchliwości nowotworu, gp78, jest ligazą białkową ubikwityny zaangażowaną w degradację retikulum endoplazmatycznego” . proc. Natl. Acad. nauka USA . 98 (25): 14422-7. doi : 10.1073/pnas.251401598 . PMC 64697 . PMID 11724934 .
- Strausberg RL, Feingold EA, Grouse LH i in. (2003). „Generowanie i wstępna analiza ponad 15 000 pełnej długości sekwencji cDNA człowieka i myszy” . proc. Natl. Acad. nauka USA . 99 (26): 16899–903. Bibcode : 2002PNAS...9916899M . doi : 10.1073/pnas.242603899 . PMC 139241 . PMID 12477932 .
- Webster JM, Tiwari S, Weissman AM, Wojcikiewicz RJ (2003). „Ubikwitynacja receptora inozytolu 1,4,5-trisfosforanu odbywa się za pośrednictwem Ubc7 ssaków, składnika szlaku degradacji związanego z retikulum endoplazmatycznym, i jest hamowana przez chelatowanie wewnątrzkomórkowego Zn2 +” . J. Biol. chemia . 278 (40): 38238–46. doi : 10.1074/jbc.M305600200 . PMID 12869571 .
- Ota T, Suzuki Y, Nishikawa T i in. (2004). „Kompletne sekwencjonowanie i charakterystyka 21 243 pełnej długości ludzkich cDNA” . Nat. Genet . 36 (1): 40–5. doi : 10.1038/ng1285 . PMID 14702039 .
- Gerhard DS, Wagner L, Feingold EA i in. (2004). „Stan, jakość i ekspansja projektu cDNA pełnej długości NIH: kolekcja genów ssaków (MGC)” . Genom Res . 14 (10B): 2121–7. doi : 10.1101/gr.2596504 . PMC 528928 . PMID 15489334 .
- Rual JF, Venkatesan K, Hao T i in. (2005). „W kierunku mapy w skali proteomu sieci interakcji białko-białko człowieka”. Natura . 437 (7062): 1173-8. Bibcode : 2005Natur.437.1173R . doi : 10.1038/natura04209 . PMID 16189514 . S2CID 4427026 .
- Chen B, Mariano J, Tsai YC i in. (2006). „Aktywność ludzkiej degradacji związanej z retikulum endoplazmatycznym E3, gp78, wymaga domeny Cue, palca PIERŚCIENIOWEGO i miejsca wiązania E2” . proc. Natl. Acad. nauka USA . 103 (2): 341–6. Bibcode : 2006PNAS..103..341C . doi : 10.1073/pnas.0506618103 . PMC 1326157 . PMID 16407162 .
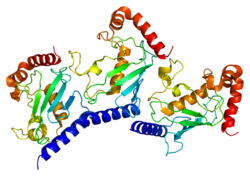
- Arai R, Yoshikawa S, Murayama K i in. (2006). „Struktura ludzkiego enzymu sprzęgającego ubikwitynę E2 G2 (UBE2G2 / UBC7)” . Acta Crystallographica Sekcja F. 62 (cz. 4): 330–4. doi : 10.1107/S1744309106009006 . PMC 2222581 . PMID 16582478 .
- Hu YH, Warnatz HJ, Vanhecke D i in. (2006). „Przeszukiwanie lokalizacji wewnątrzkomórkowej oparte na macierzy komórkowej ujawnia nowe cechy funkcjonalne białek ludzkiego chromosomu 21” . Genomika BMC . 7 : 155. doi : 10.1186/1471-2164-7-155 . PMC 1526728 . PMID 16780588 .
- Ewing RM, Chu P, Elisma F i in. (2007). „Mapowanie na dużą skalę ludzkich interakcji białko-białko za pomocą spektrometrii mas” . Mol. Syst. Biol . 3 (1): 89. doi : 10.1038/msb4100134 . PMC 1847948 . PMID 17353931 .