Gen kodujący białko u gatunku Homo sapiens
UBE2N
Dostępne konstrukcje
WPB Wyszukiwanie ortologów:
Lista kodów identyfikacyjnych PDB
Identyfikatory
, HEL-S-71, UBC13, UBCHBEN; UBC13, UbcH-ben, UbcH13, enzym sprzęgający ubikwitynę E2 N, UBCHBEN
Identyfikatory zewnętrzne
Wikidane
Enzym sprzęgający ubikwitynę E2 N jest białkiem , które u ludzi jest kodowane przez gen UBE2N .
Funkcjonować
Modyfikacja białek za pomocą ubikwityny jest ważnym mechanizmem komórkowym ukierunkowanym na degradację nieprawidłowych lub krótkotrwałych białek. Ubikwitynacja obejmuje co najmniej trzy klasy enzymów: enzymy aktywujące ubikwitynę lub E1, enzymy sprzęgające ubikwitynę lub E2 oraz ligazy ubikwitynowo-białkowe lub E3. Ten gen koduje członka rodziny enzymów koniugujących ubikwitynę E2. Badania na myszach sugerują, że białko to odgrywa rolę w naprawie poreplikacyjnej DNA.
Interakcje
Wykazano, że UBE2N wchodzi w interakcje z:
Dalsza lektura
Bonaldo MF, Lennon G, Soares MB (1997). „Normalizacja i odejmowanie: dwa podejścia ułatwiające odkrywanie genów” . Genom Res . 6 (9): 791–806. doi : 10.1101/gr.6.9.791 PMID 8889548 .
Hofmann RM, Pickart CM (1999). „Niekanoniczne funkcje enzymu koniugującego ubikwitynę kodowane przez MMS2 w składaniu nowych łańcuchów poliubikwityny do naprawy DNA” . komórka . 96 (5): 645–53. doi : 10.1016/S0092-8674(00)80575-9 PMID 10089880 . S2CID 17117789 .
Deng L, Wang C, Spencer E, Yang L, Braun A, Ty J, Ubój C, Pickart C, Chen ZJ (2000). „Aktywacja kompleksu kinazy IkappaB przez TRAF6 wymaga dimerycznego kompleksu enzymu sprzęgającego ubikwitynę i unikalnego łańcucha poliubikwityny” . komórka . 103 (2): 351–61. doi : 10.1016/S0092-8674(00)00126-4 PMID 11057907 . S2CID 18154645 .
Chan NL, Hill CP (2001). „Definiowanie topologii łańcucha poliubikwityny”. Nat. Struktura. Biol . 8 (8): 650–2. doi : 10.1038/90337 . PMID 11473244 . S2CID 16579945 .
Moraes TF, Edwards RA, McKenna S, Pastushok L, Xiao W, Glover JN, Ellison MJ (2001). „Struktura krystaliczna kompleksu enzymu sprzęgającego ludzką ubikwitynę, hMms2-hUbc13”. Nat. Struktura. Biol . 8 (8): 669–73. doi : 10.1038/90373 . PMID 11473255 . S2CID 23504541 .
Ashley C, Pastushok L, McKenna S, Ellison MJ, Xiao W (2002). „Role mysiego UBC13 w naprawie poreplikacyjnej DNA i ubikwitynacji połączonej z Lys63”. gen . 285 (1–2): 183–91. doi : 10.1016/S0378-1119(02)00409-2 . PMID 12039045 .
McKenna S, Moraes T, Pastushok L, Ptak C, Xiao W, Spyracopoulos L, Ellison MJ (2003). „Oparty na NMR model kompleksu koniugacyjnego ludzkiej ubikwityny związanej z ubikwityną Mms2.Ubc13. Strukturalna podstawa katalizy łańcuchowej lizyny 63” . J. Biol. chemia . 278 (15): 13151-8. doi : 10.1074/jbc.M212353200 PMID 12569095 .
Anandasabapathy N, Ford GS, Bloom D, Holness C, Paragas V, Seroogy C, Skrenta H, Hollenhorst M, Fathman CG, Soares L (2003). „GRAIL: ligaza ubikwityny E3, która hamuje transkrypcję genu cytokiny, ulega ekspresji w anergicznych komórkach T CD4 +” . Odporność . 18 (4): 535–47. doi : 10.1016/S1074-7613(03)00084-0 PMID 12705856 .
Ewart-Toland A, Briassouli P, de Koning JP, Mao JH, Yuan J, Chan F, MacCarthy-Morrogh L, Ponder BA, Nagase H, Burn J, Ball S, Almeida M, Linardopoulos S, Balmain A (2003). „Identyfikacja Stk6 / STK15 jako potencjalnego genu podatności na nowotwory o niskiej penetracji u myszy i ludzi”. Nat. Genet . 34 (4): 403–12. doi : 10.1038/ng1220 . PMID 12881723 . S2CID 29442841 .
Bothos J, Summers MK, Venere M, Scolnick DM, Halazonetis TD (2003). „Białko Chfr mitotycznego punktu kontrolnego działa z Ubc13-Mms2, tworząc połączone z Lys63 łańcuchy poliubikwityny” . Onkogen . 22 (46): 7101–7. doi : 10.1038/sj.onc.1206831 PMID 14562038 .
Zhou H, Wertz I, O'Rourke K, Ultsch M, Seshagiri S, Eby M, Xiao W, Dixit VM (2004). „Bcl10 aktywuje szlak NF-kappaB poprzez ubikwitynację NEMO”. Natura . 427 (6970): 167–71. Bibcode : 2004Natur.427..167Z . doi : 10.1038/natura02273 . PMID 14695475 . S2CID 4429582 .
Sun L, Deng L, Ea CK, Xia ZP, Chen ZJ (2004). „Ligaza ubikwitynowa TRAF6 i kinaza TAK1 pośredniczą w aktywacji IKK przez BCL10 i MALT1 w limfocytach T” . Mol. komórka . 14 (3): 289–301. doi : 10.1016/S1097-2765(04)00236-9 PMID 15125833 .
Colland F, Jacq X, Trouplin V, Mougin C, Groizeleau C, Hamburger A, Meil A, Wójcik J, Legrain P, Gauthier JM (2004). „Funkcjonalne mapowanie proteomiki ludzkiego szlaku sygnałowego” . Genom Res . 14 (7): 1324–32. doi : 10.1101/gr.2334104 . PMC 442148 PMID 15231748 .
Pastushok L, Moraes TF, Ellison MJ, Xiao W (2005). „Pojedyncze „kluczowe” wstawienie reszty Mms2 do kieszeni Ubc13 określa specyficzność interfejsu ludzkiego kompleksu koniugacyjnego ubikwityny Lys63” . J. Biol. chemia . 280 (18): 17891–900. doi : 10.1074/jbc.M410469200 PMID 15749714 .
Takeuchi T, Yokosawa H (2005). „Modyfikacja ISG15 Ubc13 hamuje jego aktywność koniugującą ubikwitynę”. Biochem. Biofiza. Rez. Komuna . 336 (1): 9–13. doi : 10.1016/j.bbrc.2005.08.034 . PMID 16112642 .
Zou W, Papov V, Malakhova O, Kim KI, Dao C, Li J, Zhang DE (2005). „Modyfikacja ISG15 ubikwityny E2 Ubc13 zakłóca jej zdolność do tworzenia wiązania tioestrowego z ubikwityną”. Biochem. Biofiza. Rez. Komuna . 336 (1): 61–8. doi : 10.1016/j.bbrc.2005.08.038 . PMID 16122702 .
Galeria WP
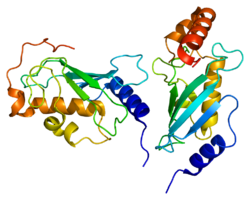
1j7d : Struktura krystaliczna hMms2-hUbc13
2c2v : STRUKTURA KRYSZTAŁOWA KOMPLEKSU CHIP-UBC13-UEV1A