Brugia malajska
|
|
| Brugia malayi | |
|---|---|
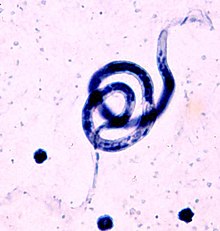
| B. malayi , rozmaz krwi, plama Giemsy | |
| Klasyfikacja naukowa | |
| Królestwo: | Animalia |
| Gromada: | nicienie |
| Klasa: | Chromadorea |
| Zamówienie: | Rhabditida |
| Rodzina: | Onchocercidae |
| Rodzaj: | Brugia |
| Gatunek: |
B. malajski
|
| Nazwa dwumianowa | |
|
Brugia malajska SL Brug, 1927
|
|
Brugia malayi to nicień filarialny ( przenoszony przez stawonogi ) (robak obłe), jeden z trzech czynników sprawczych filariozy limfatycznej u ludzi. Filarioza limfatyczna, znana również jako słoniowatość , jest stanem charakteryzującym się obrzękiem kończyn dolnych. Dwie inne filariozy filariozy limfatycznej to Wuchereria bancrofti i Brugia timori , które różnią się od B. malayi morfologicznie, objawowo i zasięgiem geograficznym.
B. malayi jest przenoszona przez komary Mansonia i jest ograniczona do Azji Południowej i Południowo-Wschodniej. Jest to jedna z chorób tropikalnych, których wyeliminowanie do 2020 roku ma Światowa Organizacja Zdrowia , co pobudziło rozwój szczepionek i leków, a także nowych metod zwalczania wektorów.
Symptomy i objawy
 | |
| Brugia malayi | |
|---|---|
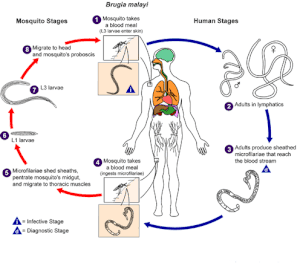
| Cykl życia Brugia malayi . | |
| Specjalność | Choroba zakaźna |
B. malayi jest jednym z czynników sprawczych filariozy limfatycznej , stanu charakteryzującego się infekcją i obrzękiem układu limfatycznego. Choroba jest spowodowana przede wszystkim obecnością robaków w naczyniach limfatycznych i wynikającą z tego reakcją zapalną żywiciela. Objawy zakażenia są zazwyczaj zgodne z objawami obserwowanymi w filariozie Bancrofta – gorączka, zapalenie węzłów chłonnych , zapalenie naczyń chłonnych , obrzęk limfatyczny i wtórne zakażenie bakteryjne – z kilkoma wyjątkami. [ potrzebne źródło ]
Zapalenie węzłów chłonnych
Zapalenie węzłów chłonnych , czyli obrzęk węzłów chłonnych, jest powszechnie rozpoznawanym objawem wielu chorób. Jest to wczesna manifestacja filariozy, zwykle pojawia się w okolicy pachwinowej podczas B. malayi i może wystąpić, zanim robaki dojrzeją.
Zapalenie naczyń chłonnych
chłonnych to zapalenie naczyń limfatycznych w odpowiedzi na infekcję. Występuje na wczesnym etapie infekcji w odpowiedzi na rozwój robaków, linienie, śmierć lub infekcję bakteryjną i grzybiczą. Dotknięte naczynia limfatyczne stają się rozszerzone i tkliwe, a pokrywająca je skóra staje się zaczerwieniona i gorąca. Powstawanie ropnia i owrzodzenie zajętego węzła chłonnego czasami występuje podczas B. malayi , częściej niż w przypadku filariozy Bancrofta. W drenażu wrzodowym można czasami znaleźć pozostałości dorosłych robaków.
Obrzęk limfatyczny
Najbardziej oczywistą oznaką infekcji, słoniowacizny, jest powiększenie kończyn – zwykle nóg. Późne powikłanie zakażenia, słoniowacizna jest formą obrzęku limfatycznego i jest spowodowana powtarzającym się zapaleniem naczyń limfatycznych. Powtarzające się reakcje zapalne powodują rozszerzenie naczyń i pogrubienie dotkniętych naczyń limfatycznych, co może upośledzać ich funkcjonowanie. Układ limfatyczny normalnie działa w celu utrzymania równowagi płynów między tkankami a krwią i służy jako integralna część układu odpornościowego. Zablokowanie tych naczyń spowodowane zwłóknieniem wywołanym stanem zapalnym, martwymi robakami lub reakcjami ziarniniakowymi może zakłócać normalną równowagę płynów, prowadząc w ten sposób do obrzęków kończyn. Słoniowatość wynikająca z B. malayi zazwyczaj atakuje dystalne części kończyn. W przeciwieństwie do filariozy Bancroftian, B. malayi rzadko atakuje genitalia i nie powoduje zapalenia grzybów, zapalenia jąder, zapalenia najądrzy, wodniaka lub chylurii, stanów częściej obserwowanych w przypadku infekcji Bancroftian.
Wtórna infekcja bakteryjna
Wtórna infekcja bakteryjna jest powszechna wśród pacjentów z filariozą. Upośledzona funkcja odpornościowa spowodowana uszkodzeniem układu limfatycznego, a także owrzodzenia węzłów chłonnych i narażenie na ropnie oraz zaburzenia krążenia spowodowane słoniowacicą mogą powodować wtórne infekcje bakteryjne lub grzybicze. Elephantiasis, oprócz fizycznego obciążenia opuchniętą kończyną, może być stanem poważnie osłabiającym, biorąc pod uwagę infekcję bakteryjną. Część „Strategii Eliminacji Filariozy Limfatycznej” WHO dotyczy programów promocji higieny w celu złagodzenia cierpienia osób dotkniętych chorobą (patrz Strategie zapobiegania).
Jednak objawy kliniczne infekcji są zmienne i zależą od kilku czynników, w tym układu odpornościowego gospodarza, dawki zakaźnej i różnic szczepów pasożytów. Większość infekcji przebiega bezobjawowo, ale różni się w zależności od osoby. Osoby żyjące na obszarach endemicznych z mikrofilaremią mogą nigdy nie wykazywać jawnych objawów, podczas gdy w innych przypadkach tylko kilka robaków może zaostrzyć ostrą reakcję zapalną.
Jednak rozwój choroby u ludzi nie jest dobrze poznany. Dorośli zwykle mają gorsze objawy, biorąc pod uwagę długi czas ekspozycji wymagany do infekcji. Zakażenie może wystąpić w dzieciństwie, ale wydaje się, że choroba objawia się dopiero po wielu latach. Okres inkubacji infekcji wynosi od 1 miesiąca do 2 lat i zazwyczaj mikrofilarie pojawiają się przed wystąpieniem jawnych objawów. Obrzęk limfatyczny może rozwinąć się w ciągu sześciu miesięcy, a rozwój słoniowacizny odnotowano w ciągu roku od zakażenia wśród uchodźców, którzy są bardziej naiwni immunologicznie. Mężczyźni mają tendencję do rozwijania gorszych objawów niż kobiety.
Zastępy niebieskie
Gospodarzami B. malayi są koty z Azji Południowo-Wschodniej .
Przyczyna
Koło życia
Rozwój i replikacja B. malayi przebiega w dwóch oddzielnych fazach: u wektora komara i u człowieka. Oba etapy są niezbędne dla cyklu życiowego pasożyta. [ potrzebne źródło ]
Komar: Komar jest wektorem biologicznym i żywicielem pośrednim – jest niezbędny do cyklu rozwojowego i przenoszenia B. malayi . 4. Komar zjada mączkę z ludzkiej krwi i połyka mikrofilarie (jaja w osłonkach podobne do robaków), które krążą w krwioobiegu człowieka. [ potrzebne źródło ] 5-7 U komarów mikrofilarie zrzucają osłonki, penetrują jelito środkowe i migrują do mięśni klatki piersiowej, gdzie mikrofilarie powiększają się, linieją i rozwijają w zakaźne larwy (L1 i L3) na przestrzeni 7 –21 dni. U komara nie występuje namnażanie ani rozmnażanie płciowe mikrofilarii. [ potrzebne źródło ] 8-1 Zakaźne larwy (L3) migrują do gruczołów ślinowych, dostają się do trąbki i uciekają na ludzką skórę, gdy komar pobiera kolejną porcję krwi.
Człowiek: B. malayi podlega dalszemu rozwojowi u ludzi, a także rozmnażaniu płciowemu i produkcji jaj. 1-2 Zakaźne larwy (L3) aktywnie penetrują skórę przez otwór po ukąszeniu i rozwijają się w postaci dorosłych w układzie limfatycznym w ciągu 6 miesięcy. Dorosłe robaki mogą przetrwać w układzie limfatycznym przez 5–15 lat. 3. Dorosłe samce i samice robaków łączą się w pary, a samice produkują średnio 10 000 jaj w osłonkach (mikrofilarii) dziennie. Mikrofilarie dostają się do krwioobiegu i wykazują nocną okresowość i podokresowość. [ potrzebne źródło ] 4. Inny komar pobiera krew i połyka mikrofilarie. Infekcja polega na tym, że komar pobiera krew podczas okresowego epizodu – kiedy mikrofilarie są obecne w krwioobiegu.
Morfologia
Dorosły
Dorosłe robaki przypominają typowe nicienie obłe. Długie i nitkowate B. malayi i inne nicienie posiadają tylko mięśnie podłużne i poruszają się ruchem w kształcie litery S. Dorosłe osobniki są zwykle mniejsze niż dorosłe osobniki W. bancrofti , chociaż wyizolowano kilka osobników dorosłych. Dorosłe samice robaków (50 mm) są większe niż samce (25 mm).
mikrofilarie
B. malayi mają długość 200–275 µm i mają okrągły przedni koniec i spiczasty koniec tylny. Mikrofilarie są otoczone, co mocno zabarwia Giemsa. Pochwa jest w rzeczywistości skorupą jaja, cienką warstwą otaczającą skorupkę jaja, gdy mikrofilarie krążą w krwioobiegu. Mikrofilarie zachowują osłonkę, dopóki nie zostaną strawione w jelicie środkowym komara.
B. malayi przypominają mikrofilarie W. bancrofti i Loa loa z niewielkimi różnicami, które mogą pomóc w diagnostyce laboratoryjnej. Mikrofilarie B. malayi można odróżnić po nieciągłym rzędzie jąder znajdujących się na końcu ogona. Istnieją dwa końcowe jądra, które są wyraźnie oddzielone od innych jąder w ogonie, podczas gdy ogon W. bancrofti nie zawiera jąder, a jądra mikrofilarii Loa loa tworzą ciągły rząd w ogonie. Mikrofilarie B. malayi mają również charakterystyczny stosunek przestrzeni głowowej wynoszący 2: 1.
Rozpowszechnianie się
B. malayi jest przenoszona przez wektora komara. Głównymi wektorami komarów są Mansonia , Anopheles i Aedes . Geograficzne rozmieszczenie choroby zależy zatem od odpowiedniego siedliska lęgowego komarów. [ potrzebne źródło ]
- Nocna forma okresowa jest przenoszona przez komary Mansonia i niektóre komary Anopheline na otwartych bagnach i obszarach uprawy ryżu. Te komary mają tendencję do gryzienia w nocy i wydają się zarażać tylko ludzi. Naturalne infekcje zwierząt są rzadkie, a zwierzęta doświadczalne nie przetrzymują infekcji.
- Nocna forma podokresowa jest przenoszona przez Mansonia na leśnych bagnach, gdzie komary gryzą w cieniu w dowolnym momencie. Powszechne są naturalne infekcje odzwierzęce. Koty, psy, małpy, lorisy, cywety i chomiki zostały z powodzeniem eksperymentalnie zakażone B. malayi od człowieka i mogą służyć jako ważne rezerwuary.
Nagromadzenie wielu zakaźnych ukąszeń komarów - od kilkuset do tysięcy - jest wymagane do ustalenia infekcji. Dzieje się tak, ponieważ kompetentny komar zwykle przenosi tylko kilka zakaźnych larw L3 (patrz Cykl życia ), a mniej niż 10% tych larw przechodzi przez wszystkie niezbędne etapy linienia i rozwija się w dorosłe robaki, które mogą się kojarzyć. Tak więc osoby najbardziej narażone na infekcję to osoby mieszkające na obszarach endemicznych - jest mało prawdopodobne, aby turyści krótkoterminowi rozwinęli filariozę limfatyczną.
Diagnoza
Czułe lub powiększone pachwinowe węzły chłonne lub obrzęk kończyn mogą ostrzegać lekarzy lub urzędników zdrowia publicznego o zakażeniu. [ potrzebne źródło ]
Przy odpowiednim sprzęcie laboratoryjnym badanie mikroskopowe różnicowych cech morfologicznych mikrofilarii w wybarwionych rozmazach krwi może pomóc w postawieniu diagnozy - w szczególności w badaniu części ogonowej, obecności pochewki i wielkości przestrzeni głowowej. Barwienie metodą Giemsy w wyjątkowy sposób zabarwi osłonkę B. malayi na różowo. Jednak znalezienie mikrofilarii na rozmazach krwi może być trudne ze względu na nocną okresowość niektórych form B. malayi . [ potrzebne źródło ]
Testy oparte na PCR są bardzo czułe i mogą być stosowane do monitorowania infekcji zarówno u ludzi, jak i u nosicieli komarów. Jednak testy PCR są czasochłonne, pracochłonne i wymagają sprzętu laboratoryjnego. Filarioza limfatyczna dotyka głównie ludzi biednych, którzy mieszkają na terenach pozbawionych takich zasobów.
Test karty antygenowej ICT jest szeroko stosowany w diagnostyce W. bancrofti , ale komercyjne antygeny B. malayi nie są powszechnie dostępne. Jednak nowe osiągnięcia badawcze pozwoliły zidentyfikować rekombinowany antygen (BmR1), który jest zarówno swoisty, jak i czuły w wykrywaniu przeciwciał IgG4 przeciwko B. malayi i B. timori w teście immunoenzymatycznym i immunochromatograficznym szybkim teście paskowym (Brugia Rapid) . Wydaje się jednak, że immunoreaktywność na ten antygen jest zmienna u osobników zakażonych innymi nicieniami nitkowatymi. Badania te doprowadziły do opracowania dwóch nowych szybkich immunochromatograficznych testów kasetowych IgG4 – WB rapid i PanLF rapid – które wykrywają odpowiednio filariozę Bancrofta i wszystkie trzy gatunki filariozy limfatycznej, z wysoką czułością i selektywnością.
Zapobieganie
Szczepionki
Obecnie nie ma licencjonowanej szczepionki zapobiegającej filariozie limfatycznej. Jednak ostatnie badania przyniosły potencjalne szczepionki z dobrymi wynikami na zwierzętach doświadczalnych. S-transferaza glutationowa, enzym detoksykacyjny występujący w pasożytach wyizolowanych z Setaria cervi , pasożyta filarialnego bydła, zmniejszył obciążenie dorosłymi pasożytami B. malayi o ponad 82% przez 90 dni po leczeniu.
Sterowanie wektorowe
Kontrola wektorów była skuteczna w praktycznie eliminowaniu filariozy limfatycznej w niektórych regionach, ale kontrola wektorów w połączeniu z chemioterapią daje najlepsze wyniki. Sugeruje się, że 11 do 12 lat skutecznej kontroli wektorów może wyeliminować filariozę limfatyczną. Skuteczne metody B. malayi obejmują opryskiwanie domów przy użyciu DDT i moskitier traktowanych środkami owadobójczymi. Larwy Mansonia przyczepiają rurki do oddychania do podwodnych korzeni i roślin, aby przeżyć. Podczas gdy chemiczne larwicydy zapewniły tylko częściową kontrolę, usuwanie roślin może zapobiec rozwojowi wektorów, ale także potencjalnym negatywnym skutkom dla środowiska wodnego. Kontrola wektora filariozy limfatycznej jest zaniedbywana w porównaniu do znacznie bardziej ugruntowanych wysiłków na rzecz kontrolowania wektorów malarii i dengi. Zintegrowane metody zwalczania wektorów powinny być stosowane na obszarach, na których ten sam gatunek komarów jest odpowiedzialny za przenoszenie wielu patogenów.
Kierownictwo
Globalny Sojusz na rzecz Eliminacji Filariozy Limfatycznej został powołany przez Światową Organizację Zdrowia w 2000 roku z dwoma głównymi celami: 1) przerwanie transmisji i 2) złagodzenie cierpienia osób dotkniętych chorobą. Programy masowego leczenia farmakologicznego są główną strategią przerywania transmisji pasożytów, a zarządzanie zachorowalnością, koncentrujące się na higienie, poprawia jakość życia zakażonych osób.
Narkotyki
Celem wysiłków społeczności jest wyeliminowanie mikrofilarii z krwi zakażonych osób, aby zapobiec przeniesieniu na komara. Osiąga się to głównie za pomocą narkotyków. Leczenie B. malayi jest takie samo jak w przypadku filariozy Bancrofta. Dietylokarbamazyna była stosowana w programach masowego leczenia jako skuteczny lek mikrofilarobójczy w kilku miejscach, w tym w Indiach. Podczas gdy dietylokarbamazyna ma tendencję do wywoływania działań niepożądanych, takich jak natychmiastowa gorączka i osłabienie, nie wiadomo, czy powoduje jakiekolwiek długoterminowe działania niepożądane leku. Wykazano, że zabija zarówno dorosłe robaki, jak i mikrofilarie. W Malezji dawki dietylokarbamazyny (6 mg/kg tygodniowo przez 6 tygodni; 6 mg/kg dziennie przez 9 dni) zmniejszyły liczbę mikrofilarii o 80% przez 18–24 miesięcy po leczeniu przy braku zwalczania komarów. Liczba mikrofilarii powoli powraca wiele miesięcy po leczeniu, co wymaga wielokrotnych dawek leku w czasie w celu osiągnięcia długoterminowej kontroli. Nie wiadomo jednak, ile lat masowego podawania leków jest potrzebnych do wyeliminowania transmisji. od 2007 r. potwierdzono przypadki oporności na dietylokarbamazynę.
Wykazano, że pojedyncze dawki dwóch leków (albendazol-dietylokarbamazyna i albendazol-iwermektyna) usuwają 99% mikrofilarii przez rok po leczeniu i pomagają złagodzić słoniowacicę we wczesnych stadiach choroby. Wydaje się, że iwermektyna nie zabija dorosłych robaków, ale służy jako mniej toksyczny mikrofilaricyd.
Od czasu odkrycia znaczenia bakterii Wolbachia w cyklu życiowym B. malayi i innych nicieni, nowe leki były ukierunkowane na endobakterię. Tetracykliny, ryfampicyna i chloramfenikol okazały się skuteczne in vitro, zakłócając linienie larw i rozwój mikrofilarii. Wykazano, że tetracykliny powodują nieprawidłowości w reprodukcji i embriogenezie dorosłych robaków, powodując bezpłodność robaków. Badania kliniczne wykazały skuteczną redukcję Wolbachia i mikrofilarii u pacjentów zakażonych onchocerkozą i W. bancrofti . Te antybiotyki, choć działają nieco bardziej pośrednio, są obiecującymi lekami przeciwfilarialnymi.
Higiena
W przypadku filariozy limfatycznej często obserwuje się wtórną infekcję bakteryjną. Rygorystyczne praktyki higieniczne, w tym codzienne mycie wodą z mydłem oraz dezynfekcja ran, mogą pomóc w leczeniu zainfekowanych powierzchni oraz spowolnić i potencjalnie odwrócić istniejące uszkodzenia tkanek. Promowanie higieny jest niezbędne dla pacjentów z filariozą limfatyczną, biorąc pod uwagę upośledzoną odporność i uszkodzony układ limfatyczny, i może pomóc w zapobieganiu cierpieniu i niepełnosprawności.
Epidemiologia
B. malayi zaraża 13 milionów ludzi w południowej i południowo-wschodniej Azji i odpowiada za prawie 10% wszystkich przypadków filariozy limfatycznej na świecie. Infekcja B. malayi jest endemiczna lub potencjalnie endemiczna w 16 krajach, gdzie najczęściej występuje w południowych Chinach i Indiach, ale występuje również w Indonezji, Tajlandii, Wietnamie, Malezji, na Filipinach i w Korei Południowej. Rozmieszczenie B. malayi pokrywa się z W. bancrofti w tych regionach, ale nie współistnieje z B. timori . Regionalne ogniska endemiczności są częściowo określone przez wektory komarów [ potrzebne źródło ]
Historia
Wyraźny pasożyt
B. malayi została odkryta w 1927 r. przez holenderskiego parazytologa Steffena Lamberta Bruga (1879–1946) (powszechnie znanego w literaturze naukowej jako SL Brug) podczas pracy w Indonezji. Był podobny do innego filarialnego glisty Wuchereria bancrofti (wówczas nazywanego Filaria (Microfilaria) bancrofti ). Ale nowy gatunek ludzkiej filarii na Sumatrze Północnej różnił się zarówno fizjologicznie, jak i morfologicznie od W. bancrofti powszechnie występujących w Dżakarcie. Na podstawie ich podobieństwa i różnic nowy gatunek nazwano Filaria malayi . Pomimo badań epidemiologicznych identyfikujących Filaria malayi w Indiach, Sri Lance, Chinach, Wietnamie Północnym i Malezji w latach trzydziestych XX wieku, hipoteza Lichtensteina i Bruga została zaakceptowana dopiero w latach czterdziestych XX wieku, kiedy Rao i Mapelstone zidentyfikowali dwa dorosłe robaki w Indiach.
Opierając się na podobieństwach z W. bancrofti , Rao i Mapelstone zaproponowali nazwanie pasożyta Wuchereria malayi. Po odkryciu nowych gatunków, takich jak W. pahangi (obecnie B. pahangi ) w 1956 r. i W. patei (obecnie B. patei ) w 1958 r., klasyfikacja naukowa została ponownie oceniona w 1960 r. Buckley zaproponował podział starego rodzaju Wuchereria , na dwa rodzaje, Wuchereria i wprowadził nową Brugię po pierwotnym odkrywcy. Z kolei Wuchereria zawiera tylko W. bancrofti , który jak dotąd zakaża tylko ludzi, a rodzaj Brugia zawiera B. malayi , który zakaża ludzi i zwierzęta, a także inne gatunki odzwierzęce.
Różne szczepy
Turner i Edeson w Malezji odkryli dwa podgatunki zakażającego człowieka B. malayi na podstawie obserwacji różnych wzorców okresowości mikrofilarii. Okresowość odnosi się do wyraźnego szczytu liczby mikrofilarii w ciągu 24 godzin, kiedy mikrofilarie są obecne i wykrywalne we krwi krążącej. Podstawa tego zjawiska pozostaje w dużej mierze nieznana.
- Okresowość nocna: mikrofilarie nie są wykrywalne we krwi przez większą część dnia, ale gęstość mikrofilarii osiąga szczyt między północą a 2 w nocy. [ potrzebne źródło ]
- Nocna podokresowość: mikrofilarie są obecne we krwi przez cały czas, ale pojawiają się w największym zagęszczeniu między południem a 20:00.
Badania
W 2007 roku naukowcy zsekwencjonowali genom Brugia malayi . Zidentyfikowanie genów tego organizmu może doprowadzić do opracowania nowych leków i szczepionek .
Aby rozszyfrować genom, przeprowadzono „sekwencjonowanie strzelby całego genomu”. Stwierdzono, że genom ma rozmiar około 90-95 megabaz. Wyniki sekwencjonowania porównano następnie z wynikami referencyjnego nicienia Caenorhabditis elegans wraz z jego prototypem Caenorhabditis briggsae . Te dwa wolno żyjące nicienie zostały włączone do badania i były ważne z kilku powodów: [ potrzebne źródło ]
- porównanie genomów przy użyciu C. elegans pozwoliło na identyfikację podobnych powiązań w genach
- naukowcy odkryli konserwację genomu z brakiem ochrony na bardziej lokalnym poziomie genów
- wykazało to, że z czasem zaszły przegrupowania między C. elegans a B. malayi i pozwoliło naukowcom zidentyfikować geny lub białka specyficzne dla B. malayi
- te unikalne geny były znaczące, ponieważ mogły doprowadzić do pasożytnictwa obserwowanego u B. malayi i dlatego są potencjalnymi celami przyszłych badań
- naukowcy odkryli konserwację genomu z brakiem ochrony na bardziej lokalnym poziomie genów
- powiązania genów dają wgląd w ewolucyjny trend genów pasożytniczych, co może dostarczyć wskazówek do dalszego wyjaśnienia ich wyjątkowej zdolności do pomyślnego przetrwania przez wiele lat u ludzi
Nowe leki
Porównania sekwencji między dwoma genomami umożliwiają mapowanie ortologów C. elegans na geny B. malayi . Używając ortologicznych (między C. elegans i B. malayi ) i włączając obszerne genomowe i funkcjonalne dane genomowe, w tym ekrany RNAi całego genomu, które już istnieją dla C. elegans , można zidentyfikować potencjalnie istotne geny w B. malayi . Naukowcy mają nadzieję, że uda im się obrać za cel te geny jako potencjalne nowe cele leczenia farmakologicznego. Długowieczność tego pasożyta komplikuje leczenie, ponieważ większość istniejących leków jest ukierunkowana na larwy, a zatem nie zabija dorosłych robaków. Leki często muszą być przyjmowane okresowo przez lata, a robaki mogą wywołać masywną reakcję immunologiczną, gdy umrą i uwolnią obce cząsteczki w organizmie. Leczenie farmakologiczne filariozy nie zmieniło się znacząco od ponad 20 lat, a wraz ze wzrostem ryzyka oporności istnieje pilna potrzeba opracowania nowych terapii lekowych przeciw filariom. Na podstawie sekwencji genomu zidentyfikowano kilka szlaków metabolicznych zawierających dziesiątki produktów genów, które mogą być pomocne w odkryciu bardziej ukierunkowanych i skutecznych terapii lekowych. [ potrzebne źródło ]
- możliwe nowe cele leków obejmują: [ potrzebne źródło ]
- linienie
- receptory jądrowe
- kolageny i przetwarzanie kolagenu
- sygnalizacja neuronalna
- kinom B. malayi
- poleganie na metabolizmie żywiciela ( B. malayi ) i endosymbiontu ( wolbachia ).
Te potencjalne nowe cele dla leków lub szczepionek mogą zapewnić nowe możliwości zrozumienia, leczenia i zapobiegania słoniowaciźnie. [ potrzebne źródło ]
Związek z Wolbachią
Związek między bakteriami Wolbachia a B. malayi nie jest w pełni poznany. Ekstrapolując z badań przeprowadzonych z Wuchereria bancrofti , innym nicieniem powodującym filariozę, Wolbachia może pomagać w embriogenezie robaka, być odpowiedzialna za silne reakcje zapalne makrofagów i choroby filarialnej oraz być powiązana z początkiem obrzęku limfatycznego i ślepoty czasami związanej z B. infekcje malajskie . W badaniu przeprowadzonym przez Uniwersytet w Bonn w Ghanie doksycyklina skutecznie uszczupliła Wolbachię z W. bancrofti . Jest prawdopodobne, że mechanizm doksycykliny jest podobny do mechanizmu innych gatunków filarialnych, tj. dominująca blokada embriogenezy, prowadząca do spadku liczby mikrofilarii zgodnie z ich okresem półtrwania. Może to uczynić leczenie doksycykliną dodatkowym narzędziem w leczeniu chorób związanych z mikrofilarią w filariozie Bancrofta, wraz z fiariozą B. malayi . Przebieg leczenia doksycykliną mógłby być znacznie krótszy, ponieważ spowodowałoby to, że dorosły robak stałby się bezpłodny w jednym zastrzyku, zamiast wielokrotnie celować w uzupełnione larwy, które zabijają obecne terapie, i byłoby mniej skutków ubocznych dla zakażonego osobnika. [ potrzebne źródło ]
Badania transplantacyjne
Innym obiecującym zastosowaniem badań jest obszar badań nad przeszczepami. Ponieważ B. malayi jest pierwszym genomem pasożyta, który został zsekwencjonowany, kluczowe znaczenie ma zrozumienie implikacji dla mechanizmu pasożytnictwa u ludzi. Według dr Alana L. Scotta, współpracownika z Johns Hopkins University, zrozumienie, w jaki sposób określony pasożyt, taki jak B. malayi , może przystosować się do ludzi, może przynieść korzyści medyczne znacznie wykraczające poza leczenie słoniowacizny. Według autora: „Ten robak może przebywać w żywicielu przez lata i niekoniecznie powodować chorobę, w rzeczywistości im mniej choroby ma dana osoba, tym więcej robaków krąży. Teraz, gdy wiemy, że te geny nie istnieją u ludzi możemy je ukierunkować, aby kontrolować choroby”. [ potrzebne źródło ] Niektóre przewidywane białka dla tych nowych genów wydają się być podobne do znanych białek immunomodulatorów, regulatorów układu odpornościowego, co sugeruje, że biorą one udział w dezaktywacji układu odpornościowego żywiciela, aby pasożyt pozostał niewykryty. Znajomość tych wcześniej nieznanych immunosupresorów może być również przydatna w przeszczepach narządów i pomóc w leczeniu chorób autoimmunologicznych. [ potrzebne źródło ]
Zgodnie z projektem Filarial Genome Project prowadzonym przez The Special Program for Research and Training in Tropical Diseases, gen Brugia malayi MIF ulega ekspresji na wszystkich etapach cyklu życiowego pasożyta, a wyniki sugerują, że B. malayi MIF może wchodzić w interakcje z ludzkim organizmem układu odpornościowego w trakcie infekcji poprzez zmianę funkcji makrofagów u zakażonego osobnika. Obecnie prowadzone są badania nad hipotezą, że MIF może być zaangażowany w zmniejszanie odpowiedzi immunologicznej gospodarza na mikrofilarie. Zrozumienie, w jaki sposób ten konkretny pasożyt przystosował się do ludzi, może pomóc naukowcom zajmującym się przeszczepami narządów, zastanawiając się, jak zapobiegać atakowaniu przeszczepionej tkanki przez układ odpornościowy. [ potrzebne źródło ]
Zobacz też
- Artykuł jest oparty na źródle domeny publicznej (strona internetowa rządu USA) Departamentu Zdrowia i Opieki Społecznej USA / Centrum Kontroli Chorób: Filarioza
Linki zewnętrzne
- Film Brugia_life_cycle_and_adults_in_lymphatics autorstwa R. Rao
- Brugia malayi w UMich
- Specjalny program badań i szkoleń w zakresie chorób tropikalnych (TDR). „Analiza funkcjonalna genów Brugia malayi”. 2004
- Uniwersytet w Pittsburghu. „Naukowcy ujawniają genetyczne sekrety wyniszczającego ludzkiego pasożyta” . 20 września 2007 r.
- Hoerauf, Achim. „Kierowanie wolbachii, doksycyklina zmniejsza patologię filariozy limfatycznej”. 18 września 2006.
- Globalny program Światowej Organizacji Zdrowia mający na celu wyeliminowanie Filariozy limfatycznej
- Globalny Sojusz na rzecz Wyeliminowania Filariozy Limfatycznej
- Gideon Chorób Zakaźnych Online
- Biblioteka obrazów pasożytów, Centra Kontroli Chorób