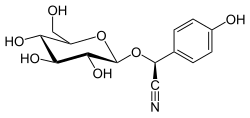
Dhurrin
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
( S )-(β- D -glukopiranozyloksy)(4-hydroksyfenylo)acetonitryl
|
|
|
Preferowana nazwa IUPAC
( S )-(4-hydroksyfenylo){[(2R , 3R , 4S , 5S , 6R ) -3,4,5-trihydroksy-6-(hydroksymetylo)oksan-2-ylo]oksy}acetonitryl |
|
| Inne nazwy ( S )-4-hydroksymandelonitrylo-β- D -glukopiranozyd
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.007.163 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 14 H 17 NIE 7 | |
| Masa cząsteczkowa | 311,29 g/mol |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
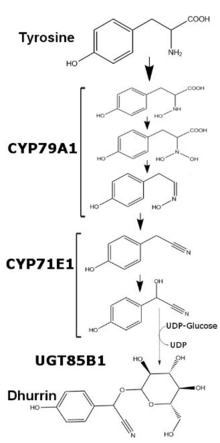
Dhurrin to glikozyd cyjanogenny wytwarzany w wielu roślinach . Odkryty w wielu sorgo w 1906 roku jako sprawca zatrucia bydła cyjanowodorem , dhurrin jest najczęściej kojarzony z Sorghum bicolor , organizmem używanym do mapowania biosyntezy dhurryny z tyrozyny . Imię Dhurrin pochodzi od arabskiego słowa oznaczającego sorgo, transliterowanego na „Dhura”.
Biosynteza
Regulacja w Sorghum bicolor
U Sorghum bicolor produkcja dhurryny jest regulowana na poziomie transkrypcji i zmienia się w zależności od wieku rośliny i dostępnych składników odżywczych. Zawartość dhurryny w S. bicolor można skorelować z ilością mRNA i białka po translacji enzymów CYP79A1 i CYP71E1, dwóch związanych z błoną członków nadrodziny cytochromu P450 . Podczas gdy transkrypcja i translacja tych dwóch enzymów jest stosunkowo wyższa przez pierwsze kilka dni wzrostu, transkrypcja jest znacznie zmniejszona po jednym tygodniu wzrostu. Po pięciu tygodniach wzrostu transkrypcja i translacja obu enzymów w liściach staje się niewykrywalna, podczas gdy łodygi we wspomnianych roślinach utrzymują minimalną produkcję obu enzymów. Po dodaniu nadmiaru azotanów transkrypcja obu enzymów wzrasta, ale nie do poziomów obserwowanych we wczesnym rozwoju. Ostatni enzym w syntezie dhurryny, UGT85B1, jest rozpuszczalnym enzymem, który wymienia glukozę z UDP-glukozy na aglikon dhurryny i tworzy wiązanie glikozydowe .
Synteza transgeniczna
, że dodanie zarówno CYP79A1, jak i CYP71E1 do genomów Arabidopsis thaliana i Nicotiana tabacum jest wystarczające do zajścia produkcji Dhurrin. Oba te enzymy są wystarczające i niezbędne do produkcji dhurryny, ponieważ usunięcie genu CYP79A1 z dwukolorowego genomu Sorghum powoduje, że rośliny nie zawierają dhurryny. Odmiana ta mogłaby teoretycznie zostać wykorzystana jako bezpieczniejsza roślina paszowa w suchych środowiskach, gdzie sorgo jest jedynym dostępnym ziarnem. Biosyntezę dhurryny in vitro skonstruowano zarówno w mikrosomach uzyskanych z sadzonek Sorghum bicolor , jak iw micelach .
Toksyczność
Ssaki
Jelita ssaków zawierają liczne glukozydazy , które skutecznie hydrolizują wiązania glikozydowe. Po hydrolizie wiązania glikozydowego aglikon dhurryny szybko rozkłada się, tworząc cyjanowodór, który jest następnie wchłaniany do krwioobiegu. Śmiertelna dawka dhurryny u ludzi i innych ssaków jest teoretycznie wysoka, ponieważ jedna cząsteczka cyjanowodoru jest wytwarzana na cząsteczkę dhurryny. Zawartość masowa dhurryny w sorgo jest stosunkowo niska w stosunku do ogólnej masy roślinnej. W związku z tym człowiek musiałby zjeść znacznie dużą ilość surowego sorgo, zanim doświadczy skutków ubocznych. W suchych środowiskach sorgo jest najlepszą opcją dla ziarna zbóż i paszy, ponieważ może wytrzymać ekstremalne warunki suszy. Zwierzęta spożywające surowe sorgo jako paszę są znacznie bardziej skłonne do zjedzenia ilości, która zawierałaby śmiertelną dawkę dhurryny dla ich odpowiednich gatunków i może spowodować utratę zwierząt z powodu zatrucia cyjanowodorem.
Jako środek odstraszający owady
W odpowiedzi na zewnętrzne uszkodzenia łodygi odmiany sorgo mogą uwalniać dhurrynę w miejscu uszkodzenia. Wykazano, że ta reakcja odstrasza owady, ponieważ transgeniczne sorgo niezdolne do produkcji dhurryny było silnie faworyzowane przez owady roślinożerne w porównaniu z dzikimi odmianami sorgo.
- ^ Blyth, Alexander Wynter (13 maja 2013). Trucizny: ich skutki i wykrywanie Podręcznik do użytku chemików analitycznych i ekspertów . USA: Charles Griffin and Company. P. 204.
- ^ Busk, Peter Kamp (lipiec 2002). „Synteza dhurryny w sorgo jest regulowana na poziomie transkrypcyjnym i indukowana przez nawożenie azotem starszych roślin” . Fizjologia roślin . 129 (3): 1222–1231. doi : 10.1104/pp.000687 . PMC 166516 . PMID 12114576 .
- ^ Bak, Soren (sierpień 2000). „Transgeniczne rośliny tytoniu i rzodkiewki wykazujące ekspresję dwóch wielofunkcyjnych enzymów cytochromu P450 sorgo, CYP79A1 i CYP71E1, są cyjanogennymi i gromadzą metabolity pochodzące ze związków pośrednich w biosyntezie Dhurrin” . Fizjologia roślin . 123 (4): 1437-1448. doi : 10.1104/pp.123.4.1437 . PMC59100 . _ PMID 10938360 .
- ^ Kahn, RA (grudzień 1997). „Izolacja i rekonstytucja cytochromu P450ox i rekonstytucja in vitro całego szlaku biosyntezy cyjanogennego glukozydu dhurryny z sorgo” . Fizjologia roślin . 115 (4): 1661-1670. doi : 10.1104/pp.115.4.1661 . PMC 158632 . PMID 9414567 .
- ^ Borrell, Andrew K. (2014). „Przystosowanie sorgo pozostającego zielonego do suszy jest związane z rozwojem baldachimu, anatomią liści, wzrostem korzeni i pobieraniem wody” . Dziennik botaniki eksperymentalnej . 65 (21): 6251–6263. doi : 10.1093/jxb/eru232 . PMC 4223986 . PMID 25381433 .
- ^ Krothapalli, Kartikeya (październik 2013). „Forward Genetics przez sekwencjonowanie genomu ujawnia, że szybkie uwalnianie cyjanku odstrasza owady roślinożerne Sorghum Bicolor” . Genetyka . 195 : 309–318. doi : 10.1534/genetyka.113.149567 . PMC 3781961 . PMID 23893483 .