Dyskodermolid

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
(3Z , 5S , 6S , 7S,8R,9S,11Z, 13S , 14S , 15S , 16Z , 18S ) -8,14,18 - Trihydroksy - 19 - [ ( 2S , 3R ,4S , 5R ) -4-hydroksy-3,5-dimetylo-6-oksooksan-2-ylo]-5,7,9,11,13,15-heksametylononadeka-1,3 , Karbaminian 11,16-tetraen-6-ylu |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 33 H 55 NIE 8 | |
| Masa cząsteczkowa | 593,79 g/mol |
| Temperatura topnienia | 112 do 113 ° C (234 do 235 ° F; 385 do 386 K) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
(+)-Discodermolide to naturalny produkt poliketydowy , który stabilizuje mikrotubule . (+)-discodermolide został wyizolowany przez Gunasekera i jego współpracowników z Harbour Branch Oceanographic Institute z głębinowej gąbki Discodermia dissoluta w 1990 roku. Stwierdzono, że (+)-discodermolide jest silnym inhibitorem wzrostu komórek nowotworowych w kilku MDR linie komórek nowotworowych. (+)-diskodermolid wykazuje również pewne unikalne cechy, w tym liniową strukturę szkieletu, właściwości immunosupresyjne zarówno in vitro, jak i in vivo, silną indukcję fenotypu przyspieszonego starzenia oraz synergistyczne działanie antyproliferacyjne w połączeniu z paklitakselem . Discodermolide został uznany za jeden z najsilniejszych naturalnych promotorów tubuliny . Wiele wysiłków zmierzających do całkowitej syntezy (+)-diskodermolidu było ukierunkowanych na jego interesującą aktywność biologiczną i skrajny niedobór naturalnych źródeł (0,002% wag. z zamarzniętej gąbki morskiej). Podaż związku niezbędna do pełnych badań klinicznych nie może zostać zaspokojona przez zbieranie, izolację i oczyszczanie. Od 2005 roku próby syntezy lub półsyntezy przez fermentację okazały się nieskuteczne. W rezultacie cały discodermolid stosowany w badaniach przedklinicznych i badaniach klinicznych pochodzi z całkowitej syntezy na dużą skalę.
Historia
Diskodermolid został po raz pierwszy wyizolowany w 1990 roku z karaibskiej gąbki morskiej Discodermia dissoluta przez chemika dr Saratha Gunasekerę i biologa dr Rossa Longleya, naukowców z Harbour Branch Oceanographic Institution . Gąbka zawierała 0,002% discodermolidu (7 mg/434 g gąbki). Ponieważ związek jest wrażliwy na światło, gąbkę należy zbierać na minimalnej głębokości 33 metrów. Początkowo stwierdzono, że discodermolide ma immunosupresyjne i przeciwgrzybicze . [ potrzebne źródło ]
Struktura
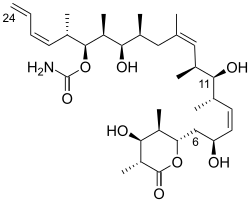
(+) -diskodermolid ma liniowy szkielet polipropionianowy, przerywany wiązaniami Z-olefinowymi przy C (8,9) i C (13,14), końcowy podstawnik Z-dienowy przy C (21–24), 13 centrów stereogenicznych ( w tym cztery drugorzędowe grupy hydroksylowe i siedem podstawników metylowych), karbaminian i całkowicie podstawiony D- lakton . Względną stereochemię określono metodą krystalografii rentgenowskiej . Absolutna stereochemia (+)-diskodermolidu została opisana przez Schreibera i jego współpracowników w 1993 roku. Diskodermolid przyjmuje konformację w kształcie litery U , w której wewnętrzne (Z)-alkeny działają jak blokady konformacyjne, minimalizując oddziaływania allilowe i synpentanowe wzdłuż kręgosłupa. D- lakton jest utrzymywany w konformacji przypominającej łódkę .
Czynności biologiczne
Właściwości immunosupresyjne
Wstępna ocena biologiczna (+)-diskodermolidu przeprowadzona przez grupę Longley wykazała, że ma on właściwości immunosupresyjne zarówno in vitro , jak i in vivo . Odpowiedź immunosupresyjną ) -diskodermolid był nietoksyczny in vitro. Stwierdzono , że zarówno w ludzkich leukocytach krwi obwodowej, jak i mysich splenocytach (+)-diskodermolid hamuje dwukierunkową mieszaną reakcję limfocytów . Ponadto (+)-diskodermolid hamował również odpowiedź mitogenną leukocytów krwi obwodowej . Dalsze eksperymenty wykazały, że (+)-diskodermolid ma również działanie antyproliferacyjne w kilku innych liniach komórek niechłonnych . [ potrzebne źródło ]
Właściwości antyproliferacyjne i antymitotyczne
(+)-Diskodermolid jest bardzo silnym środkiem antyproliferacyjnym . Mysie komórki hybrydoma Do11.10T traktowane (+)-diskodermolidem nie mogły przechodzić normalnego cyklu komórkowego. W nietraktowanych kontrolach 68% komórek znajdowało się w fazie G1, 31% w fazie S, a mniej niż 1% w fazie G2/M. Jednak po 3 godzinach leczenia (+)-diskodermolidem 52% stwierdzono w fazie G1, 40% w fazie S i 58% w fazie G2 i M. Wynik ten wskazuje, że (+)-diskodermolid blokuje cykl komórkowy w fazie G2 i M. Stwierdzono również, że ten efekt hamowania jest odwracalny. Komórki powracają do normalnego cyklu w ciągu 48 godzin po usunięciu (+)-diskodermolidu z pożywki do hodowli komórkowej. (+)-Diskodermolid zatrzymuje cykl komórkowy poprzez wiązanie i stabilizację sieci mikrotubul . Nadmierna stabilizacja wrzeciona mitotycznego powoduje zatrzymanie cyklu komórkowego w fazie G2 i M i ostatecznie prowadzi do śmierci komórki przez apoptozę . W stężeniu 10 µM (+)-diskodermolid jest w stanie promować mikrotubul bez białek związanych z mikrotubulami i GTP. Z białkiem związanym z mikrotubulami i GTP , 10 µM (+)-diskodermolid jest w stanie zainicjować polimeryzację tubuliny w temperaturze 0 ° C.
Silny induktor przyspieszonego starzenia się komórek
(+)-Discodermolide jest w stanie wywołać fenotyp starzenia . Komórki Hela , MDA-MB-231 , HCT-116 i A549 traktowane (+)-diskodermolidem wykazywały umiarkowany do wysokiego poziom aktywności β-galaktozydazy we wszystkich czterech liniach komórkowych. Aktywność β-galaktozydazy jest jedną z cech starzenia . Inne wspólne cechy obejmują ustanie proliferacji i zwiększoną powierzchnię cytoplazmy . (+)-Diskodermolid indukował również regulację w górę i aktywację trzech białek (p66Shc, Erk1 i Erk2).
Środek neuroprotekcyjny
stwierdzono również, że (+)-Discodermolide ma działanie neuroprotekcyjne . Funkcja mikrotubule została wykorzystana do przywrócenia funkcji neuronów, które zostały zakłócone przez sekwestrację wywołaną przez amyloid . Wiadomo, że białko tau stabilizuje mikrotubul w zdrowych neuronach . Służył jako „tor kolejowy”, po którym dostarczane są aktyna, tubulina , mitochondria , enzymy związane z neuroprzekaźnikami i pęcherzyki przenoszące białka przekaźnikowe. Obecność amyloidu w komórce może prowadzić do agregacji białek tau i zmniejszenia liczby mikrotubul . W transgenicznym mysim modelu ludzkiej tauopatii (+)-diskodermolid stabilizuje mikrotubule i przywraca szybki transport aksonalny w komórkach, kompensując utratę funkcji spowodowaną agregacją białka tau . Myszy z upośledzeniem motorycznym wykazywały pełne przywrócenie normalnego ruchu po leczeniu (+)-diskodermolidem.
Silny naturalny promotor składania tubuliny
Diskodermolid konkuruje z paklitakselem o wiązanie z mikrotubulami , ale z większym powinowactwem i jest również skuteczny w komórkach nowotworowych opornych na paklitaksel i epotilon . Wydaje się również, że discodermolide wykazuje niezwykle spójną konformację molekularną 3D w stanie stałym, w roztworze i po związaniu z tubuliną ; cząsteczki o elastyczności konformacyjnej discodermolidu zwykle mają bardzo różne konformacje w różnych środowiskach.
Biosynteza
Wiele poliketydów pochodzenia morskiego, które często występują w gąbkach, nie może zostać wyhodowanych poza ich naturalnym środowiskiem. Znalezienie genów odpowiedzialnych za biosyntezę poliketydów pochodzących z gąbek jest zadaniem trudnym do wykonania ze względu na kolonialny charakter gąbek. Naukowcy nie są jeszcze w stanie hodować gąbek; dlatego geny biosyntezy (+)-diskodermolidu nie zostały jeszcze odkryte.
Syntezy totalne
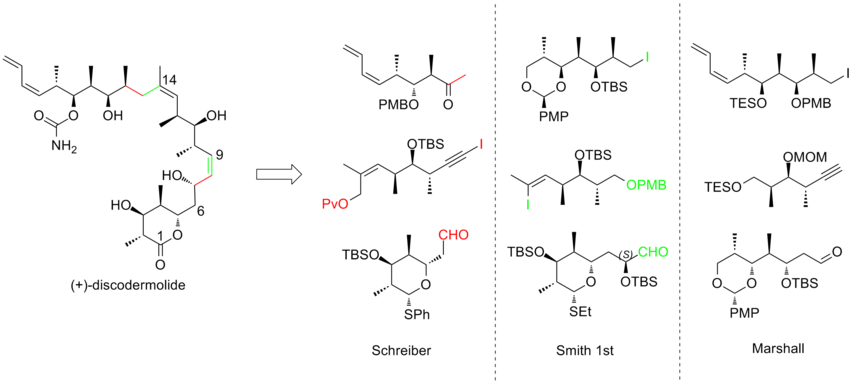
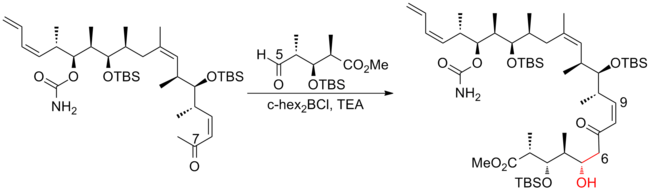
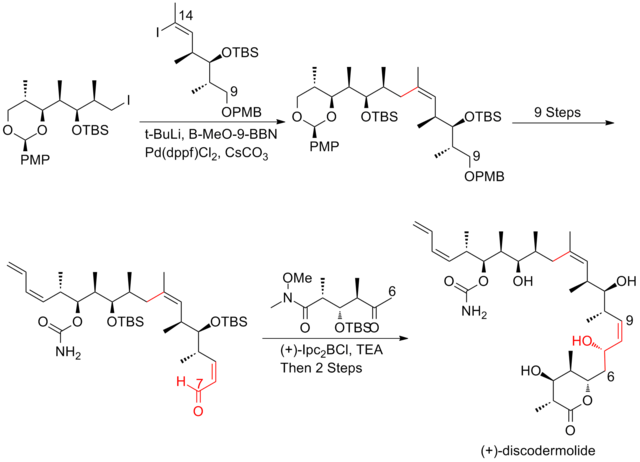
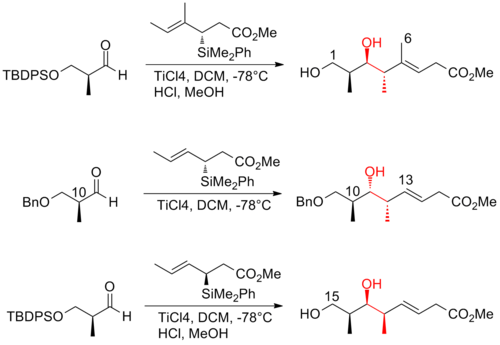
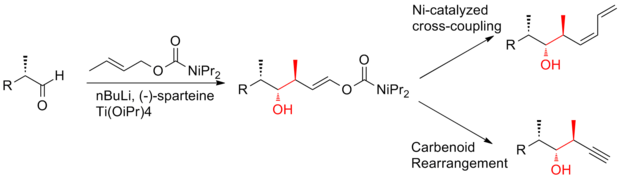
Podjęto intensywne wysiłki w kierunku całkowitej syntezy (+)-diskodermolidu, aby sprostać rosnącemu zainteresowaniu badaniem jego profilu klinicznego . Różne grupy badawcze opublikowały kilkanaście syntez. Po dekadzie prac syntezy discodermolidu stały się bardziej zbieżne i praktyczne. Wszystkie podejścia oparte na całkowitej syntezie rozpoczęto od konstrukcji trzech głównych fragmentów o mniej więcej równoważnej złożoności, z których każdy zawiera triadę metylo-hydroksylo-metylową ciągłych centrów, która odpowiada stereogeniczności docelowego discodermolidu. Oto trzy przykłady retrosyntetycznych analiz (+) -diskodermolidu:
Całkowita synteza nienaturalnego antypodu (-)-diskodermolidu
Synteza Schreibera (-)-diskodermolidu
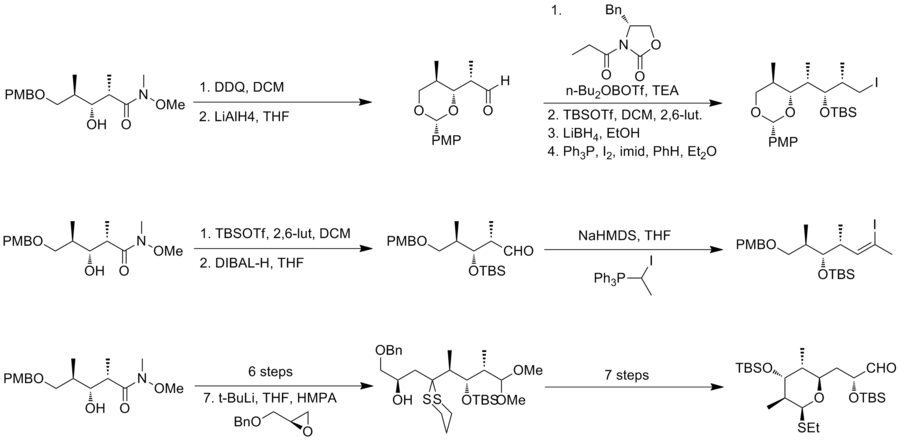
W 1993 roku Schreiber i jego współpracownicy opisali pierwszą całkowitą syntezę nienaturalnego antypodu (-)-diskodermolidu i określili absolutną stereochemię naturalnego produktu. Zespół Schreibera rozpoznał trzy fragmenty o mniej więcej równej złożoności, które są oddzielone jednostkami olefinowymi w discodermolidzie. Dwa materiały wyjściowe, alkohole homoallilowe, łatwo pochodzą od 3-hydroksy-2-metylopropionianu.
Trójpodstawiony (Z)-alken pierwszego fragmentu wytworzono przy użyciu odczynnika Still-Gennari. Odczynnik Gilberta został następnie użyty do homologacji go do acetylenu . Metoda Goekjiana i Kishi została następnie wykorzystana do uzyskania pożądanego fragmentu, jodoacetylenu. Ten sam alkohol homoallilowy przekształcono w diol w czterech etapach. Po utlenieniu do ketoaldehydu homololowano go do dienów przez katalizowane palladem sprzęganie z bromkiem winylocynku w celu wytworzenia drugiego fragmentu. Sześcioczłonowa podjednostka pierścieniowa została przekształcona z acetalu, który otrzymano przez wewnątrzcząsteczkową 1,4-addycję przypuszczalnego półacetalowego związku pośredniego.
Zespół Schreibera odkrył, że NiCl 2 i CrCl 2 skutecznie promują dodawanie jodku alkinylu do aldehydu. Reakcja daje mieszaninę 2:1 pożądanego produktu i jego izomeru . Jednak niepożądany izomer można zawrócić do pożądanego epimeru w trzech etapach, w tym utlenianie Swerna i asymetryczną redukcję Coreya. Pd katalizował częściowe uwodornienie alkinu w celu ustalenia konfiguracji Z na C (8) – C (9). Grupę piwaloiloksylową następnie przekształcono w bromek do końcowego sprzęgania. Stereoselektywne alkilowanie enolanu między bromkiem allilu a enolanem litu pochodzącym z drugiego fragmentu dało mieszaninę izomerów 3:1 i zakończyło tworzenie szkieletu (-)-diskodermolidu. Podczas końcowej konwersji, redukcja ketonu NaBH4 dała dającą się rozdzielić mieszaninę izomerów 2,5:1. Synteza Schreibera (-) -diskodermolidu ma ogólną wydajność 3,2% z najdłuższą liniową sekwencją 24 etapów i łącznie 36 etapów. W 1996 roku grupa Schreibera opublikowała całkowitą syntezę naturalnego discodermolidu z podobną strategią syntezy (całkowita wydajność 4,3%, 36 kroków, 24 kroki najdłuższej sekwencji liniowej.
Synteza pierwszej generacji (-) -diskodermolidu Smitha
W 1995 roku Smith i jego współpracownicy opisali drugą całkowitą syntezę (-)-diskodermolidu. Smith zaadaptował strategię potrójnej zbieżności syntezy Schreibera. W strategii Smitha wszystkie trzy fragmenty miały wspólnego prekursora , który był produktem wysoce wydajnej pięcioetapowej konwersji w skali 50 g z 3-hydroksy-2-metylopropionianu z wydajnością 59%. W celu uzyskania pożądanego efektu stereochemicznego wykorzystano reakcję synaldolową Evansa .
acylooksazolidynonu Evansa . Po zabezpieczeniu grupami hydroksylowymi i redukcyjnym usunięciu chiralnego związku pomocniczego przeprowadzono jodowanie w celu uzyskania fragmentu A. Przygotowanie fragmentu B rozpoczęto od zabezpieczenia TBS i redukcji DIBAL . Otrzymany aldehyd można przekształcić w żądany Z-tripodstawiony halogenek winylu z selektywnością 6:1. Kluczową cechą syntezy fragmentu C było dodanie anionu pochodzącego z ditianu do eteru benzylowo- glicydylowego .
winylu za pośrednictwem palladu (0) z cynkoorganiczną pochodną jodku alkilu daje produkt z wydajnością 66%. Po dwuetapowej konwersji do odpowiedniej fosfoniowej , połączenie Wittiga soli fosfoniowej z aldehydem, fragment C, przebiegało z wydajnością 76% i dobrą selektywnością. Ostatnią cechą tej syntezy była dienu za pośrednictwem tytanu . Synteza (-) -diskodermolidu Smitha ma ogólną wydajność 2,0% przy najdłuższej liniowej sekwencji 29 etapów i łącznie 42 etapów.
Synteza Mylesa (-)-diskodermolidu
W 1997 roku Myles i jego współpracownicy opisali całkowitą syntezę (-) -diskodermolidu przy użyciu alkilowania kontrolowanego przez chelatację jako kluczowego sprzężenia. Za pośrednictwem tytanu reakcja hetero-Delsa-Aldera aldehydu z dienem Danishefsky z powodzeniem wytworzyła wymagającą Z-tripodstawioną olefinę C(13)-C(14) we fragmencie jodku allilu. Stereogeniczność w podjednostce C (16) – C (21) została wywołana przez zastosowanie chemii aldolowej Evansa. Stereogeniczność końcowego fragmentu została ustalona przez asymetryczną allilację promowaną przez cynę . Warto zauważyć, że prawidłowy stopień utlenienia w C(1) tego fragmentu zmniejszyłby liczbę etapów po sprzęganiu fragmentów. Synteza Mylesa (-) -diskodermolidu ma ogólną wydajność 1,5% przy najdłuższej liniowej sekwencji 25 etapów i łącznie 44 etapów.
Całkowita synteza naturalnego antypodu (+)-diskodermolidu
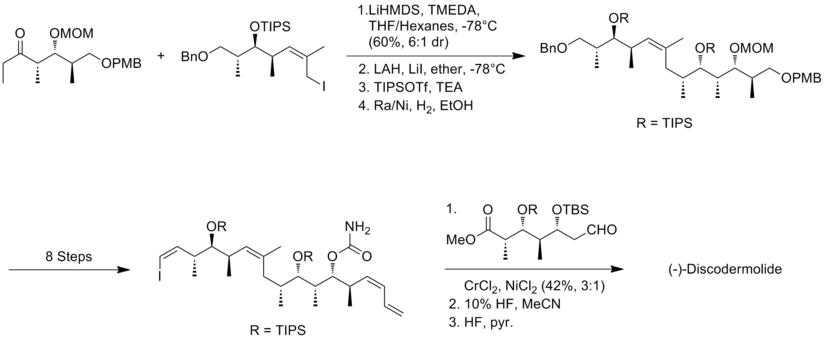
Synteza Marshalla (+)-diskodermolidu
Marshall i jego współpracownicy wykorzystali asymetryczną taktykę allenylmetal-homoaldol do skonstruowania polipropionianowych struktur (+)-diskodermolidu. Nowością podejścia Marshalla jest to, że trzy podjednostki stereotriad są składane przez dodanie nieracemicznych odczynników z metalami allenylowymi do (S)-3-sililoksy-2-metylopropanalu w celu wytworzenia zarówno adduktów syn/syn, jak i syn/anti. Główną cechą syntezy fragmentu jodku alkilu była obróbka aldehydu do allenylotributylostannanu w obecności BF3 w celu uzyskania izomeru syn/syn. Stereotriady syn/anty metylo-hydroksylo-metylowe otrzymano w reakcji między aldehydem a homochiralnym odczynnikiem allenylocynkowym.
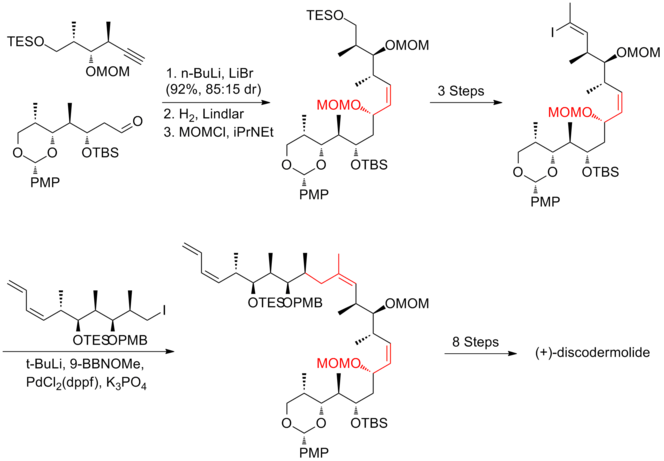
W syntezie Marshalla sprzęganie fragmentu alkinowego z fragmentem aldehydowym przebiegało z wydajnością 92%, z diastereoselektywnością 85:15 . Kondensacja aldehydu z jodoetylidenotrifenylofosforanem była najtrudniejszym etapem, który dał 40% wydajności i nierozłączną mieszaninę 85:15 izomerów (Z) i (E). Ostatnie sprzęganie przeprowadzono poprzez Suzuki jodku winylu z boronianem pochodzącym z jodku alkilu. Synteza Marshalla (+) -diskodermolidu ma ogólną wydajność 1,3% przy najdłuższej liniowej sekwencji 30 etapów i łącznie 48 etapów.
Synteza Evansa (+)-diskodermolidu
Evans i jego współpracownicy opracowali strategię, która w dużej mierze opiera się na asymetrycznej metodologii aldolowej do produkcji szkieletu polipropionianu. Użyli reakcji kondensacji Claisena do skonstruowania C(13)-C(14) tripodstawionej Z-olefiny. Synteza Evansa (+) -diskodermolidu ma ogólną wydajność 6,4% przy najdłuższej liniowej sekwencji 31 etapów i łącznie 49 etapów.
Synteza (+) -diskodermolidu w skali gramowej Smitha
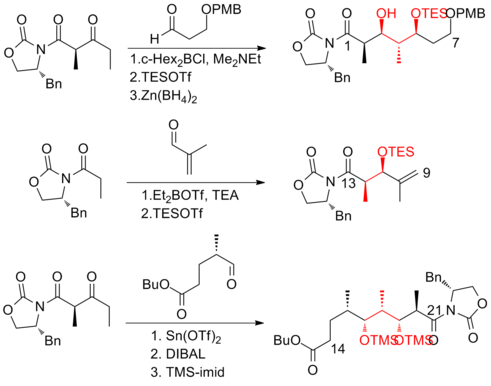
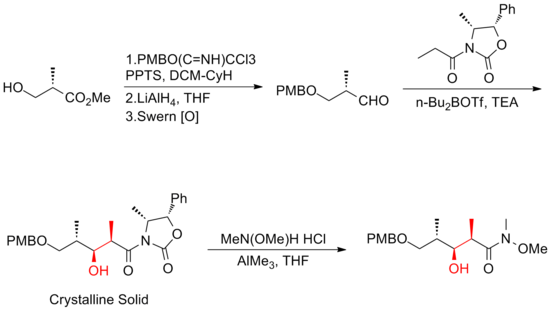
W 1999 roku Smith i jego współpracownicy opisali pierwszą syntezę (+)-diskodermolidu w skali gramowej, co umożliwiło opracowanie (+)-diskodermolidu jako potencjalnego środka chemioterapeutycznego . Ta droga syntezy była licencjonowana dla Novartis Pharmaceuticals . Jednym z głównych ulepszeń było to, że nie było wymagane oczyszczanie w pierwszych czterech etapach pięcioetapowej sekwencji prowadzącej do wspólnego prekursora, ponieważ związek pośredni, addukt aldolowy, jest krystaliczną substancją stałą . Do ustawienia stereogeniczności na C(5) fragmentu laktonu zastosowano kontrolowaną chelatację reakcję Mukaiyama- aldol .
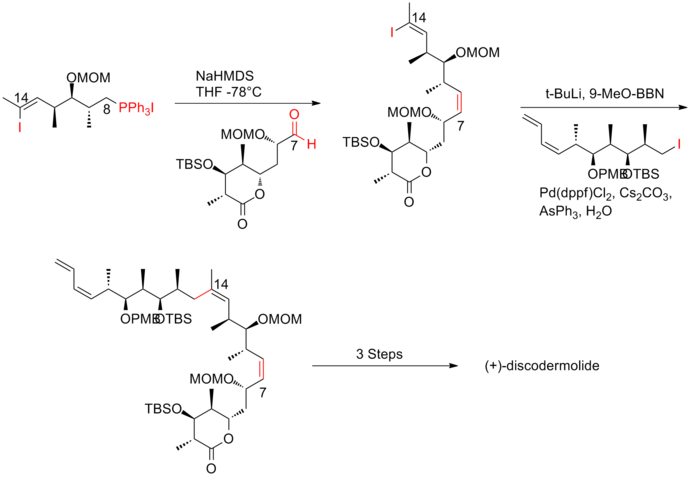
Dwa lata później Smith i jego współpracownicy publikują syntezę trzeciej generacji, w której gruba grupa zabezpieczająca eter TBS przy C(11) prekursora jodku została zastąpiona przez mniej sterycznie obciążającą grupę, MOM. Ta modyfikacja sprzyja tworzeniu pożądanej fosfoniowej . Synteza (+) -diskodermolidu Smitha trzeciej generacji ma ogólną wydajność 6,0% przy najdłuższej liniowej sekwencji 21 etapów i łącznie 35 etapów.
Synteza czwartej generacji Smitha (+) -diskodermolidu
Kluczową cechą podejścia czwartej generacji było wykorzystanie fragmentu dwukierunkowego, jodku winylu/soli fosfoniowej. sól fosfoniową można łatwo otrzymać, ponieważ trójpodstawiony jodek winylu jest mniej reaktywny niż jodek alkilu . Reakcja Wittiga, a następnie sprzęganie Suzuki z jodkiem alkilu skutecznie dostarczyło szkielet (+)-diskodermolidu. Synteza czwartej generacji Smitha (+) -diskodermolidu ma ogólną wydajność 9,0% z najdłuższą liniową sekwencją 17 etapów i łącznie 36 etapów.
Synteza (+) -diskodermolidu pierwszej generacji Patersona
Paterson i jego współpracownicy z University of Cambridge opracowali strategię, która wykorzystuje nowe reakcje aldolowe kontrolowane chelatacją i kontrolowanymi odczynnikami z wysoką selektywnością połączeń podjednostek. Inną cechą tej syntezy była indukcja olefiny C(8)-C(9) o geometrii cis w reakcji Stilla-Gennariego Hornera-Wadswortha-Emmonsa . Synteza (+) -diskodermolidu pierwszej generacji Patersona ma ogólną wydajność 10,3% przy najdłuższej liniowej sekwencji 23 etapów i łącznie 42 etapów.
Druga i trzecia generacja syntez Patersona (+)-diskodermolidu
W 2003 roku Paterson i współpracownicy opisali strategię, która w dużej mierze opiera się na stereokontroli pochodzącej z substratu. Zamiast kontrolowanej odczynnikowo reakcji aldolowej w syntezie Patersona pierwszej generacji, do połączenia C(5)-C(6) zastosowano antyaldol, w którym pośredniczy dicykloheksylobor, co prowadzi do znacznego wzrostu diastereoselektywności z 4: 1 do 92 :8. Warto zauważyć, że zmodyfikowana przez Stilla-Gennariego reakcja Hornera-Wadswortha-Emmonsa została również wykorzystana do skonstruowania trójpodstawionej olefiny C (13) -C (14) na wczesnym etapie tej syntezy. Synteza (+) -diskodermolidu Patersona drugiej generacji ma ogólną wydajność 7,8% z najdłuższą liniową sekwencją 24 etapów i łącznie 35 etapów.
W 2004 roku Paterson i jego współpracownicy ujawnili całkowitą syntezę (+)-diskodermolidu trzeciej generacji. Stopniowa metoda stosowana w poprzednich generacjach do włączania podjednostki C (1) – C (8) została zastąpiona późną olefinacją Still-Gennari, co prowadzi do zauważalnej poprawy konwergencji. Synteza (+) -diskodermolidu trzeciej generacji Patersona ma ogólną wydajność 11,1% (najwyższa dotychczas zgłoszona) z najdłuższą liniową sekwencją 21 etapów i łącznie 37 etapów.
Novartis 60-g całkowita synteza (+)-diskodermolidu
Na początku 2004 roku firma Novartis Pharmaceuticals ujawniła szczegóły syntezy (+)-diskodermolidu w skali 60g. Ta synteza wykorzystywała podejście Smitha w skali gramowej i grę końcową pierwszej generacji Patersona. Ta synteza umożliwia ocenę (+)-diskodermolidu jako środka chemioterapeutycznego in vivo dla dorosłych pacjentów z zaawansowanymi nowotworami litymi w badaniach klinicznych fazy I. Synteza Novartis (+)-diskodermolidu ma ogólną wydajność 0,65% z najdłuższą liniową sekwencją 26 etapów i łącznie 33 etapów.
Całkowita synteza (+)-diskodermolidu Panek
W 2004 roku Panek i jego współpracownicy opisali podejście, które wykorzystuje metodologię budowy wiązań CC na bazie chiralnego krotylosilanu w celu uzyskania absolutnej stereochemii trzech podjednostek (+)-diskodermolidu. Jedną z kluczowych cech podejścia Patersona jest wykorzystanie hydrocyrkonowania -sprzęgania krzyżowego do konstrukcji C13-C14(Z)-olefin. Do łączenia podjednostek stosuje się octanową reakcję aldolową z wysokimi poziomami indukcji 1,5-antystereo i pośredniczoną przez pallad reakcję sprzęgania krzyżowego sp2-sp3. Synteza Paneka (+) -diskodermolidu ma ogólną wydajność 2,1% przy najdłuższej liniowej sekwencji 27 etapów i łącznie 42 etapów.
Całkowita synteza Ardissona (+) -diskodermolidu
W 2008 roku Ardisson i jego współpracownicy opisali strategię, w której wielokrotnie stosuje się reakcję krotytytanowania w celu uzyskania alkoholi homoallilowych (Z) -O-eno-karbaminianowych o doskonałej selektywności. Ta reakcja krotytytanowania nie tylko skutecznie wytwarza triady syn-antymetylo-hydroksy-metylowe (+)-diskodermolidu, ale także daje produkty, które można łatwo przekształcić w końcowy (Z) -dien . C13-C14 (Z)-olefina jest instalowana poprzez wysoce selektywne przegrupowanie dyotropowe. Synteza Ardission (+) -diskodermolidu ma ogólną wydajność 1,6% z najdłuższą liniową sekwencją 21 etapów.
Rozwój kliniczny
Harbor Branch Oceanographic Institution udzielił licencji na (+)-diskodermolid firmie Novartis , która rozpoczęła pierwszą fazę badania klinicznego w 2004 r. Badanie wykazało, że lek powodował minimalną toksyczność i stanowi nowy mechanizm działania. Grupa badawcza Amosa B. Smitha , we współpracy z Kosan Biosciences , prowadzi przedkliniczny program opracowywania leków.
Zobacz też
Linki zewnętrzne
- Wiadomości chemiczne i inżynieryjne: synteza diskodermolidu na większą skalę autorstwa Michaela Freemantle'a
- Chemia i biologia discodermolidu
- Synteza Betzera i Ardissona (+) -diskodermolidu