Korpusy grzybów
Ciała grzybów lub corpora pedunculata to para struktur w mózgu owadów , innych stawonogów i niektórych pierścienic (zwłaszcza gąsienicy Platynereis dumerilii ) . Wiadomo, że odgrywają rolę w uczeniu się i zapamiętywaniu węchowym . U większości owadów ciała grzyba i róg boczny to dwa wyższe obszary mózgu, które otrzymują informacje węchowe z płata anteny poprzez neurony projekcyjne. Zostały one po raz pierwszy zidentyfikowane i opisane przez francuskiego biologa Félixa Dujardina w 1850 roku.
Struktura
Ciała grzybów są zwykle opisywane jako neuropile , czyli gęste sieci wypustek neuronalnych ( zakończeń dendrytów i aksonów ) oraz gleju . Wzięły swoją nazwę od ich z grubsza półkulistego kielicha , wypukłości, która jest połączona z resztą mózgu centralnym przewodem nerwowym lub szypułką .
Większość naszej obecnej wiedzy o ciałach grzybów pochodzi z badań kilku gatunków owadów, zwłaszcza karalucha Periplaneta americana , pszczoły miodnej Apis mellifera , szarańczy i muszki owocówki Drosophila melanogaster . Badania ciał muszek owocówek były szczególnie ważne dla zrozumienia genetycznych podstaw funkcjonowania ciał grzybów, ponieważ ich genom został zsekwencjonowany i istnieje ogromna liczba narzędzi do manipulowania ekspresją ich genów.
W mózgu owada szypułki ciał grzybów rozciągają się przez śródmózgowie . Składają się głównie z długich, gęsto upakowanych włókien nerwowych komórek Kenyona , wewnętrznych neuronów ciał grzybów. Komórki te znaleziono w ciałach grzybów wszystkich badanych gatunków, chociaż ich liczba jest różna. Na przykład muszki owocówki mają około 2500, a karaluchy około 200 000.
Sekcja mózgu szarańczy w celu odsłonięcia centralnego mózgu i przeprowadzenia nagrań elektrofizjologicznych można zobaczyć tutaj.
Funkcjonować
Ciała grzybów są najlepiej znane ze swojej roli w węchowym uczeniu się asocjacyjnym. Te sygnały węchowe są odbierane z neuronów dopaminergicznych , oktopaminergicznych , cholinergicznych , serotonergicznych i GABAergicznych poza MB. Są największe u błonkoskrzydłych , o których wiadomo, że mają szczególnie rozbudowaną kontrolę nad zachowaniami węchowymi. Ponieważ jednak ciała grzybów znajdują się również w anosmii prymitywnych owadów, ich rola prawdopodobnie wykracza poza przetwarzanie węchowe. Badania anatomiczne sugerują rolę w przetwarzaniu wzrokowych i mechanosensorycznych u niektórych gatunków. W szczególności u błonkoskrzydłych podregiony neuropilu ciała grzyba są wyspecjalizowane w odbieraniu bodźców węchowych, wzrokowych lub obu rodzajów bodźców sensorycznych. U błonkoskrzydłych bodźce węchowe są ułożone w kielichu. U mrówek można rozróżnić kilka warstw, odpowiadających różnym skupiskom kłębuszków nerkowych w płatach czułków , być może w celu przetwarzania różnych klas zapachów. Istnieją dwie główne grupy neurony projekcyjne dzielące płat anteny na dwa główne obszary, przedni i tylny. Grupy neuronów projekcyjnych są segregowane, oddzielnie unerwiają grupy kłębuszków nerkowych i wysyłają aksony oddzielnymi drogami, albo przez środkowo-czułkowy układ przedmózgowy (m-APT), albo przez boczny trakt przedmózgowy (l-APT), łącząc się z dwiema warstwami w kielich ciał grzybów. W tych warstwach organizacja dwóch odprowadzających obszarów płata czułkowego jest reprezentowana topograficznie, ustanawiając zgrubną odotopową płata czułkowego w obszarze krawędzi ciał grzybów.
Wiadomo, że ciała grzybów biorą udział w uczeniu się i zapamiętywaniu , szczególnie w zakresie węchu , i dlatego są przedmiotem aktualnych intensywnych badań. W przypadku większych owadów badania sugerują, że ciała grzybów mają inne funkcje uczenia się i pamięci, takie jak pamięć asocjacyjna , filtrowanie sensoryczne, kontrola motoryczna i pamięć miejsca. Badania sugerują, że ciała grzybów generalnie działają jak rodzaj detektora koincydencji , integrując multimodalność danych wejściowych i tworzenie nowych skojarzeń, sugerując w ten sposób ich rolę w uczeniu się i zapamiętywaniu. Ostatnie prace pokazują również dowody na zaangażowanie ciała grzyba we wrodzone zachowania węchowe poprzez interakcje z rogiem bocznym, prawdopodobnie wykorzystując częściowo stereotypowe reakcje czuciowe neuronów wyjściowych ciała grzyba (MBON) u poszczególnych osób. Chociaż połączenia między neuronami projekcyjnymi a komórkami Kenyona są losowe (tj. nie są stereotypowe dla poszczególnych osób), stereotypowość w odpowiedziach MBON jest możliwa dzięki gęstej konwergencji wielu komórek Kenyon na kilka MBON wraz z innymi właściwościami sieci.
Informacje o zapachach mogą być zakodowane w ciele grzyba przez tożsamość reagujących neuronów, jak również czas ich skoków. Eksperymenty na szarańczy wykazały, że komórek Kenyona jest zsynchronizowana z oscylacjami nerwowymi o częstotliwości 20 Hz i są one szczególnie wrażliwe na impulsy projekcyjne neuronów w określonych fazach cyklu oscylacyjnego.
Spać
Neurony, które odbierają sygnały z neuronów serotonergicznych i GABAergicznych poza MB, wywołują stan czuwania, a eksperymentalna stymulacja tych serotonergicznych neuronów w górę rzeki wymusza sen. Docelowe neurony w MB są hamowane przez serotoninę , GABA i kombinację obu. Z drugiej strony oktopamina nie wydaje się wpływać na funkcję snu MB.
muszka owocowa
Wiemy, że struktury ciała grzybów są ważne dla węchowego uczenia się i pamięci u Drosophila , ponieważ ich ablacja niszczy tę funkcję. Ciało grzyba jest również w stanie łączyć informacje z wewnętrznego stanu ciała i bodźców węchowych, aby określić wrodzone zachowanie. Dokładne role określonych neuronów tworzących ciała grzybów są nadal niejasne. Struktury te są jednak szeroko badane, ponieważ wiele wiadomo na temat ich genetycznego składu . Istnieją trzy specyficzne klasy neuronów, które tworzą płaty ciała grzyba: neurony α/β, α'/β' i γ, z których wszystkie mają odrębną ekspresję genów. Tematem obecnych badań jest to, które z tych podstruktur w ciele grzyba są zaangażowane w każdą fazę i proces uczenia się i zapamiętywania. Ciała grzybów Drosophila są również często używane do badania uczenia się i pamięci oraz są manipulowane ze względu na ich stosunkowo dyskretny charakter. Zazwyczaj testy uczenia się węchowego polegają na osobnym wystawianiu much na dwa zapachy; jeden jest sparowany z impulsami wstrząsu elektrycznego ( bodziec warunkowy lub CS +), a drugi nie ( bodziec bezwarunkowy lub US). Po tym okresie treningowym muchy umieszcza się w labiryncie w kształcie litery T z dwoma zapachami umieszczanymi pojedynczo na obu końcach poziomych ramion w kształcie litery „T”. Oblicza się procent much, które unikają CS+, przy czym wysokie unikanie jest uważane za dowód uczenia się i pamięci.
Ślady pamięci komórkowej
Niedawne badania łączące kondycjonowanie zapachu i obrazowanie komórkowe zidentyfikowały sześć śladów pamięci, które pokrywają się ze zmianami molekularnymi w systemie węchowym Drosophila . Trzy z tych śladów są związane z wczesnym kształtowaniem się pamięci behawioralnej. Jeden taki ślad został zwizualizowany w płacie antenowym (AL) przez cząsteczki reporterowe synapto-pHluorin . Natychmiast po kondycjonowaniu dodatkowy zestaw neuronów projekcyjnych w zestawie ośmiu kłębuszków nerkowych w AL zostaje aktywowany synaptycznie przez kondycjonowany zapach i trwa tylko 7 minut. Drugi ślad jest wykrywalny przez GCaMP , a więc wzrost napływu Ca2 + , w aksonach α'/β' neuronów ciała grzyba. Jest to trwalszy ślad, obecny do jednej godziny po kondycjonowaniu. Trzecim śladem pamięciowym jest zmniejszenie aktywności przednio sparowanego neuronu bocznego, który działa jako tłumik tworzenia pamięci poprzez jeden ze swoich hamujących receptorów GABAergicznych . Zmniejszenie odpowiedzi wapniowej neuronów APL i późniejszy spadek GABA uwolnienie na korpusy grzybów utrzymywało się do 5 minut po kondycjonowaniu zapachowym.
Ślad pamięci pośredniej jest zależny od ekspresji genu amn zlokalizowanego w grzbietowych sparowanych neuronach środkowych. Wzrost wapnia i uwalniania synaptycznego, który unerwia ciała grzybów, staje się wykrywalny około 30 minut po sparowaniu porażenia prądem z zapachem i utrzymuje się przez co najmniej godzinę. Oba długoterminowe ślady pamięci, które zostały zmapowane, zależą od aktywności i syntezy białek CREB i CaMKII i istnieją tylko po warunkowaniu przestrzennym. Pierwszy ślad jest wykrywany w neuronach α/β między 9 a 24 godziną po kondycjonowaniu i charakteryzuje się wzrostem wapnia w odpowiedzi na uwarunkowany zapach. Drugi ślad pamięci długoterminowej tworzy się w ciałach grzybów γ i jest wykrywany przez wzrost wapnia między 18 a 24 godzinami po kondycjonowaniu
dynamika cAMP
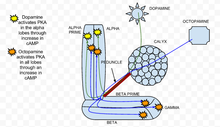
Cykliczny monofosforan adenozyny (cAMP lub cykliczny AMP) jest drugim przekaźnikiem, który bierze udział w ułatwianiu napływu wapnia do ciała grzyba w neuronach ciała grzyba Drosophila melanogaster . Podwyższenie cAMP indukuje plastyczność presynaptyczną u Drosophila. Na poziomy cAMP wpływają zarówno neuroprzekaźniki , takie jak dopamina i oktopamina , jak i same zapachy. Dopamina i oktopamina są uwalniane przez interneurony ciała grzyba , podczas gdy zapachy bezpośrednio aktywują neurony w ścieżce węchowej, powodując napływ wapnia przez kanały wapniowe bramkowane napięciem .
W klasycznym paradygmacie kondycjonowania , parowanie depolaryzacji neuronów (poprzez podanie acetylocholiny w celu przedstawienia zapachu lub CS ) z późniejszym podaniem dopaminy (w celu przedstawienia szoku lub US ) skutkuje synergistycznym wzrostem cAMP w płatach ciała grzyba. Wyniki te sugerują, że płaty ciała grzyba są krytycznym miejscem integracji CS/US poprzez działanie cAMP. Ten synergistyczny efekt został pierwotnie zaobserwowany w Aplysia , gdzie połączono napływ wapnia z aktywacją Sygnalizacja białka G przez serotoninę generuje podobny synergistyczny wzrost cAMP.
Dodatkowo, w tym synergistycznym wzroście cAMP pośredniczy i zależy od cyklazy adenylowej brukwi (rut AC), która jest wrażliwa zarówno na wapń (co wynika z otwierania kanałów wapniowych bramkowanych napięciem przez zapachy), jak i na stymulację białka G (spowodowaną przez dopaminę). Podczas gdy parowanie w przód depolaryzacji neuronów i dopaminy (acetylocholiny, po której następuje dopamina) skutkuje synergistycznym wzrostem cAMP, parowanie w przód depolaryzacji neuronów i oktopaminy daje subaddytywny wpływ na cAMP. Mówiąc dokładniej, oznacza to, że to parowanie wytwarza znacznie mniej cAMP niż suma każdego bodźca z osobna w płatach. Dlatego koleina AC w neuronach ciała grzyba działa jak detektor koincydencji z dopaminą i oktopaminą działającymi dwukierunkowo w celu wpływania na poziomy cAMP.
Dynamika PKA
kinaza białkowa A (PKA) odgrywa ważną rolę w uczeniu się i zapamiętywaniu u Drosophila . Kiedy wapń dostaje się do komórki i wiąże się z kalmoduliną , stymuluje cyklazę adenylanową (AC), która jest kodowana przez gen rutabaga ( rut ). Ta aktywacja AC zwiększa stężenie cAMP , który aktywuje PKA. Kiedy dopamina , awersyjny stymulant węchowy, aktywuje ona PKA specyficznie w pionowych płatach ciała grzyba. Tę specyfikę przestrzenną reguluje nieuk ( dnc ) PDE, fosfodiesteraza specyficzna dla cAMP . Jeśli gen osła zostanie zniesiony, jak stwierdzono w dnc , specyficzność przestrzenna nie zostanie zachowana. W przeciwieństwie do tego, stymulacja apetytu wywołana oktopaminy zwiększa PKA we wszystkich płatach. W koleinowym , genotypie, w którym rutabaga jest zniesiona, reakcje zarówno na dopaminę, jak i oktopaminę były znacznie zmniejszone i zbliżone do szumu eksperymentalnego.
Acetylocholina , która reprezentuje bodziec warunkowy , prowadzi do silnego wzrostu aktywacji PKA w porównaniu ze stymulacją samą dopaminą lub oktopaminą. Ta reakcja jest zniesiona u kolein , co pokazuje, że PKA jest niezbędna do integracji sensorycznej. Specyficzność aktywacji płata alfa w obecności dopaminy jest zachowana, gdy dopamina jest połączona z acetylocholiną. Zasadniczo, podczas paradygmatu warunkowania, gdy bodziec warunkowy jest połączony z bodźcem bezwarunkowym, PKA wykazuje zwiększoną aktywację. To pokazuje, że PKA jest wymagana do warunkowego uczenia się Drosophila melanogaster .
Apis mellifera
Bodziec → reakcje wyjściowe są iloczynem par pobudzenia i hamowania . Jest to ten sam wzorzec organizacji, co w przypadku mózgów ssaków . Te wzorce mogą, podobnie jak u ssaków, poprzedzać działanie. Od 2021 r. jest to obszar dopiero niedawno wyjaśniony przez Zwaka i in. 2018, Duer i in. 2015 oraz Paffhausen i in. 2020.
Zobacz też
Dalsza lektura
- Martina Heisenberga (1998). „Co ciała grzybów robią dla mózgu owadów? Wprowadzenie” . Uczyć się. pam . 5 (1): 1–10. doi : 10.1101/lm.5.1.1 . PMC 311238 . PMID 10454369 .
- SE Fahrbacha (2006). „Struktura ciał grzybów mózgu owadów”. rok ks. Entomol. 51 (3): 209–232. doi : 10.1006/jtbi.2001.2504 . PMID 12183125 .
- López-Riquelme, Germán Octavio (2008). Hormigas como sistemas modelo para el comportamiento complejo. Podstawy neurobiológicas de la comunicación química y la división del trabajo en las hormigas (Ph.D.). Universidad Nacional Autónoma de México. doi : 10.13140/RG.2.1.3145.1689 .