Kwas dihydroksymalonowy
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Kwas dihydroksypropanodiowy |
|
| Inne nazwy Jednowodny kwas mezoksalowy Kwas oksomalonowy jednowodny Kwas ketomalonowy jednowodny |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.008.372 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C3H4O6 _ _ _ _ _ | |
| Masa cząsteczkowa | 136,059 g · mol -1 |
| Temperatura topnienia | 119 do 120 ° C (246 do 248 ° F; 392 do 393 K) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
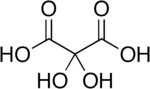
Kwas dihydroksymalonowy jest związkiem organicznym o wzorze C 3 H 4 O 6 lub HO-(C=O)-C(OH) 2- (C=O)-OH, występującym w niektórych roślinach, takich jak lucerna i melasa buraczana .
Związek jest również nazywany kwasem dihydroksymesoksaliowym i kwasem dihydroksypropanodiowym . Może być postrzegany jako uwodniona pochodna kwasu mezoksaliowego i jest często nazywany monohydratem kwasu mezoksaliowego i podobnymi nazwami. Ten związek jest niezwykły, ponieważ zawiera stabilne geminalne grupy hydroksylowe .
Kwas dihydroksymalonowy jest rozpuszczalną w wodzie białą substancją stałą. Krystalizuje w rozpływających się pryzmach , które topią się w temperaturze od 113 ° C do 121 ° C bez utraty wody. Był używany w badaniach medycznych jako środek hipoglikemizujący i został opatentowany w Stanach Zjednoczonych w 1997 roku jako szybko działające antidotum na zatrucie cyjankiem .
Synteza
Kwas dihydroksymalonowy można otrzymać syntetycznie przez hydrolizę alloksanu wodą barytową , ogrzanie kwasu kaffurowego roztworem octanu ołowiu , elektrolizę kwasu winowego w roztworze zasadowym lub z dioctanu gliceryny i stężonego kwasu azotowego na zimno. Produkt można otrzymać również poprzez utlenianie kwasu tartronowego lub glicerolu .
Reakcje
roztworze wodnym jest redukowany amalgamatem sodu do kwasu tartronowego , a także łączy się z fenylohydrazyną i hydroksyloaminą . Redukuje amoniakalne roztwory srebra . Po podgrzaniu z mocznikiem do 100°C tworzy alantoinę . W wyniku dalszego wrzenia wodnego roztworu rozkłada się na dwutlenek węgla i kwas glioksalowy .