Peroksydaza manganu
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| peroksydazy manganowej | |||||||||
| nr WE | 1.11.1.13 | ||||||||
| nr CAS | 114995-15-2 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
W enzymologii peroksydaza manganowa ( EC 1.11.1.13 ) jest enzymem , który katalizuje reakcję chemiczną
- 2 Mn (II) + 2 H. + + H. 2 O 2 2 Mn (III) + 2 H. 2 O
Trzema substratami tego enzymu są Mn(II), H + i H 2 O 2 , podczas gdy jego dwoma produktami są Mn(III) i H 2 O .
Enzym ten należy do rodziny oksydoreduktaz , a konkretnie działających na nadtlenek jako akceptor (peroksydazy). Systematyczna nazwa tej klasy enzymów to Mn(II):oksydoreduktaza nadtlenku wodoru . Inne powszechnie używane nazwy to peroksydaza-M2 i peroksydaza zależna od Mn (utleniająca NADH) . Zatrudnia jednego kofaktora , hemu . Enzym ten do działania potrzebuje Ca 2+ .
Grzyby białej zgnilizny wydzielają ten enzym, aby wspomóc degradację ligniny .
Odkrycie i charakterystyka
Peroksydaza manganowa (powszechnie określana jako MnP) została odkryta w 1985 roku jednocześnie przez grupy badawcze Michaela H. Golda i Ronalda Crawforda w grzybie Phanerochaete chrysosporium . Białko zostało genetycznie zsekwencjonowane w P. chrysoporium w 1989 roku. Uważa się, że enzym jest unikalny dla Basidiomycota , ponieważ nie znaleziono jeszcze żadnego gatunku bakterii , drożdży ani pleśni , które by je naturalnie wytwarzały.
Mechanizm reakcji
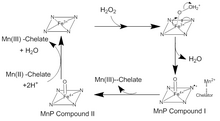
Kataliza MnP zachodzi w serii nieodwracalnych reakcji utleniania-redukcji ( redoks ), które przebiegają zgodnie z mechanizmem ping-ponga z kinetyką drugiego rzędu . W pierwszym etapie cyklu katalitycznego H 2 O 2 , czyli nadtlenek organiczny , wchodzi do miejsca aktywnego MnP. Tam tlen w H 2 O 2 wiąże się z jonem Fe(III) w kofaktorze hemu, tworząc kompleks nadtlenku żelaza. Dwa elektrony są przenoszone z Fe 3+ do nadtlenku, rozrywając wiązanie tlen-nadtlenek, tworząc H2O i kompleks rodnikowy Fe(IV) okso-porfiryny . Ten utleniony związek pośredni jest znany jako związek MnP I. Związek MnP I wiąże się następnie z monochelatowanym Jon Mn(II), który przekazuje elektron w celu wygaszenia rodnika i utworzenia Mn(III) i MnP związku II, kompleksu okso-porfiryny Fe(IV). MnP Związek II utlenia inny jon Mn(II) do Mn(III) i jest redukowany w reakcji dwóch jonów H+ i tlenu związanego z żelazem. To przekształca jon Fe (III) w hemie i uwalnia drugą cząsteczkę wody. Istnieje wiele odstępstw od tego tradycyjnego cyklu katalitycznego. MnP Związek I może być używany do utleniania wolnego Mn(II), żelazocyjanku , a także fenoli i innych związków aromatycznych .
Chelatory
Mn(III) jest niestabilny w środowisku wodnym , dlatego MnP uwalnia go jako chelat Mn(III)-kwasu karboksylowego . Istnieje wiele chelatorów kwasu karboksylowego, w tym szczawian , malonian , winian i mleczan , jednak szczawian jest najczęstszy. Struktura peroksydazy faworyzuje chelaty Mn(III) nad wolnymi jonami Mn(III). Chelat Mn(III) oddziałuje z miejscem aktywnym, ułatwiając uwalnianie produktu z enzymu. Chelator może mieć wpływ na szybkość kinetyczną, a nawet reakcję katalizowaną. Jeśli substrat Mn(II) jest chelatowany z mleczanem, MnP zamiast tego katalizuje wydzielanie O 2 . Jednak ta reakcja uboczna ma niewielki wpływ na aktywność enzymatyczną, ponieważ wynika z wolniejszej kinetyki trzeciego rzędu.
Studia strukturalne
Pod koniec 2007 roku rozwiązano 6 struktur dla tej klasy enzymów o kodach dostępu PDB 1MN1 , 1MN2 , 1YYD , 1YYG , 1YZP i 1YZR .
Chociaż MnP, podobnie jak inne peroksydazy ligninowe , jest peroksydazą klasy II , ma podobną trzeciorzędową strukturę do prokariotycznych peroksydaz klasy I, ale zawiera mostki dwusiarczkowe, takie jak peroksydazy klasy III u roślin. MnP ma strukturę globularną zawierającą 11-12 α-helis, w zależności od gatunku, w którym jest wytwarzany. Jest stabilizowany przez 10 aminokwasowych cystyny , które tworzą 5 mostków dwusiarczkowych, z których jeden znajduje się w pobliżu obszaru C-końca . Miejsce aktywne zawiera kofaktor hemu, który jest związany przez dwa Ca 2+ jony, jeden powyżej i jeden poniżej hemu. W pobliżu wewnętrznego propionianu hemu znajdują się trzy reszty kwasowe , które służą do stabilizacji Mn(II) lub Mn(III), gdy jest on związany z enzymem. Konkretne reszty różnią się między gatunkami, ale ich liczba i względne położenie w sfałdowanym białku jest zachowane. Istnieje łącznie 357 reszt aminokwasowych w MnP P. chrysosoporium i podobna liczba w enzymach wytwarzanych przez inne podstawczaki.
Znaczenie biochemiczne
Główną funkcją jonów Mn(III) wytwarzanych przez MnP jest utlenianie i degradacja ligniny. W tym celu podstawczaki wydzielają raczej MnP niż Mn(III), a enzym działa poza komórką grzyba. Jony Mn(III) z MnP mogą bezpośrednio utleniać związki fenolowe w ligninie, ale mogą również utleniać niektóre organiczne związki siarki i nienasycone kwasy tłuszczowe . To utlenianie tworzy tiylowe i nadtlenowe, które w obecności O 2 mogą utleniać ligninę lub reagować z wodą, tworząc H 2 O 2 . Mn3 + sam jon może degradować ligninę poprzez katalizowanie rozszczepień alkilo - arylowych i utlenianie węgla α w fenolach.
Rozporządzenie
Aktywność MnP jest kontrolowana poprzez regulację transkrypcji . MnP jest regulowany w górę przez wzrost zewnątrzkomórkowych stężeń Mn(II) i H 2 O 2 . Stwierdzono, że zwiększone stężenie O 2 i stres cieplny również aktywują MnP.
Dalsza lektura
- Glenn JK, Akileswaran L, Złoto MH (1986). „Utlenianie Mn (II) jest główną funkcją zewnątrzkomórkowej peroksydazy Mn z Phanerochaete chrysosporium”. Łuk. Biochem. Biofiza . 251 (2): 688–96. doi : 10.1016/0003-9861(86)90378-4 . PMID 3800395 .
- Paszczyński A, Huynh VB, Crawford R (1986). „Porównanie ligninazy-I i peroksydazy-M2 z grzyba białej zgnilizny Phanerochaete chrysosporium”. Łuk. Biochem. Biofiza . 244 (2): 750–65. doi : 10.1016/0003-9861(86)90644-2 . PMID 3080953 .
- Wariishi H, Akileswaran L, Złoto MH (1988). „Peroksydaza manganu z podstawczaka Phanerochaete chrysosporium: charakterystyka widmowa stanów utlenionych i cyklu katalitycznego”. Biochemia . 27 (14): 5365–5370. doi : 10.1021/bi00414a061 . PMID 3167051 .