Stan stacjonarny
| Część serii artykułów o |
| mechanice kwantowej |
|---|
Stan stacjonarny to stan kwantowy , w którym wszystkie obserwabli są niezależne od czasu. Jest to wektor własny operatora energii (zamiast kwantowej superpozycji różnych energii). Jest również nazywany wektorem własnym energii , stanem własnym energii , funkcją własną energii lub ketem własnym energii . Jest bardzo podobny do koncepcji orbitalu atomowego i orbitalu molekularnego w chemii, z pewnymi drobnymi różnicami wyjaśnionymi poniżej .
Wstęp
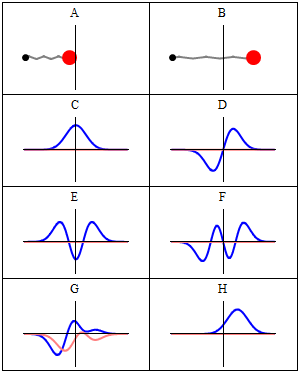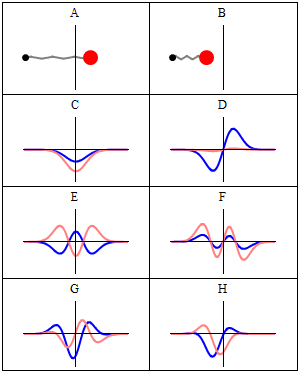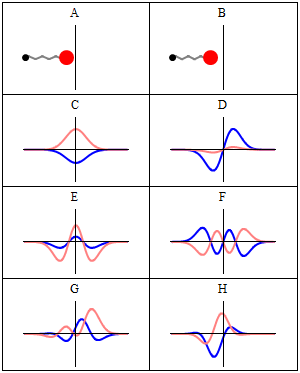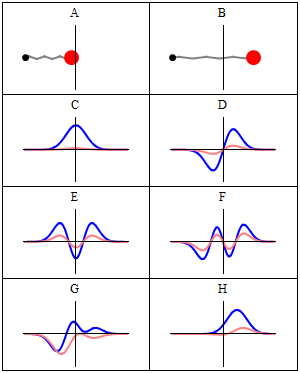
Stan stacjonarny nazywamy stacjonarnym , ponieważ system pozostaje w tym samym stanie w miarę upływu czasu, w każdy możliwy do zaobserwowania sposób. W przypadku hamiltonianu pojedynczej cząstki oznacza to, że cząstka ma stały rozkład prawdopodobieństwa dla swojej pozycji, prędkości, spinu itp . (Jest to prawdą przy założeniu, że środowisko cząstki jest również statyczne, tj. hamiltonian jest niezmienny w czasie). Sama funkcja falowa nie jest stacjonarna: stale zmienia swój ogólny złożony współczynnik fazowy , tworząc falę stojącą . Częstotliwość oscylacji fali stojącej pomnożona przez stałą Plancka jest energią stanu zgodnie z zależnością Plancka-Einsteina .
Stany stacjonarne to stany kwantowe , które są rozwiązaniami niezależnego od czasu równania Schrödingera :
- jest stanem kwantowym , który jest stanem stacjonarnym, jeśli spełnia to równanie;
- jest operatorem Hamiltona ;
- jest liczbą rzeczywistą i odpowiada wartości własnej energii stanu .
To jest równanie wartości własnej jest operatorem liniowym w przestrzeni wektorowej własnym jest jego wartością własną.
Jeżeli stan stacjonarny jest podłączony do zależnego od czasu równania Schrödingera, wynikiem jest
Zakładając, że niezależny od czasu (niezmienny w czasie), to równanie zachodzi przez t . Dlatego jest to równanie różniczkowe opisujące, jak zmienia się w czasie. Jego rozwiązaniem jest
stacjonarny jest falą stojącą , która oscyluje z całkowitym złożonym współczynnikiem fazowym , a częstotliwość kątowa jej oscylacji jest równa jej energii podzielonej .
Właściwości stanu stacjonarnego

Jak pokazano powyżej, stan stacjonarny nie jest matematycznie stały:
Jednak wszystkie obserwowalne właściwości stanu są w rzeczywistości stałe w czasie. Na przykład, jeśli reprezentuje prostą jednowymiarową funkcję falową pojedynczej cząstki , prawdopodobieństwo, że cząstka jest w miejscu x jest
Obraz Heisenberga jest alternatywnym matematycznym sformułowaniem mechaniki kwantowej , w którym stany stacjonarne są naprawdę matematycznie stałe w czasie.
Jak wspomniano powyżej, równania te zakładają, że hamiltonian jest niezależny od czasu. Oznacza to po prostu, że stany stacjonarne są stacjonarne tylko wtedy, gdy reszta systemu jest również nieruchoma i stacjonarna. Na przykład elektron 1s w atomie wodoru jest w stanie stacjonarnym, ale jeśli atom wodoru zareaguje z innym atomem, to oczywiście elektron zostanie zakłócony.
Spontaniczny rozpad
Rozpad spontaniczny komplikuje kwestię stanów stacjonarnych. Na przykład, zgodnie z prostą ( nierelatywistyczną ) mechaniką kwantową , atom wodoru ma wiele stanów stacjonarnych: 1s, 2s, 2p itd. to wszystkie stany stacjonarne. Ale w rzeczywistości tylko stan podstawowy 1s jest naprawdę „stacjonarny”: elektron na wyższym poziomie energii spontanicznie wyemituje jeden lub więcej fotonów , aby rozpaść się do stanu podstawowego. Wydaje się to przeczyć idei, że stany stacjonarne powinny mieć niezmienne właściwości.
Wyjaśnienie jest takie, że hamiltonian używany w nierelatywistycznej mechanice kwantowej jest jedynie przybliżeniem hamiltonianu z kwantowej teorii pola . Stany elektronów o wyższej energii (2s, 2p, 3s itd.) Są stanami stacjonarnymi zgodnie z przybliżonym hamiltonianem, ale nie stacjonarnymi zgodnie z prawdziwym hamiltonianem, z powodu fluktuacji próżni . Z drugiej strony stan 1s jest naprawdę stanem stacjonarnym, zarówno zgodnie z przybliżonym, jak i prawdziwym hamiltonianem.
Porównanie do „orbitalnego” w chemii
Orbital jest stanem stacjonarnym (lub jego przybliżeniem) jednoelektronowego atomu lub cząsteczki; dokładniej orbital atomowy dla elektronu w atomie lub orbital molekularny dla elektronu w cząsteczce.
W przypadku cząsteczki, która zawiera tylko jeden elektron (np. wodór atomowy lub H 2 + ), orbital jest dokładnie tym samym, co całkowity stan stacjonarny cząsteczki. Jednak w przypadku cząsteczki wieloelektronowej orbital jest zupełnie inny niż całkowity stan stacjonarny, który jest stanem wielu cząstek wymagającym bardziej skomplikowanego opisu (takiego jak wyznacznik Slatera ). W szczególności w cząsteczce wieloelektronowej orbital nie jest całkowitym stanem stacjonarnym cząsteczki, ale raczej stanem stacjonarnym pojedynczego elektronu w cząsteczce. Ta koncepcja orbitalu ma sens tylko przy przybliżeniu, że jeśli zignorujemy warunki chwilowego odpychania elektron-elektron w hamiltonianie jako założenie upraszczające, możemy rozłożyć całkowity wektor własny cząsteczki wieloelektronowej na oddzielne wkłady z poszczególnych stanów stacjonarnych elektronów (orbitale), z których każdy uzyskuje się w przybliżeniu jednoelektronowym. (Na szczęście chemicy i fizycy mogą często (ale nie zawsze) używać tego „przybliżenia jednoelektronowego”.) W tym sensie w systemie wieloelektronowym orbital można uznać za stan stacjonarny pojedynczego elektronu w systemie .
W chemii obliczenia orbitali molekularnych zazwyczaj zakładają również przybliżenie Borna-Oppenheimera .
Zobacz też
- Zmiana stanu
- Liczba kwantowa
- Próżnia mechaniki kwantowej lub stan próżni
- Wirtualna cząsteczka
- Stan stabilny
Dalsza lektura
- Stany stacjonarne , Alan Holden, Oxford University Press, 1971, ISBN 0-19-851121-3











