Zespół Birta-Hogga-Dubé
 | |
| Zespół Birt-Hogg-Dubé | |
|---|---|
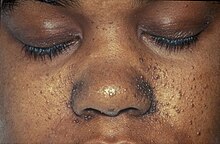
| Charakterystyczne włókniakowłókniaki zespołu Birt-Hogg-Dubé widoczne na twarzy osoby. | |
| Specjalność |
Genetyka medyczna |
Zespół Birt-Hogg-Dubé ( BHD ), także zespół Hornsteina-Birt-Hogga-Dubé , zespół Hornsteina-Knickenberga i włókniakowłókniaki z trichodiscoma i acrochordons to ludzkie autosomalne dominujące zaburzenie genetyczne , które może powodować podatność na raka nerki , torbiele nerkowe i płucne oraz niezłośliwe guzy mieszków włosowych , zwane włókniakami mieszkowymi . Objawy obserwowane w każdej rodzinie są unikalne i mogą obejmować dowolną kombinację tych trzech objawów. Najczęstszą manifestacją są włókniaki mieszkowe, które występują na twarzy i górnej części tułowia u ponad 80% osób z BHD w wieku powyżej 40 lat. Torbiele płuc są równie częste (84%), ale tylko 24% osób z BHD ostatecznie doświadcza zapaści płuca ( spontaniczna odma opłucnowa ). Guzy nerek, zarówno nowotworowe, jak i łagodne, występują u 14–34% osób z BHD; powiązane raki nerki są często rzadkimi nowotworami hybrydowymi.
Każdy z tych stanów, który występuje w rodzinie, może wskazywać na rozpoznanie zespołu Birt-Hogg-Dubé, chociaż jest to potwierdzone jedynie testem genetycznym na mutację w genie FLCN , który koduje białko folikulinę . Chociaż jego funkcja nie jest w pełni poznana, wydaje się, że jest to supresorowy guza , który ogranicza wzrost i podział komórek. Wersje FLCN znaleziono u innych zwierząt, w tym muszek owocowych , owczarków niemieckich , szczurów i myszy . Chorobę odkryto w 1977 r., ale związek z FLCN został wyjaśniony dopiero w 2002 r., po tym, jak rak nerki, zapadnięte płuca i torbiele płuc zostały ostatecznie połączone z BHD.
Zespół Birta-Hogga-Dubé może objawiać się podobnie do innych chorób, które należy wykluczyć przy stawianiu diagnozy. Należą do nich stwardnienie guzowate , które powoduje zmiany skórne podobne do włókniakowłókniaków oraz choroba von Hippla-Lindaua , która powoduje dziedziczne nowotwory nerek. Po zdiagnozowaniu osoby z BHD leczy się zapobiegawczo, monitorując nerki i płuca za pomocą obrazowania medycznego . Fibrofolliculoma można usunąć chirurgicznie, a odma opłucnowa i rak nerki są leczone zgodnie z normalnym standardem opieki. Należy również rozważyć wykonanie badań dermatologicznych, USG szyi i kolonoskopii [1] .
Symptomy i objawy
Skóra
Zespół Birt-Hogg-Dubé wpływa na skórę i zwiększa ryzyko nowotworów nerek i płuc. Stan ten charakteryzuje się wieloma niezłośliwymi, kopulastymi guzami mieszków włosowych ( fibrofolliculoma ) , szczególnie na twarzy, szyi i rzadziej w górnej części klatki piersiowej. Włókniakowłókniaki są ogólnie opisywane jako mające nieprzejrzysty biały kolor lub żółtawy odcień i mają woskowatą, gładką teksturę. Guzy zawsze znajdują się na nosie i wokół niego oraz na uchu zewnętrznym i za nim . Zazwyczaj pojawiają się po raz pierwszy u osób w wieku 20 lub 30 lat i występują u ponad 80% osób z zespołem powyżej 40 roku życia. Z czasem guzy stają się większe i liczniejsze. Guzy różnią się u poszczególnych osób; mogą wyglądać na połączone w blaszki , przypominać zaskórniki z czopem keratynowym lub zawierać torbiele naskórkowe . Duża liczba guzów na twarzy może być związana z nadmiernym łojotokiem (nieprawidłowo podwyższona łoju ). Obecność fibrofolliculoma na twarzy osoby może powodować znaczny stres psychiczny .
Inne nowotwory mogą obejmować rzęsistkowate (guzy krążka włosowego , które mogą być identyczne z włókniakowłókniakami), naczyniakowłókniaki i włókniaki okołomieszkowe . Jednak naczyniakowłókniaki występują częściej w stwardnieniu guzowatym. Wraz z guzami u osób z zespołem Birt-Hogg-Dubé obserwuje się inne choroby skóry. Około 40% osób lub rodzin z tą chorobą ma grudki w jamie ustnej, które mogą znajdować się na policzkach ( błona śluzowa policzków ), języku, dziąsłach lub wargach. Białe lub koloru błony śluzowej, są dyskretne, małe i miękkie i składają się z tkanki włóknistej pokrytej pogrubionym nabłonkiem . W niektórych rodzinach występują również kolagenoma skóry. Wiele osób z BHD ma zmiany skórne, które wydają się być akrochordami (znacznikami skórnymi), ale zamiast tego mogą to być włókniaki mieszkowe. Zmiany te są zwykle zlokalizowane pod pachami , na powiekach iw fałdach skóry. Nie u wszystkich osób rozwijają się guzy twarzy; w niektórych rodzinach z mutacją, która powoduje BHD, rozwijają się tylko guzy nerek lub samoistna odma opłucnowa.
Nerki

Osoby w wieku powyżej 20 lat z BHD mają zwiększone ryzyko rozwoju wolno rosnących guzów nerek ( odpowiednio chromofobowy rak nerki i onkocytoma nerki ), torbieli nerki i prawdopodobnie guzów w innych narządach i tkankach. Guzy te często występują w obu nerkach iw wielu miejscach w każdej nerce. Średnia liczba guzów nerki stwierdzanych u osoby z BHD wynosi 5,3, chociaż znaleziono do 28 guzów. Hybrydowy rak onkocytarno-chromofobowy, występujący w 50% przypadków, jest najczęściej wykrywanym nowotworem, a następnie rak chromofobowy nerki, rak jasnokomórkowy nerki, onkocytoma nerki i rak brodawkowaty nerki . Osoby w wieku powyżej 40 lat i mężczyźni są bardziej narażeni na rozwój guzów nerek, które są diagnozowane średnio w wieku 48 lat. Rak nerki związany z BHD diagnozowano u osób w wieku zaledwie 20 lat.
Ogólnie rzecz biorąc, osoby z tym zespołem są mniej więcej siedem razy bardziej narażone na raka nerki w porównaniu z populacją zdrową. Szacunki zapadalności wśród osób z tą chorobą wahają się od 14 do 34%. Rzadko wiąże się z rakiem jasnokomórkowym nerki i rakiem brodawkowatym nerki . Jeśli rozwinie się u osoby z BHD, rak nerkowokomórkowy pojawia się w późniejszym okresie życia i ma złe rokowanie. Chociaż typy nowotworów zwykle związane z BHD są uważane za mniej agresywne, u osób z zespołem obserwowano przypadki zaawansowanego lub przerzutowego raka nerki. Zarówno guzy łagodne, jak i nowotworowe mogą z czasem zmniejszać czynność nerek , gdy stają się większe.
Płuca
Wraz z włókniakami pęcherzykowymi i guzami nerek u osób dotkniętych chorobą często rozwijają się torbiele ( pęcherzyki lub pęcherze ) w podopłucnowej podstawie płuc lub przestrzeni śródmiąższowej , które mogą pęknąć i spowodować nieprawidłowe gromadzenie się powietrza w jamie klatki piersiowej ( odma opłucnowa ), co może doprowadzić do zapaści płuca. Torbiele nie powodują innych objawów, a czynność płuc jest zwykle prawidłowa. Ponad 83% osób z BHD ma torbiele, ale zespół ten nie powoduje stanów takich jak postępująca przewlekła obturacyjna choroba płuc lub uogólniona niewydolność oddechowa , chociaż powoduje rozedmę płuc . Spontaniczna, czasami nawracająca odma opłucnowa występuje znacznie częściej i w młodszym wieku z BHD niż w populacji zdrowej. Około 24% osób z tą chorobą ma co najmniej jedną samoistną odmę opłucnową, 30 razy częściej niż u osób zdrowych. Chociaż odma opłucnowa spowodowana przez BHD często występuje w średnim wieku, przy medianie wieku 38 lat, 17% dotkniętych nią osób ma samoistną odmę opłucnową przed ukończeniem 40. roku życia. Odmę opłucnową obserwowano u osób w wieku od 7 do 16 lat. Niektóre rodziny mają postać BHD, która wpływa tylko na płuca.
Inne narządy
Guzki tarczycy są związane z fenotypem Birt-Hogg-Dubé, obecnym u 65% osób i 90% rodzin z zespołem. Jednak związek między BHD a rakiem tarczycy nie został potwierdzony. Zgłaszano, że inne stany są powiązane, ale mogą nie być spowodowane mutacją w FLCN lub mogą w ogóle nie być powiązane. Należą do nich: wole wieloguzkowe , rak rdzeniasty tarczycy , onkocytoma ślinianki przyusznej , polipowatość okrężnicy , znamię tkanki łącznej , tłuszczaki , naczyniakotłuszczaki , gruczolaki przytarczyc , nakrapiana chorioretinopatia, nerwiak , oponiaki , naczyniakowłókniaki twarzy, trichoblastomy , skórna mucynoza ogniskowa, mięśniak gładkokomórkowy skóry , rak piersi , raka migdałków , raka jelita grubego , mięsaka nogi, raka płuc, czerniaka , guzowatego włókniakomięsaka skóry , raka podstawnokomórkowego , mięśniakomięsaka gładkokomórkowego skóry i raka płaskonabłonkowego .
Patofizjologia
Genetyka

Powiązanie z genem folikuliny ( FLCN ) po raz pierwszy opisano w 2002 r. Ten 14- eksonowy gen znajduje się na krótkim ramieniu chromosomu 17 (17p11.2) i ma region bogaty w cytozynę w eksonie 11, szczególnie podatny na mutację. Najczęstszą mutacją w tym regionie jest insercja lub delecja reszty cytozyny, występująca w 53% rodzin dotkniętych BHD. Nie stwierdzono znaczących różnic w objawach doświadczanych przez rodziny z insercją w tym miejscu w porównaniu z tymi, które mają delecję, ale mutacje w FLCN związane z zespołem BHD są heterogenne i często są mutacjami nonsensownymi lub mutacjami z przesunięciem ramki odczytu , które powodują wczesne skrócenie produkt białkowy na końcu karboksylowym . Bardzo rzadko obserwuje się mutacje zmiany sensu . Mutacje w genie FLCN, które powodują zespół Birta-Hogga-Dubé, są mutacjami germinalnymi, co oznacza, że występują w każdej komórce organizmu i mogą być przekazywane następnym pokoleniom. Mutacje te są często przekazywane z pokolenia na pokolenie w sposób autosomalny dominujący, ale mogą wystąpić jako nowa mutacja u osoby bez wcześniejszej historii rodziny ( mutacja de novo ). Każde dziecko chorego rodzica ma 50% szans na zachorowanie. BHD ma bardzo wysoką penetrację . Nie wykryto korelacji między różnymi genotypami i fenotypami FLCN .
Funkcjonować
FLCN tworzy białko, folikulinę, która ma dwie izoformy . Wydaje się, że działa jako supresor guza i jest silnie wyrażany w skórze, dystalnych nefronach i pneumocytach typu I. Stwierdzono również w śliniance przyusznej , mózgu, piersiach , trzustce , prostacie i jajnikach . Supresory nowotworów zwykle zapobiegają zbyt szybkiemu lub niekontrolowanemu wzrostowi i podziałowi komórek. Mutacje w FLCN mogą zakłócać zdolność folikuliny do hamowania wzrostu i podziału komórek, prowadząc do powstawania guzów nienowotworowych i nowotworowych. Ostatnie badania sugerują, że folikulina spełnia tę funkcję poprzez udział w metabolizmie komórkowym , prawdopodobnie poprzez modulację szlaku mTOR (ssaczego celu rapamycyny ) i/lub fosforylację oksydacyjną w mitochondriach . Folliculin oddziałuje z FNIP1 i FNIP2 (białko oddziałujące z FLCN), tworząc kompleks z kinazą białkową aktywowaną przez AMP . Udział Folliculiny w szlaku mTOR może wyjaśniać podobieństwo fenotypu między zespołem BHD, zespołem Cowdena, stwardnieniem guzowatym i zespołem Peutza-Jeghersa .
Większość mutacji powodujących raka powoduje skrócenie białka na końcu karboksylowym. Wykazano, że C-końcowy koniec folikuliny jest domeną, przez którą oddziałuje z FNIP1, a tym samym prawdopodobnie szlakiem mTOR. FLCN jest wysoce konserwatywny u kręgowców - jest bardzo podobny u wielu gatunków kręgowców. Na 508. aminokwas , zwykle lizynę , wpływa mutacja zmiany sensu u niektórych osób z BHD. Stwierdzono, że lizyna w tej pozycji jest konserwowana między ortologami folikuliny bezkręgowców i kręgowców, co wskazuje, że jest ważna dla funkcji białka.

Osoby z BHD rodzą się z jedną zmutowaną kopią genu FLCN w każdej komórce. Haploinsuficjencja — posiadanie tylko jednej funkcjonalnej kopii genu FLCN — wystarcza do wywołania włókniakowłókniaków i torbieli płucnych, chociaż jedna kopia genu wystarcza do kontrolowania komórek nerki. Podczas życia człowieka przypadkowe mutacje mogą dezaktywować normalną kopię genu w podzbiorze komórek. Kiedy tak się dzieje, w rezultacie komórki te nie mają funkcjonalnych kopii genu FLCN , co pozwala komórkom wymknąć się spod kontroli. Ta utrata heterozygotyczności jest powszechnym mechanizmem w raku i jest często wykrywana w raku nerki związanym z BHD. Molekularne defekty genetyczne w guzach nerki u osób z BHD różnią się od dwóch innych podobnych guzów nerki, chromofobowego raka nerkowokomórkowego i onkocytoma nerki . Nowotwory związane z BHD różnią się między nerkami, gdzie utrata heterozygotyczności FLCN jest odpowiedzialna za nowotwory, a skórą, gdzie FLCN ulega silnej ekspresji w heterozygotach. Stwierdzono, że FLCN ulega nadekspresji w tkance włókniakowłókniaka i ma bardzo niski poziom ekspresji w dotkniętych chorobą nerkach. Ponadto wykazano, że szlak mTOR jest aktywowany w tkance nowotworowej zarówno u ludzi, jak i myszy.
Wykazano, że cystogeneza nerek i nowotworzenie w BHD są napędzane przez konstytutywną aktywację TFEB.
Diagnoza
BHD można zasugerować na podstawie wyników badań klinicznych, ale definitywnie diagnozuje się ją za pomocą molekularnych testów genetycznych w celu wykrycia mutacji w genie FLCN . Klasyczna triada kliniczna obejmuje łagodne rozrosty mieszków włosowych, torbiele płucne i samoistną odmę opłucnową oraz obustronne, wieloogniskowe guzy nerek.
Triada kliniczna
Skórne objawy BHD pierwotnie opisywano jako włókniakowłókniaki (nieprawidłowy rozrost mieszków włosowych), rzęsistkowate (zmiany hamartomatyczne z mieszkiem włosowym na obwodzie, często spotykane na twarzy) i akrochordony (znaczniki skórne). Objawy skórne są potwierdzone badaniem histologicznym . Większość osób (89%) z BHD ma liczne torbiele w obu płucach, a 24% miało jeden lub więcej epizodów odmy opłucnowej. Torbiele można wykryć za pomocą tomografii komputerowej klatki piersiowej . Guzy nerek mogą manifestować się jako wiele typów raka nerkowokomórkowego, ale częściej obserwuje się pewne patologiczne podtypy (w tym guzy chromofobowe , onkocytoma i hybrydowe nowotwory onkocytarne). Chociaż pierwotny zespół został odkryty na podstawie zmian skórnych, osoby z BHD mogą wykazywać jedynie zmiany w płucach i/lub nerkach, bez żadnych zmian skórnych. Chociaż te objawy wskazują na BHD, jest to potwierdzone jedynie testem genetycznym FLCN .
Badania genetyczne
FLCN są wykrywane przez sekwencjonowanie u 88% probantów z tym zespołem. Oznacza to, że niektóre osoby z rozpoznaniem klinicznym mają mutacje, których nie można wykryć za pomocą obecnej technologii, lub że mutacje w innym obecnie nieznanym genie mogą być odpowiedzialne za mniejszość przypadków. Ponadto testowane są również amplifikacje i delecje w regionach eksonowych . Testy genetyczne mogą być przydatne do potwierdzenia diagnozy klinicznej i zapewnienia możliwości określenia innych osób z grupy ryzyka w rodzinie, nawet jeśli nie rozwinęły się jeszcze u nich objawy BHD.
Diagnostyka różnicowa
BHD może być trudna do zdiagnozowania na podstawie samych objawów, ponieważ dziedziczne raki nerek, odma opłucnowa i guzy skóry występują wraz z innymi zespołami. Dziedziczne obustronne, wieloogniskowe guzy nerki, podobne do obserwowanych w BHD, mogą wystąpić w przypadku choroby von Hippla-Lindaua (rak jasnokomórkowy nerki), dziedzicznego raka brodawkowatego nerki (rak brodawkowaty nerkowokomórkowy) oraz dziedzicznej mięśniakowatości gładkokomórkowej i zespołu raka nerkowokomórkowego . Różnicuje się je badaniem histologicznym guzów.
Dziedziczna nawracająca odma opłucnowa lub torbiele płuc są związane z zespołem Marfana , zespołem Ehlersa-Danlosa , zespołem stwardnienia guzowatego , niedoborem alfa1-antytrypsyny i mukowiscydozą . Niedziedziczna nawracająca odma opłucnowa i/lub torbiele płuc mogą wystąpić z histiocytozą komórek Langerhansa i limfangioleiomiomatozą . Warunki te można odróżnić od BHD poprzez zbadanie historii pacjenta i wykonanie badania fizykalnego. konieczne może być wykluczenie endometriozy płucnej lub klatki piersiowej.
Chociaż włókniakowłókniaki są unikalne dla BHD, mogą mieć niejednoznaczny wygląd i muszą zostać potwierdzone histologicznie. Inne choroby mogą naśladować objawy dermatologiczne BHD, w tym zespół stwardnienia guzowatego, zespół Cowdena , rodzinne trichoepitelioma i mnoga endokrynologiczna neoplazja typu 1 . Należy rozróżnić stwardnienie guzowate, ponieważ oba zaburzenia mogą objawiać się naczyniakowłókniakami na twarzy, chociaż częściej występują w stwardnieniu guzowatym.
Kierownictwo
Różne przejawy BHD są kontrolowane na różne sposoby. Włókniakowłókniaki można usunąć chirurgicznie, poprzez wyłyżeczkowanie , wycięcie przez golenie , odnawianie powierzchni skóry lub ablację laserową ; nie jest to jednak trwałe rozwiązanie, ponieważ guzy często nawracają. Badanie dermatologiczne co 6-12 miesięcy ze względu na ryzyko wystąpienia czerniaka . Co roku należy rozważyć wykonanie USG tarczycy/przyusznic . Należy rozważyć wykonanie kolonoskopii . Objawy nerkowe i płucne leczy się zapobiegawczo: zaleca się regularne wykonywanie tomografii komputerowej, ultrasonografii lub rezonansu magnetycznego nerek, a członkom rodziny zaleca się niepalenie. MRI są preferowaną metodą monitorowania nerek u osób z BHD, ponieważ nie niosą ze sobą takiego samego ryzyka powikłań popromiennych jak tomografia komputerowa i są bardziej czułe niż ultradźwięki. Palacze z Birt-Hogg-Dubé mają cięższe objawy płucne niż osoby niepalące. Chociaż nefrektomia , guzy nerki w przypadkach BHD są często usuwane bez pobierania całej nerki, w częściowej nefrektomii . Badania na myszach z nokautem wykazały, że podawanie rapamycyny może złagodzić wpływ mutacji FLCN na nerki i poprawić rokowanie w raku nerki z powodu interakcji folikuliny ze szlakiem mTOR.
Epidemiologia
Zaburzenie zostało zgłoszone w ponad 100 rodzinach na całym świecie, chociaż niektóre źródła podają nawet 400 rodzin i jest dziedziczone w sposób autosomalny dominujący. Uważa się, że jest niedodiagnozowana ze względu na zmienność jej ekspresji. Wzorzec mutacji i spektrum objawów są różne u poszczególnych osób. Mniej nasilone fenotypy skórne obserwuje się u kobiet i osób obojga płci, u których objawy skórne pojawiają się późno.
Rejestr pacjentów
Zachęcamy pacjentów, rodziny i opiekunów z zespołem Birt-Hogg-Dubé do przyłączenia się do Rejestru Kontaktowego Konsorcjum ds. Rzadkich Chorób Płuc NIH . Jest to witryna chroniona prywatnością, która zawiera aktualne informacje dla osób zainteresowanych najnowszymi wiadomościami naukowymi, badaniami i metodami leczenia rzadkich chorób płuc.
Historia
Zespół ten został po raz pierwszy dobrze opisany w 1977 roku przez trzech kanadyjskich lekarzy: Arthura R. Birta, Georginę R. Hogga i Williama J. Dubé. Najwcześniejszy przypadek możliwej BHD w literaturze medycznej opublikowali Burnier i Rejsek w 1927 r., którzy opisali przypadek włókniaków okołomieszkowych na twarzy 56-letniej kobiety. Trichodiscomas zostały po raz pierwszy opisane w 1974 roku przez HS Zackheima i H. Pinkusa, ale nie były związane z BHD aż do Birta, Hogga i Dubé. Pierwszy przypadek BHD z objawami ogólnoustrojowymi został opisany przez Hornsteina i Knickenberga u dwojga rodzeństwa i ich ojca, u których u wszystkich występowały polipy jelita grubego i charakterystyczne włókniakowłókniaki. Chociaż rodzeństwo nie miało objawów nerkowych ani płucnych, ich ojciec miał cysty w płucach i nerkach. Zespół Hornsteina-Knickenberga to obecnie przestarzała nazwa dziedzicznych włókniakowłókniaków nieodłącznie związanych z BHD.
Birt, Hogg i Dubé zbadali rodzinę z dziedzicznym rakiem tarczycy i odkryli, że wielu członków miało włókniakowłókniaki, trichodiscoma i acrochordony, które zostały zdefiniowane jako klasyczne objawy choroby o tej samej nazwie. Pierwszy przypadek samoistnej odmy opłucnowej związanej z BHD stwierdzono w 1986 roku; pierwszy przypadek raka nerki miał miejsce w 1993 r., a obecność torbieli w płucach u osób z BHD potwierdzono w 1999 r. Kiedyś uważano, że osoby z BHD są bardziej narażone na polipy jelita grubego i nowotwory , ale zostało to obalone. Fundacja BHD wspiera badania nad zespołem i organizuje regularne sympozja poświęcone BHD i pokrewnym zaburzeniom dla badaczy, klinicystów i członków rodziny.
Inne zwierzęta
Geny związane z FLCN i chorobami podobnymi do BHD znaleziono u psów, muszek owocowych, szczurów i myszy. U owczarków niemieckich mutacje zmiany sensu w psim ortologu FLCN powodują fenotyp podobny do ludzkiego BHD — raki nerki (w tym przypadku wieloogniskowy gruczolakorak nerki) i guzy skóry (guzkowate zwłóknienie skóry). Mieli podobny wzór nowotworzenia do ludzkiego BHD, ponieważ zmiany skórne były heterozygotyczne pod względem FLCN , a guzy nerek były prawdopodobnie spowodowane utratą heterozygotyczności. Samice owczarków niemieckich z FLCN są również podatne na mięśniaki macicy .
Homolog FLCN o nazwie DBHD został odkryty u muszki owocowej, Drosophila melanogaster . Zmniejszenie ekspresji DBHD powoduje utratę komórek macierzystych męskiej linii germinalnej (GSC), co sugeruje, że DBHD jest wymagana do utrzymania męskiego GSC w jądrach muchy. Ponadto DBHD reguluje utrzymanie GSC w dół lub równolegle do szlaków transdukcji sygnału JAK/STAT i Dpp, co sugeruje, że BHD reguluje nowotworzenie poprzez kontrolowanie komórek macierzystych u ludzi {Singh i in. 2006}
Japońscy naukowcy opracowali linię szczurów z dziedzicznym rakiem nerki. Mają mutację w FLCN , który wytwarza skrócone białko, chociaż nie rozwijają objawów skórnych ani płucnych obserwowanych u ludzi. Heterozygoty mają nieprawidłowości nerek obserwowane bardzo wcześnie w życiu, które rozwijają się w nowotwory jasnokomórkowe i hybrydowe, znacznie skracając długość życia zwierząt; są również podatne na endometrium i gruczołów ślinowych , a także rabdomiolizę . Homozygoty nie przeżywają do narodzin. FLCN typu dzikiego , fenotyp został uratowany.
Myszy z nokautem zostały stworzone dla raka nerki powodującego mutację BHD; heterozygoty rozwijają torbiele nerek i guzy, które prowadzą do niewydolności nerek w ciągu trzech tygodni od urodzenia. U tych myszy szlak mTOR był niewłaściwie aktywowany, co wskazuje, że mysi homolog FLCN odgrywa rolę regulacyjną w tym szlaku. Rapamycyna częściowo uratowała fenotyp poprzez regulację mTOR. Homozygoty umierają w macicy .
Cytaty
Bibliografia
- Ayo, Dereje S.; Aughenbaugh, GL; Yi, ES; Ręka, JL; Ryu, JH (2007), "Cystic Lung Disease in Birt-Hogg-Dubé Syndrome", Chest , 132 (2): 679-84, doi : 10.1378/chest.07-0042 , PMID 17505035
- Birt, AR; Hogg, GR; Dubé, WJ (1977), „Dziedziczne liczne włókniakowłókniaki z trichodiscomas i acrochordons”, Archives of Dermatology , 113 (12): 1674–7, doi : 10.1001/archderm.113.12.1674 , PMID 596896
- BHD Foundation , 2013, zarchiwizowane od oryginału w dniu 11 czerwca 2021 r. , Pobrane 17 lipca 2013 r.
- Chan-Smutko, Gayun (2012), „Testowanie genetyczne przez miejsce raka”, The Cancer Journal , 18 (4): 343–9, doi : 10.1097/PPO.0b013e31826246ac , PMID 22846736
- Coleman, Jonathan A; Russo, Paul (2009), „Dziedziczny i rodzinny rak nerki”, Current Opinion in Urology , 19 (5): 478–85, doi : 10.1097/MOU.0b013e32832f0d40 , PMID 19584731
- Devine, Megan Stuebner; Garcia, Christine Kim (2012), „Genetyczna choroba śródmiąższowa płuc”, Clinics in Chest Medicine , 33 (1): 95–110, doi : 10.1016/j.ccm.2011.11.001 , PMC 3292740 , PMID 22365249
- Furuya, M.; Nakatani, Y. (2012), „Zespół Birta-Hogga-Dubego: cechy kliniczno-patologiczne płuc”, Journal of Clinical Pathology , 66 (3): 178–86, doi : 10.1136/jclinpath-2012-201200 , PMC 3595143 , PMID 23223565
- „Zespół Birta-Hogga-Dubé” , Genetics Home Reference , US National Library of Medicine, styczeń 2013 , pobrano 13 lipca 2013
- „Zespół Birta-Hogga-Dubé: zasoby edukacyjne” , Genetics Home Reference , NIH, 22 lipca 2013 r., zarchiwizowane z oryginału w dniu 15 marca 2016 r. , pobrane 25 lipca 2013 r.
- Grant, Luizjana; Babar, J.; Griffin, N. (2009), „Cysty, ubytki i plastry miodu w zaburzeniach wieloukładowych: diagnostyka różnicowa i ustalenia dotyczące cienkiego przekroju CT”, Clinical Radiology , 64 (4): 439–48, doi : 10.1016/j.crad. 2008.09.015 , PMID 19264190
- James, William D.; Berger, Tymoteusz; Elston, Dirk (2011), Andrew's Diseases of the Skin: Clinical Dermatology (wyd. 11), Elsevier Health Sciences, ISBN 978-1-4377-3619-9
- Kniffin , Cassandra L. 22 _ ( sierpnia 2012 )
- Liu, Wei; Chen, Zhi; Mamo, Yansen; Wu, Xiaochun; Jin, Yaping; Hou, Steven (2013), White-Cooper, Helen (red.), „Charakterystyka genetyczna genu zespołu Drosophila Birt-Hogg-Dubé”, PLOS ONE , 8 (6): e65869 , Bibcode : 2013PLoSO ... 865869L , doi : 10.1371/journal.pone.0065869 , PMC 3684598 , PMID 23799055
- Maher, Eamonn R. (2011), „Genetyka rodzinnego raka nerek”, Nephron Experimental Nephrology , 118 (1): e21–6, doi : 10.1159/000320892 , PMID 21071978 , S2CID 23464317
- Menko, Fred H.; Van Steensel, Maurice AM; Giraud, Zofia; Friis-Hansen, Lennart; Richard, Stéphane; Ungari, Silvana; Nordenskjöld, Magnus; Hansen, Thomas VO; Solly, John; Maher, Eamonn R; European Bhd, Consortium (2009), „Zespół Birta-Hogga-Dubé: diagnoza i zarządzanie”, The Lancet Oncology , 10 (12): 1199–206, doi : 10.1016/S1470-2045 (09) 70188-3 , PMID 19959076
- BHD Foundation , National Organization for Rare Disorders, 2013, zarchiwizowane z oryginału w dniu 3 listopada 2013 r ., pobrane 25 lipca 2013 r.
- Nickerson, Michael L.; Warren, Michelle B.; Toro, Jorge R.; Matrosowa, Wiera; Glenn, Gladys; Turner, Maria L.; Duray, Paweł; Merino, Maria; Choyke, Peter; i in. (2002), „Mutacje w nowym genie prowadzą do nowotworów nerek, defektów ściany płuc i łagodnych guzów mieszków włosowych u pacjentów z zespołem Birt-Hogg-Dubé”, Cancer Cell , 2 (2 ) : 157–64 , doi : 10.1016/S1535-6108(02)00104-6 , PMID 12204536
- Palmirotta, Raffaele; Savonarola, Annalisa; Ludovici, Giorgia; Donati, Pietro; Kawaler, Francesco; De Marchis, Maria Laura; Ferroni, Patrycja; Guadagni, Fiorella (marzec 2010), „Związek między zespołem Birt Hogg Dubé a predyspozycjami do raka” , Anticancer Res. , 30 (3): 751–7, PMID 20392993
- Reese, Erin; Sluzewicz, Jason; Kluijt, Irma; Teertstra, H. Jelle; De Jong, Daphne; Horenblas, Szymon; Ryu, Jay (5 października 2009), „Syndrom Birta-Hogga-Dubé” , w: Riegert-Johnson, Douglas L; Boardman, Lisa A; Heferon, Tymoteusz; Roberts, Maegan (red.), Cancer Syndromes , Bethesda, MD: National Center for Biotechnology Information, PMID 21249760
- Riegert-Johnson, DL, „Birt-Hogg-Dube” , Rodzinne zespoły nowotworowe , NCBI , dostęp 21 lipca 2009 r.
- Sudarshan, Sunil; Karam, Jose A.; Brugarolas, James; Thompson, R. Houston; Uzzo, Robert; Rini, Brian; Margulis, Witalij; Patard, Jean-Jacques; Escudier, Bernard; Linehan, W. Marston (2013), „Metabolizm raka nerki: z laboratorium do praktyki klinicznej”, European Urology , 63 (2): 244–51, doi : 10.1016/j.eururo.2012.09.054 , PMC 3709870 , PMID 23063455
- Toro, Jorge R. (9 września 2008), „Syndrom Birta-Hogga-Dubé” , w: Pagon, Roberta A; Adam, Małgorzata P; Ptak, Thomas D; Dolan, Cynthia R.; Fong, podbródek; Smith, Richard JH; Stephens, Karen (red.), GeneReviews , University of Washington, PMID 20301695
- Toro, JR; Wei, MH; Glenn, GM; Weinreich, M; Toure, O; Wocke, C; Turner, M.; Choyke, P; Merynos, MJ; i in. (2008), „Mutacje BHD, kliniczne i molekularne badania genetyczne zespołu Birt-Hogg-Dube: nowa seria 50 rodzin i przegląd opublikowanych raportów”, Journal of Medical Genetics , 45 (6): 321–31, doi : 10.1136/jmg.2007.054304 , PMC 2564862 , PMID 18234728
- Verine, Hieronim; Pluvinage, Amelia; Bousquet, Guilhem; Lehmann-Che, Jacqueline; De Bazelaire, Cedrik; Sufir, Nadem; Mongiat-Artus, Pierre (2010), „Hereditary Renal Cancer Syndromes: An Update of a Systematic Review”, European Urology , 58 (5): 701–10, doi : 10.1016/j.eururo.2010.08.031 , PMID 20817385
Linki zewnętrzne

