tritioaceton
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Heksametylo-1,3,5-tritian |
|
| Inne nazwy tritioaceton
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 5-19-09-00119 | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.011.438 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 9 H 18 S 3 | |
| Masa cząsteczkowa | 222,42 g·mol -1 |
| Gęstość | 1,0660 do 1,0700 g/ml |
| Temperatura topnienia | 21,8°C |
| Temperatura wrzenia | 107°C/10 mmHg |
|
Współczynnik załamania światła ( n D )
|
1,5390 do 1,5430 |
| Zagrożenia | |
| Oznakowanie GHS : | |

|
|
| Ostrzeżenie | |
| H315 , H319 , H335 | |
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332 + P313 , P337 + P313 , P362 , P403+P233 , P405 , P50 1 | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
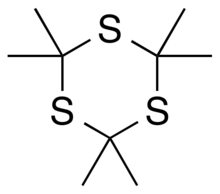
Tritioaceton ( 2,2,4,4,6,6-heksametylo-1,3,5-tritian ) to organiczny związek chemiczny o wzorze C
9 H
18 S
3 . Jego kowalencyjna to [–C(CH
3 )
2 –S–]
3 , czyli sześcioczłonowy pierścień składający się z naprzemiennych atomów węgla i siarki , z dwoma grupami metylowymi przyłączonymi do każdego atomu węgla. Można go postrzegać jako pochodną 1,3,5-tritianu podstawnikami grupy metylowej dla wszystkich atomów wodoru w tej macierzystej strukturze.
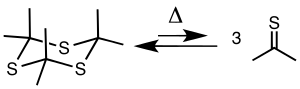
Związek Tritioaceton jest stabilnym cyklicznym trimerem tioacetonu (propano-2-tionu), który sam w sobie jest związkiem niestabilnym. Natomiast analogiczny trioksanowy , 2,2,4,4,6,6-heksametylo-1,3,5-trioksan (Triaceton), z atomami tlenu zamiast atomów siarki, wydaje się być niestabilny, podczas gdy jego odpowiedni monomer aceton (2-propanon) jest stabilny.
Synteza
Tritioaceton został po raz pierwszy wytworzony w 1889 roku przez Baumanna i Fromma w reakcji siarkowodoru z acetonem. W obecności zakwaszonego ZnCl
2 w temperaturze 25°C otrzymuje się produkt składający się z 60–70% tritioacetonu, 30–40% 2,2-propanoditiolu i niewielkich ilości dwóch zanieczyszczeń izomerycznych, 3,3,5 ,5,6,6-heksametylo-1,2,4-tritian i 4-merkapto-2,2,4,6,6-pentametylo-1,3-ditian. Produkt można również otrzymać przez pirolizę siarczku alliloizopropylu.
Reakcje
Piroliza tritioacetonu w temperaturze 500–650 ° C i 5–20 mm Hg daje tioaceton, który można zebrać za pomocą wymrażarki w temperaturze -78 ° C.
Używa
Tritioaceton znajduje się w niektórych środkach aromatyzujących . Jego FEMA to 3475.
Toksyczność
LD50 . ( doustnie) u myszy wynosi 2,4 g/kg
Zobacz też
- 2,4,6-trimetylo-1,3,5-tritian
- Heksametylocyklotrisiloksan , analog z pierścieniem krzemowo -tlenowym zamiast pierścienia węglowo-siarkowego.
- Heksametylocyklotrisilazan z pierścieniem krzemowo- azotowym .
- 2,2,4,4,6,6-heksametylo-1,3,5-triselena-2,4,6-tristannacykloheksan, z pierścieniem cynowo - selenowym .
- Bibliografia _ _ _ Arkusz danych chemicznych online, dostęp 2020-01-01.
- ^ a b c d TCI America (2020): „ Produkt H1278: 2,2,4,4,6,6-heksametylo-1,3,5-tritian ”. Strona katalogu online, dostęp 2020-01-01.
- ^ ab 2,2,4,4,6,6 NCBI PubChem (2010): „ -heksametylo-1,3,5-tritian ”. Arkusz danych chemicznych online, dostęp 2020-01-01.
- ^ David S. Breslow , Herman Skolnik (2009): Multi-siarka i siarka oraz tlen pięcio- i sześcioczłonowe heterocykle , część 2; strona 712. Tom 68 Chemii związków heterocyklicznych . ISBN9780470188330 _
- ^ RD Lipscomb i WH Sharkey (1970): „Charakterystyka i polimeryzacja tioacetonu”. Journal of Polymer Science - Part A: Polymer Chemistry , tom 8, wydanie 8, strony 2187–2196. doi : 10.1002/pol.1970.150080826
- ^ abc William H. Sharkey (1979): „Polimeryzacja przez podwójne wiązanie węgiel - siarka”. Polimeryzacja , seria Advances in Polymer Science , tom 17, strony 73–103. doi : 10.1007/3-540-07111-3_2
- ^ William J. Bailey i Hilda Chu (1965): „Synteza politioacetonu”. ACS Polymer Preprints , tom 6, strony = 145–155
- ^ Horst Bohme, Hans Pfeifer i Erich Schneider (1942): „Dimeryczne tioketony”. Berichte der Deutschen Chemischen Gesellschaft , tom 75B, wydanie 7, strony 900–909. doi : 10.1002/cber.19420750722 Uwaga: Ten wczesny raport myli trimer z monomerem.
- ^ a b EJ Moran, OD Easterday i BL Oser (1980): „Ostra toksyczność doustna wybranych chemikaliów smakowych”. Drug and Chemical Toxicology , tom 3, wydanie 3, strony 249–258. PMID 7449655 doi : 10.3109/01480548009002221
- ^ Światowa Organizacja Zdrowia (1999): „ Trójtioaceton [ martwy link ] ”. Arkusz danych online w ocenie Wspólnego Komitetu Ekspertów FAO/WHO ds. Dodatków do Żywności (JECFA) . Dostęp w dniu 2020-01-02.
- ^ G. Ohloff i I. Flament (1979): „Rola substancji heteroatomowych w związkach aromatycznych środków spożywczych”. W Fortschritte der Chemie Organischer Naturstoffe ( Postęp w chemii organicznych produktów naturalnych ), tom 36, strony 231–283. doi : 10.1007/978-3-7091-3265-4_2
- ^ EUR-Lex (2012): „ Wpis w tabeli 15.009: Tritioaceton ”. W rozporządzeniu UE nr 872/2012 , dokument 32012R0872, Dziennik Urzędowy UE – seria L , tom 267, strony 1–161.
- ^ Stuart D. Brewer i Charles P. Haber (1948): „Alkilosilazany i niektóre związki pokrewne”. Journal of the American Chemical Society , tom 70, wydanie 11, strony 3888–3891. doi : 10.1021/ja01191a106
- ^ BM Mikhova (2008), „Dane NMR dla węgla-13 - C6H18Se3Sn3” w Landolt-Börnstein - skondensowana materia grupy III , tom 35 Dane jądrowego rezonansu magnetycznego , podtom D5, Związki metaloorganiczne . doi : 10.1007/978-3-540-74189-3_1362
-
Bibliografia
_ _
_ _
_ _
_ _ Journal of Organometallic Chemistry , tom 161, wydanie 3, strony 319–325. doi : 10.1016/S0022-328X(00)92243-5