alametycyna

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
N -acetylo-2-metyloalanylo- L -prolilo-2-metyloalanylo- L -alanylo-2-metyloalanylo - L -alanylo- L -glutaminylo-2-metyloalanylo -L -walilo-2-metyloalanyloglicylo- L- leucylo-2- metyloalanylo- L -prolilo - L -walilo-2-metyloalanylo-2-metyloalanylo- L -α-glutamylo - N1 -[(1S ) -1-benzylo-2-hydroksyetylo]-L - glutamamid
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.121.626 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 92 H 150 N 22 O 25 | |
| Masa cząsteczkowa | 1964,31 g/mol |
| Wygląd | Biaława substancja stała |
| Temperatura topnienia | 255 do 270 ° C (491 do 518 ° F; 528 do 543 K) |
| Nierozpuszczalny | |
| Rozpuszczalność w DMSO , metanolu , etanolu | Rozpuszczalny |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Alametycyna jest antybiotykiem peptydowym tworzącym kanały , wytwarzanym przez grzyby Trichoderma viride . Należy do peptaibolu , które zawierają niebiałkopochodną resztę aminokwasową Aib ( kwas 2-aminoizomasłowy ). Ta reszta silnie indukuje tworzenie alfa-helikalnej . Sekwencja peptydowa to:
Ac-Aib-Pro-Aib-Ala-Aib-Ala-Gln-Aib-Val-Aib-Gly-Leu-Aib-Pro-Val-Aib-Aib-Glu-Gln-Phl
(Ac = acetyl, Phl = fenyloalaninol, Aib = kwas 2-aminoizomasłowy )
W błonach komórkowych tworzy zależne od napięcia kanały jonowe poprzez agregację od czterech do sześciu cząsteczek .
Biosynteza
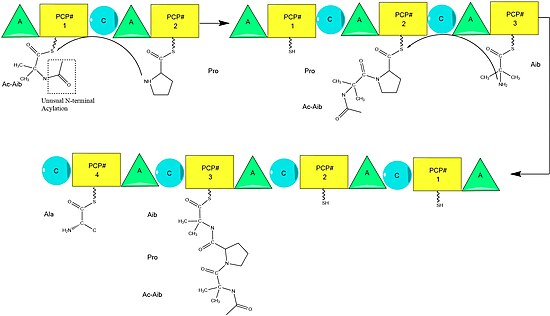
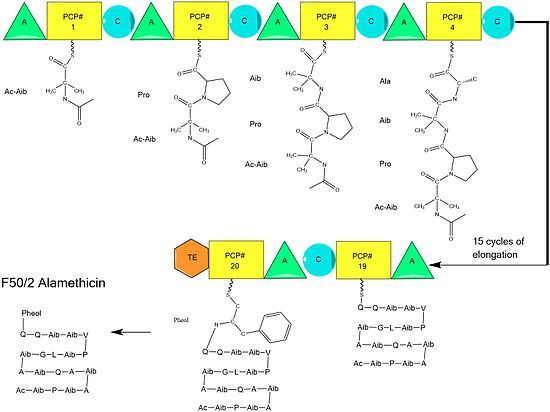
Przypuszcza się, że biosynteza alametycyny jest katalizowana przez syntazę alametycyny, nierybosomalną syntazę peptydową (NRPS), wyizolowaną po raz pierwszy w 1975 r. Chociaż istnieje kilka akceptowanych sekwencji peptydu alametycyny, dowody sugerują, że wszystkie one są zgodne z ogólnym mechanizmem NRPS z niewielkimi zmianami w wybranych aminokwasach . Rozpoczynając od acylowania N-końca pierwszego kwasu aminoizomasłowego enzymu syntazy ALM przez acetylo-CoA , następuje sekwencyjna kondensacja aminokwasów przez każdą modułową jednostkę syntetazy. Aminokwasy są początkowo adenylowane przez domenę „ adenylacji ” (A), zanim zostaną przyłączone wiązaniem tioestrowym do peptydylowego białka nośnikowego podobnego do acylonośnego białka. Rosnący łańcuch jest przyłączony do PCP zawierającego aminokwas przez domenę „kondensacji” (C), po której następuje kolejna runda tych samych reakcji w następnym module.
Montaż jest zakończony przez dodanie fenyloalaninolu, niezwykłego substratu podobnego do aminokwasu. Po dodaniu fenyloalaninolu ukończony łańcuch peptydowy jest rozszczepiany przez domenę tioesterazy, rozszczepiając wiązanie tioestrowe i pozostawiając alkohol.
Dalsza lektura
- Jones, LR; Maddock, SW; Besch, HR Jr (1980). „Demaskujący wpływ alametycyny na (Na +, K +) -ATPazę, cyklazę adenylanową sprzężoną z receptorem beta-adrenergicznym i aktywność kinazy białkowej zależnej od cAMP w pęcherzykach sercowych” . J. Biol. chemia . 255 (20): 9971–9980. doi : 10.1016/S0021-9258(18)43488-6 . PMID 6253461 .
- Zbadaj struktury alametycyny w banku danych białek
-
Alametycyna w Norine
- Z „Modelu kanału jonowego bramkowanego napięciem wywnioskowanego ze struktury krystalicznej alametycyny przy rozdzielczości 1,5 A”. Fox Junior, RO; Richards, FM (1982). „Model kanału jonowego bramkowanego napięciem wywnioskowano ze struktury krystalicznej alametycyny przy rozdzielczości 1,5 A”. Natura . 300 (5890): 325–30. Bibcode : 1982Natur.300..325F . doi : 10.1038/300325a0 . PMID 6292726 . S2CID 4278453 .
- Leitgeb, Balázs; Szekeres, András; Manczinger, László; Vágvölgyi, Csaba; Kredics, László (2007-06-01). „Historia alametycyny: przegląd najszerzej zbadanego peptydobolu”. Chemia i różnorodność biologiczna . 4 (6): 1027–1051. doi : 10.1002/cbdv.200790095 . ISSN 1612-1880 . PMID 17589875 . S2CID 40886688 .