Awobenzon

|
|

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
3-(4- tert -Butylofenylo)-1-(4-metoksyfenylo)propano-1,3-dion |
|
| Inne nazwy butylometoksydibenzoilometan; 4-tert-butylo-4'-metoksydibenzoilometan
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.067.779 |
| Numer WE |
|
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C20H22O3 _ _ _ _ _ | |
| Masa cząsteczkowa | 310,39 g/mol |
| Wygląd | bezbarwny kryształ |
| Strona danych uzupełniających | |
| Awobenzon (strona danych) | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Awobenzon ( nazwy handlowe Parsol 1789 , Milestab 1789 , Eusolex 9020 , Escalol 517 , Neo Heliopan 357 i inne, INCI Butyl Methoxydibenzoylmethane) to rozpuszczalny w tłuszczach składnik stosowany w produktach przeciwsłonecznych do pochłaniania pełnego spektrum promieni UVA .
Historia
Awobenzon został opatentowany w 1973 roku i został zatwierdzony w UE w 1978 roku. Został zatwierdzony przez FDA w 1988 roku. FDA nie uważa awobenzonu za ogólnie uznany za bezpieczny i skuteczny, powołując się na potrzebę dodatkowych danych dotyczących bezpieczeństwa, mimo że został stosowany w filtrach przeciwsłonecznych od ponad 40 lat.
Nieruchomości
Czysty awobenzon to białawy do żółtawego krystaliczny proszek o słabym zapachu, rozpuszczający się w izopropanolu , sulfotlenku dimetylu , oleinianie decylu, kwasie kaprynowym/kaprylowym, trójglicerydach i innych olejach. Nie rozpuszcza się w wodzie.
Awobenzon jest pochodną dibenzoilometanu . Awobenzon występuje w stanie podstawowym jako mieszanina form enolowych i ketonowych, faworyzując chelatowany enol. Ta forma enolowa jest stabilizowana przez wewnątrzcząsteczkowe wiązania wodorowe w β-diketonie. Jego zdolność do pochłaniania światła ultrafioletowego w szerszym zakresie długości fal niż wiele innych środków przeciwsłonecznych doprowadziła do jego zastosowania w wielu preparatach handlowych sprzedawanych jako filtry przeciwsłoneczne o „szerokim spektrum”. Awobenzon ma maksimum absorpcji przy 357 nm.
Bezpieczeństwo
Awobenzon, aktywny składnik ochrony przeciwsłonecznej na bazie ropy naftowej, nie jest ogólnie uznawany przez FDA za bezpieczny i skuteczny. Niedawne badania przeprowadzone na Moskiewskim Uniwersytecie Łomonosowa wykazały, że chlorowana woda i światło ultrafioletowe mogą powodować rozpad awobenzonu na różne inne związki organiczne, w tym; kwasy aromatyczne , aldehydy , fenole i acetofenony , które mogą powodować niekorzystne skutki zdrowotne.
Kraje ze stanami lub obszarami, w których awobenzon jest zakazany: czerwony. Biorąc pod uwagę zakaz: żółty.
Japonia. Hawaje, Stany Zjednoczone Ameryki. Parki Morskie, Tajlandia. Palau. Rezerwaty przyrody, Meksyk. Wyspy Dziewicze, Stany Zjednoczone Ameryki. Bonaire.
Brazylia i UE rozważają wprowadzenie zakazu
Stabilność
Awobenzon jest wrażliwy na właściwości rozpuszczalnika, jest stosunkowo stabilny w polarnych rozpuszczalnikach protonowych i niestabilny w środowiskach niepolarnych. Ponadto, gdy jest napromieniowany światłem UVA, generuje trypletowy stan wzbudzony w postaci keto, co może albo spowodować degradację awobenzonu, albo może przenosić energię do celów biologicznych i powodować szkodliwe skutki.
Wykazano, że awobenzon ulega znacznej degradacji w świetle, co skutkuje mniejszą ochroną w miarę upływu czasu. Światło UV-A w dzień nasłonecznienia w klimacie umiarkowanym jest wystarczające do rozkładu większości związku. Dane przedstawione Agencji ds. Żywności i Leków przez Stowarzyszenie Kosmetyczne, Toaletowe i Zapachowe wskazują na -36% zmianę absorbancji UV awobenzonu po godzinie ekspozycji na światło słoneczne. Degradację tę można ograniczyć stosując fotostabilizator, taki jak oktokrylen . Inne fotostabilizatory obejmują:
- 4-Metylobenzylidenokamfora ( USAN Enzacamene)
- Tinosorb S (USAN Bemotrizinol , INCI Bis-Ethylhexyloxyphenol Methoxyphenyl Triazine)
- Tinosorb M (USAN bisoctrizole , INCI metyleno-bis-benzotriazolilotetrametylobutylofenol)
- Salicylan butyloctylu (nazwa handlowa HallBrite BHB - [1] )
- Benzoesan heksadecylu
- benzoesan butyloktylu
- HallBrite PSF (INCI undecylocrylene dimetikon E)
- Mexoryl SX (USAN Ecamsule , INCI terephthalilidene dicamphor sulfonic acid)
- Synoxyl HSS (INCI Trimetoksybenzylidenopentanodion)
- Corapan TQ (INCI 2,6-naftalan dietyloheksylu)
- Parsol SLX (INCI Polysilicone-15)
- Oxynex ST (INCI Diethylhexyl Syringylidene Malonate
- Polikrylen (INCI Poliester-8)
- SolaStay S1 (INCI etyloheksylometoksykrylen)
- Salicylan Oktylu (INCI Ethylhexyl Salicylate)
Kompleksowanie awobenzonu z cyklodekstrynami może również zwiększać jego fotostabilność. Preparaty awobenzonu z hydroksypropylo-beta-cyklodekstryną wykazały znaczną redukcję fotoindukowanej degradacji, jak również zmniejszoną penetrację przezskórną absorbera UV przy stosowaniu w wysokich stężeniach.
Fotostabilność awobenzonu jest dodatkowo zwiększona, gdy filtry przeciwsłoneczne są formułowane ze związkami przeciwutleniającymi. Mangiferyna , glutation , ubichinon , witamina C , witamina E , beta-karoten i trans-resweratrol wykazały pewną zdolność do ochrony awobenzonu przed fotodegradacją. Stabilność i skuteczność awobenzonu wydaje się nadal wzrastać wraz z dodawaniem większej ilości przeciwutleniaczy do kremu przeciwsłonecznego.
Według niektórych badań „najskuteczniejsze filtry przeciwsłoneczne zawierają awobenzon i dwutlenek tytanu ”. Awobenzon może rozkładać się szybciej w świetle w połączeniu z mineralnymi pochłaniaczami UV, takimi jak tlenek cynku i dwutlenek tytanu, chociaż przy odpowiedniej powłoce cząstek mineralnych reakcja ta może zostać zmniejszona. Dwutlenek tytanu domieszkowany manganem może być lepszy niż niedomieszkowany dwutlenek tytanu, aby poprawić stabilność awobenzonu.
Różny
Jako enolan, awobenzon tworzy barwne kompleksy z jonami metali ciężkich (takich jak Fe 3+ ), aw celu ich stłumienia można dodać środki chelatujące . Stearyniany , sole glinu, magnezu i cynku mogą powodować powstawanie słabo rozpuszczalnych osadów. Producenci zalecają również unikanie włączenia soli żelaza i żelaza, metali ciężkich , donorów formaldehydu oraz PABA i estrów PABA. [ potrzebne źródło ] Twórcy Coppertone informują, że awobenzon wiąże żelazo i może powodować plamienie ubrań wypranych w wodzie bogatej w żelazo. Właściwości plamiące kremu przeciwsłonecznego wykonanego z awobenzonu są szczególnie widoczne na łodziach z włókna szklanego z białym żelkotem. [ potrzebne źródło ]
Awobenzon reaguje również z trifluorkiem boru, tworząc stabilny krystaliczny kompleks, który jest wysoce fluorescencyjny pod wpływem promieniowania UV. Barwa emisji kryształów zależy od upakowania molekularnego kompleksu borowo-awobenzonowego. Fotoluminescencja może być również zmieniana przez siłę mechaniczną w stanie stałym, co skutkuje zjawiskiem zwanym „ mechanochromową luminescencją ”. Zmieniony kolor emisji odzyskuje się powoli w temperaturze pokojowej lub szybciej w wyższych temperaturach.
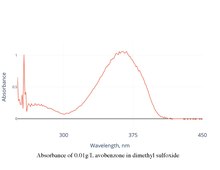
Widmo absorbancji
Po rozpuszczeniu awobenzon ma szczytową absorbancję przy około 360 nm. Pik może się nieznacznie przesunąć w zależności od rozpuszczalnika.
Przygotowanie
Związek wytwarza się w reakcji estru metylowego 4-tert-butylobenzoesowego (z kwasu 4-tert-butylobenzoesowego przez estryfikację metanolem) z 4-metoksyacetofenonem w toluenie w obecności amidu sodu poprzez kondensację Claisena .
Zgodnie z niedawnym zgłoszeniem patentowym, wydajność do 95% uzyskuje się z tymi samymi materiałami wyjściowymi w toluenie w obecności metanolanu potasu .
Podlega tautomerii keto-enolowej i po rozpuszczeniu występuje głównie w enolu . Pod wpływem promieniowania UV może przekształcić się w formę ketonową, a po umieszczeniu w ciemności ponownie przekształcić się w formę enolową.
Zobacz też