Caprella mutica

|
|
|
Japońska krewetka szkieletowa Caprella mutica |
|
|---|---|
| Klasyfikacja naukowa | |
| Królestwo: | Animalia |
| Gromada: | stawonogi |
| podtyp: | Skorupiaki |
| Klasa: | Malacostraka |
| Nadrzędne zamówienie: | Peracarida |
| Zamówienie: | Amfipoda |
| Rodzina: | Caprellidae |
| Rodzaj: | Caprella |
| Gatunek: |
C. mutica
|
| Nazwa dwumianowa | |
|
Caprella mutica Szurina, 1935
|
|

|
|
|
Rodzimy zasięg występowania C. mutica Kręgi to obszary, na których potwierdzono obecność okazów: 1 : Zatoka Piotra Wielkiego 2 : Zatoka Posyet 3 : Przylądek Olarovsky 4 : Przylądek Signalny 5 : Morze Ochockie 6 : Kunashir 7 : Szykotan 8 : Zatoka Akkeshi |
|
| Synonimy | |
|
|
Caprella mutica , powszechnie znana jako japońska krewetka szkieletowa , jest gatunkiem krewetki szkieletowej . Są to stosunkowo duże caprellidy , osiągające maksymalną długość 50 mm (2,0 cala). Są dymorficzne płciowo , a samce są zwykle znacznie większe niż samice. Charakteryzują się „owłosionymi” pierwszym i drugim piersiowym oraz rzędami kolców na ciele. Kolor ciała waha się od zielonego przez czerwony do niebieskiego, w zależności od środowiska. Są wszystkożernymi , wysoce przystosowalnymi, oportunistycznymi żerami. Z kolei stanowią cenne źródło pożywienia dla ryb , krabów i innych większych drapieżników . Zwykle znajdują się w gęstych koloniach przyczepionych do zanurzonych struktur stworzonych przez człowieka, pływających wodorostów i innych organizmów.
C. mutica są rodzime dla płytkich, chronionych zbiorników wodnych w Morzu Japońskim . W ciągu zaledwie 40 lat stały się gatunkiem inwazyjnym na północnym Atlantyku , północnym Pacyfiku i wzdłuż wybrzeży Nowej Zelandii . Uważa się, że zostały przypadkowo wprowadzone na te obszary poprzez światowy ruch morski i akwakulturę. Poza swoim rodzimym zasięgiem C. mutica są często wyłącznie synantropijne i występują w dużych ilościach na obszarach działalności człowieka i wokół nich. Ich wpływ ekologiczny i ekonomiczny jako gatunku inwazyjnego jest nieznany, ale stanowią poważne zagrożenie dla rodzimych populacji krewetek szkieletowych na dotkniętych obszarach.
Opis
Podobnie jak wszystkie amfipody Caprellid , Caprella mutica charakteryzują się smukłymi ciałami i wydłużonymi wyrostkami. Ich szkieletowy wygląd dał początek potocznym nazwom „ krewetek szkieletowych ” lub „krewetek duchów”, a w połączeniu z ich charakterystyczną pionową postawą do karmienia, dają im uderzające podobieństwo do patyczaków i „zagłodzonych modliszek ”. C. mutica różnią się ubarwieniem od półprzezroczystego bladozielonego, brązowego, kremowego, pomarańczowego, ciemnoczerwonego, fioletowego, a nawet turkusowego, w zależności od podłoża, w którym się znajdują. Woreczki lęgowe samic są nakrapiane czerwonymi plamami. Stosunkowo duży amfipod, C. mutica, wykazuje dymorfizm płciowy, a samce są znacznie większe niż samice. Samce mają średnią długość od 25 do 30 mm (0,98 do 1,18 cala), chociaż odnotowano okazy osiągające 50 mm (2,0 cala) długości. Z drugiej strony samice mają średnio tylko 15 do 20 mm (0,59 do 0,79 cala) długości.
Ciało można podzielić na trzy części – głowa (głowa), pereon (klatka piersiowa) i brzuch . Pereon obejmuje większość długości ciała. Jest podzielony na siedem segmentów zwanych pereonitami. Zaokrąglony i gładki cefalon jest połączony z pierwszym pereonitem; podczas gdy bardzo zmniejszony i prawie niewidoczny odwłok jest przyczepiony do tylnej części siódmego pereonitu. U samców pierwsze dwa pereonity są wydłużone, przy czym drugi pereonit jest najdłuższy ze wszystkich pereonitów. Są gęsto pokryte długimi szczecinami (włosiem), co nadaje im owłosiony wygląd. Drugi pereonit ma również dwie do trzech par kolców na grzbiecie, z dodatkowymi dwiema parami po bokach w pobliżu podstawy kończyn. Pozostałe pereonity (od trzeciego do siódmego) nie mają gęstych szczecin pierwszych dwóch pereonitów. Trzeci pereonit ma siedem par kolców z tyłu, podczas gdy czwarty pereonit ma osiem par. Oba mają od trzech do siedmiu par kolców w pobliżu podstawy skrzeli. Piąty pereonit ma pięć par kolców tylnych i parę kolców po bokach. Szósty i siódmy pereonit mają po dwie pary tylnych kolców, umieszczonych w ich środkach i blisko tylnej części. Samice różnią się od samców znacznie krótszymi pereonitami, które nie są pokryte gęstą szczeciną. Cefalon i pierwszy pereonit również mają po jednej parze kolców, chociaż czasami mogą być nieobecne.
Podobnie jak inne skorupiaki , C. mutica posiada dwie pary czułków , przy czym pierwsza (zewnętrzna) para ma ponad połowę całkowitej długości ciała. Segmenty szypułek (podstawa) są trzy razy dłuższe niż wici („bicze” na końcach czułków). Wici mają po 22 segmenty. Druga (wewnętrzna) para anten ma mniej niż połowę długości pierwszej. Posiadają dwa rzędy długich szczecin na brzusznych powierzchniach segmentów ich szypułek. Żuchwy i szczęki są obecne na przedniej brzusznej powierzchni głowy. Szczękowonogi , zmodyfikowana para przydatków, służą również jako akcesoria gębowe.
Wyrostki wyrastające z pereonitów nazywane są pereopodami . Pierwsze dwie pary pereopodów to wysoce zmodyfikowane chwytające drapieżników, znane jako gnathopods . Przypominają nieco ramiona modliszek. Segmenty gnatopodów można podzielić na dwie części, które składają się ze sobą: propodus (liczba mnoga: propodi, „kończyna przednia”) i najbardziej końcowy segment znany jako dactylus (liczba mnoga: dactyli, „palec”). Pierwsza para gnathopodów jest znacznie mniejsza niż druga para i wyrasta blisko szczękonogów. Wewnętrzne brzegi propodi posiadają dwa kolce. Zarówno propodi, jak i daktyle mają ząbkowane krawędzie wewnętrzne. Druga para gnatopodów jest bardzo duża, z dwoma dużymi kolcami na środkowej i górnej krawędzi wewnętrznej krawędzi dłoni propodi. Górny kręgosłup jest znany jako „trujący kręgosłup” lub „trujący ząb” i może być tego samego rozmiaru lub znacznie większy niż dolny kręgosłup („kręgosłup zamykający”). Pomimo nazwy pozostaje niejasne, czy trujący kręgosłup jest rzeczywiście jadowity , chociaż są one doskonale zdolne do zadawania potencjalnie śmiertelnych obrażeń małym organizmom. Ostatnie badania powiązały kolce z porami, które prowadzą do możliwych gruczołów wytwarzających toksyny.
Ich daktyle są potężne i zakrzywione w kształt przypominający bułat . Druga para gnatopodów jest gęsto pokryta szczecinkami przypominającymi włosy, podczas gdy pierwsza para ma szczeciny tylko na tylnych brzegach. Trzeci i czwarty pereopod są nieobecne. Na ich miejscu znajdują się dwie pary wydłużonych owalnych blaszek wywodzących się odpowiednio z trzeciego i czwartego pereonitu. U dojrzałych samic w trzecim i czwartym pereonicie rozwijają się również dwa woreczki lęgowe. Tworzą je oostegity – płytkowate wyrostki z segmentów podstawnych ( coxae ) przydatków. Pereopody od piątego do siódmego działają jako chwytające wyrostki. Wszystkie mają propodi z dwoma kolcami na wewnętrznych marginesach. Siódma para pereopodów jest najdłuższą z trzech par, po której następuje szósta para pereopodów i piąta para pereopodów.
C. mutica bardzo przypomina Caprella acanthogaster , również pochodzącą z wód wschodnioazjatyckich. Rozróżnienie tych dwóch gatunków może być trudne, zwłaszcza że Caprella mutica może wykazywać znaczne różnice morfologiczne między samcami. C. mutica można wiarygodnie rozróżnić jedynie na podstawie ich osadzonych pereonitów pierwszego i drugiego (gładkie u C. acanthogaster ), jak również wydłużonego owalnego kształtu ich skrzeli (liniowe u C. acanthogaster ).
Taksonomia i nomenklatura
Caprella mutica zostały po raz pierwszy opisane w 1935 roku przez A. Schurina na podstawie okazów pobranych z Zatoki Piotra Wielkiego na Morzu Japońskim . Należy do rodzaju Caprella w podrodzinie Caprellinae z rodziny Caprellidae , grupy wysoce wyspecjalizowanych obunogów powszechnie znanych jako krewetki szkieletowe. Caprellids są klasyfikowane w nadrodzinie Caprelloidea z infrarzędu Caprellida .
C. mutica są znane w języku japońskim jako koshitoge-warekara („krewetki szkieletowe w talii”) . W Holandii i Belgii , gdzie odkryto pierwsze inwazyjne populacje C. mutica w Europie, są one znane jako machospookkreeftje po flamandzku (dosłownie „ macho duch krewetek”). Nazwa pochodzi od młodszego synonimu ( nazwa błędna ) Caprella macho , zastosowanego w 1995 r. do gatunku przez Dirka Platvoeta i in. którzy początkowo wierzyli, że są innym gatunkiem. „Macho” jest humorystycznym nawiązaniem do charakterystycznych „owłosionych torsów” samców C. mutica . Caprella acanthogaster humboldtiensis , inna błędna nazwa gatunku, została po raz pierwszy zastosowana do błędnie zidentyfikowanych okazów C. mutica wydobytych z Zatoki Humboldta w Kalifornii przez Donalda M. Martina w 1977 r. Niektóre okazy zebrane w zatoce Firth of Clyde w Szkocji w 1999 r . były również początkowo błędnie zidentyfikowany jako Caprella tuberculata , ale od tego czasu stwierdzono , że został wprowadzony przez C. mutica .
Ekologia i biologia
Caprella mutica zamieszkuje płytkie chronione zbiorniki morskie. Często można je znaleźć w gęstych koloniach przyczepionych do zanurzonych sztucznych struktur, makroglonów morskich i innych organizmów. Są to przede wszystkim wszystkożerne detrytusy , ale mogą przystosować się do innych metod żywienia w zależności od dostępności pożywienia. Polują na nie ryby , kraby i kilka innych drapieżników.
C. mutica na ogół występuje w regionach o klimacie umiarkowanym i subarktycznym . Nie tolerują temperatur wody wyższych niż 28,3 ° C (82,9 ° F). Umierają również w ciągu pięciu minut, jeśli zostaną wystawione na działanie wody o temperaturze 40 ° C (104 ° F). Na dolnym końcu mogą przetrwać temperatury niższe niż -1,9 ° C (28,6 ° F), ale są unieruchomione, jeśli nie całkowicie w stanie zawieszenia animacji . Tolerancja C. mutica na zasolenie nie spada poniżej 15 psu i nie jest w stanie przetrwać w siedliskach słodkowodnych . Jednak w ich rodzimych siedliskach zaobserwowano, że mogą przetrwać zasolenie tak niskie, jak 11 psu. Są również wrażliwe na działanie powietrza i umrą w ciągu godziny, jeśli zostaną wyjęte z wody.
C. mutica rozmnaża się przez cały rok, ze szczytem sezonu w miesiącach letnich. Samce są bardzo agresywne i rywalizują seksualnie z mniejszymi samicami. Jaja, które średnio 40 na samicę, są inkubowane przez około 5 dni w temperaturze 22 ° C (72 ° F) w torebce lęgowej samicy. Po wykluciu osiągają dojrzałość płciową w ciągu około 21 do 46 dni. Ich średnia długość życia w warunkach laboratoryjnych to 68,8 dni dla samców i 82 dni dla samic.
Siedlisko
W swoim naturalnym środowisku Caprella mutica występuje w strefach infralitoralu (lub nerytu ) i litoralu osłoniętych zbiorników wodnych na głębokość około 0,7 do 13 m (2,3 do 42,7 stopy). Mogą spędzić całe życie trzymając się podłoża w pozycji pionowej. Podłoża te zazwyczaj unoszą się na wodzie z nitkowatymi, liściastymi, rozgałęzionymi lub darniowymi strukturami tego samego koloru co ich ciało, co służy zarówno do kamuflażu , jak i transportu. C. mutica są słabymi pływakami i poruszają się głównie w sposób falujący, podobny do robaka calowego , używając tylnych pereopodów i gnathopodów. Na ogół niechętnie puszczają swoje substraty i robią to tylko wtedy, gdy są wzburzone. Wiadomo, że różne populacje w różnych podłożach wykazują różne egzoszkieletu , co sugeruje, że mogą zmieniać kolor, aby wtopić się w otoczenie. Dokładny mechanizm tej zmiany koloru pozostaje jednak nieznany.
Podłoża, na których najczęściej występują w ich rodzimych siedliskach, obejmują łóżka i pływające kępy makroglonów, takich jak Sargassum muticum , Sargassum miyabei , Sargassum pallidum , Neorhodomela larix , Polysiphonia morrowii , Cystoseira crassipes , Laminaria japonica , Chondrus spp. i Desmarestia viridis ; a także w roślinach morskich (takich jak trawa morska z rodzaju Zostera ), hydrozoanach i mszywiołach .
W swoich wprowadzonych zakresach mają również tendencję do poszukiwania organizmów, które wykazują struktury, z którymi ich smukłe ciała mogą z łatwością się łączyć. Należą do nich makroalgi, takie jak Ulva lactuca , Ceramium spp., Plocamium spp., Cladophora spp., Chorda filum , Fucus vesiculosus , Pylaiella spp. i wprowadzonego Sargassum muticum ; hydrozoany, takie jak Obelia spp. i Tubularia indivisa ; mszywioły; obunogi budujące rury, takie jak Monocorophium acherusicum i Jassa marmorata ; a nawet osłonice o miękkim ciele, takie jak Ascidiella aspersa i Ciona jelit .
Zarówno w swoich rodzimych, jak i wprowadzonych obszarach, C. mutica jest również synantropijna , występując obficie w społecznościach porastających sztuczne konstrukcje, takie jak zanurzone liny, sieci rybackie, pale , doki , boje , sprzęt akwakultury , platformy wiertnicze , kadłuby statków , a nawet na morzu farmy wiatrowe . W ich wprowadzonych zasięgach (szczególnie w Europie) występują głównie, a nawet wyłącznie, zamieszkując sztuczne konstrukcje.
C. mutica może osiągnąć bardzo duże zagęszczenie w swoim wprowadzonym zasięgu podczas kolonizacji sztucznych struktur. Badanie C. mutica w Zatoce Chaleur w Quebecu wykazało koncentrację 468 800 osobników na 1 m2 ( 11 stóp kwadratowych); podczas gdy badanie przeprowadzone w zatoce Dunstaffnage w zatoce Firth of Lorn w Szkocji wykazało 319 000 osobników na 1 m2 ( 11 stóp kwadratowych). Natomiast C. mutica w swoich rodzimych siedliskach osiąga maksymalne zagęszczenie wynoszące zaledwie około 1220 do 2600 osobników na 1 m2 ( 11 stóp kwadratowych). Populacje osiągają szczyt późnym latem (od sierpnia do września), zanim nastąpi gwałtowny spadek w miesiącach zimowych.
Dieta i drapieżniki
Caprella mutica to wszystkożerne , wysoce przystosowawcze, oportunistyczne karmy. Badania zawartości ich żołądka ujawniają bardzo zróżnicowaną dietę zależną od konkretnego podłoża, na którym się znajdują. Są to głównie detrytusożercy , ale mają niezwykłą zdolność dostosowywania metod karmienia od bycia pasącymi się , padlinożercami , filtratorami , a nawet drapieżnikami , w zależności od warunków ich środowiska. C. mutica odsiewa cząsteczki pokarmu lub małe organizmy z wody, machając ich ciałami tam iz powrotem, z wysuniętymi grzebieniowymi szczecinkami na drugiej parze czułków. Następnie oczyszczają uwięzione cząsteczki, pochylając czułki w dół do aparatu gębowego. Używają również swoich czułków do zeskrobywania cząstek jedzenia z powierzchni ich ciał lub podłoża, do którego przylegają. Duże gnatopody służą do uderzania i chwytania zarówno ruchomej , jak i siedzącej ofiary. Znane organizmy drapieżne C. mutica obejmują glony (zarówno planktonowe, jak i makroalgi), wiciowce , hydrozoany , mszywioły , okrzemki , widłonogi , krewetki solankowe i inne obunogi . Są w stanie odżywiać się zawieszonymi cząstkami organicznymi , w tym paszą dla ryb i rozkładającą się materią organiczną. Wiadomo również, że C. mutica angażuje się w zachowania kanibalistyczne na martwych i umierających osobnikach własnego gatunku lub rodzaju.
Podobnie jak inne caprellidy, C. mutica jest ofiarą głównie ryb i krabów . W ich rodzimych siedliskach drapieżnikami z Caprella mutica są krab przybrzeżny Carcinus maenas i wargacz złocisty ( Ctenolabrus rupestris ), które zjadają je w dużych ilościach. Inne drapieżniki to ślimaki nagoskrzelne , rozgwiazdy , robaki nemertejskie , ukwiały i hydrozoany . Stanowią cenne źródło pożywienia dla tych organizmów ze względu na wysoką zawartość wielonienasyconych kwasów tłuszczowych i karotenoidów . Stanowią również ważne ogniwo w łańcuchu pokarmowym między planktonem a większymi rybami. To, w połączeniu z ich względną obfitością i szybkim tempem wzrostu, czyni je potencjalnie ważnym źródłem paszy dla ryb morskich w akwakulturze. Wprowadzone populacje C. mutica stały się główną częścią diety rodzimych dzikich i hodowlanych ryb.
Rozmnażanie i historia życia
Dzikie populacje Caprella mutica wykazują większą liczbę samic niż samców. Może to być związane z faktem, że samice są agresywnie bronione przez samce przed konkurującymi samcami, co skutkuje wysoką śmiertelnością samców. Większe rozmiary i większa widoczność samców sprawiają, że są one również bardziej wrażliwymi celami dla drapieżników polegających na wzroku, takich jak ryby. C. mutica są r-strategami . Rozmnażają się przez cały rok, z sezonami szczytowymi w lecie (od marca do lipca).

Samce wykazują współzawodnictwo seksualne i zachowania zalotne . Agresywnie angażują się w „pojedynki bokserskie”, używając swojej dużej drugiej pary gnatopodów w obecności wrażliwych samic. Spotkania te często mają śmiertelne skutki, ponieważ gnatopody i ich trujące zęby mogą zostać użyte do przebicia lub przecięcia przeciwnika na pół. Samce będą również wielokrotnie dotykać czułkami egzoszkieletów samic, aby wykryć oznaki linienia ( ekdyzy ). Jak wszystkie skorupiaki , samice są zdolne do krycia dopiero wkrótce po zrzuceniu swoich starych, stwardniałych egzoszkieletów.
Amplexus trwa od 10 do 15 minut. Po kryciu samce będą bronić samic przez krótki czas (około 15 minut). Po tym okresie samice zaczynają zachowywać się agresywnie i odganiają samce. Następnie zginają czwarty i piąty pereonit pod kątem 90 stopni. Gdy ich otwory narządów płciowych (znajdujące się na piątym pereonicie) zrównają się z otworami worków lęgowych, szybko składają w nich zapłodnione jaja. Samice niosące zapłodnione jaja pozostają bardzo agresywne w stosunku do samców przez cały okres lęgowy, co wskazuje na zachowanie matki mające na celu ochronę rozwijającego się zarodka przed agresją samców.
Worek lęgowy samicy może zawierać od 3 do 363 jaj, średnio 74 jaja. Większe samice zwykle produkują więcej jaj. Jaja są inkubowane w worku z czerwiem przez 30 do 40 dni przed wykluciem. Podobnie jak wszystkie amfipody, kaprellidy nie mają planktonowego stadium larwalnego , a pisklęta przypominają miniaturowe dorosłe osobniki. Młode osobniki mogą przylgnąć do swoich matek po wykluciu, a samice nadal chronią swoje potomstwo, które pozostaje blisko. Pisklęta mierzą około 1,3 do 1,8 mm (0,051 do 0,071 cala) i rosną średnio do 0,4 do 0,9 mm (0,016 do 0,035 cala) na stadium rozwojowe .
C. mutica dojrzewa szybko, liniejąc średnio raz w tygodniu, aż wejdzie w „stadium przedwczesne”, różnicując się płciowo w piątym stadium rozwojowym . Okresy między cyklami pierzenia stają się wówczas dłuższe w ich stadiach od siódmego do dziewiątego , średnio raz na dwa tygodnie, aż do osiągnięcia dojrzałości płciowej. Może to nastąpić już po 21 dniach i nie później niż 46 dni po wykluciu, w zależności od warunków środowiskowych. Jednak w dzikich populacjach może to zająć nawet sześć miesięcy, kiedy młode wykluwają się późnym latem.
Samce zaczynają powiększać się w szybszym tempie z każdym kolejnym pierzeniem po siódmym stadium rozwojowym. Z drugiej strony samice wydają pierwsze potomstwo w siódmym stadium rozwojowym. Jako dorośli mogą linieć kilka razy, za każdym razem stając się podatnymi seksualnie aż do śmierci. Średnia długość życia C. mutica w warunkach laboratoryjnych wynosi 68,8 dni dla samców i 82 dni dla samic.
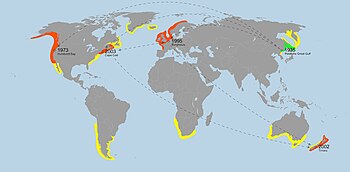
Dystrybucja i ekologia inwazyjna
Caprella mutica pochodzi z subarktycznych regionów Morza Japońskiego w północno-zachodniej Azji. Po raz pierwszy odkryto je w Zatoce Piotra Wielkiego na terenie Federacji Rosyjskiej , Kraju Nadmorskiego . Zostały ponownie opisane przez japońskiego biologa morskiego Ishitaro Arimoto w 1976 roku, który zauważył, że były one również obecne na wyspie Hokkaido i okolicznych regionach. W ciągu zaledwie 40 lat rozprzestrzeniły się na inne części świata poprzez wielokrotne przypadkowe introdukcje (zarówno pierwotne, jak i wtórne) z kadłubów lub wód balastowych międzynarodowego transportu morskiego, sprzętu akwakultury i przesyłek Ostryga pacyficzna ( Crassostrea gigas ).
Badania genetyczne mitochondrialnego DNA (mtDNA) populacji C. mutica ujawniają dużą różnorodność genetyczną w regionie Morza Japońskiego, jednoznacznie identyfikując go jako ich rodzimy zasięg. Natomiast populacje nierodzime w Ameryce Północnej, Europie i Nowej Zelandii charakteryzowały się niewielką różnorodnością. Jednak wykrycie materiału genetycznego obecnego w populacjach nierodzimych również stwarza prawdopodobieństwo, że istnieją nieznane regiony, z których C. mutica może również pochodzić; chociaż może to również wynikać po prostu z tego, że grupy prób użyte w badaniach były zbyt małe. Porównania mtDNA różnych populacji umożliwiają prześledzenie możliwych dróg wprowadzenia. Najbardziej prawdopodobne jest to, że pierwotne wprowadzenie obcego pochodzenia miało miejsce na zachodnim wybrzeżu Ameryki Północnej, które wykazuje największą różnorodność genetyczną w populacjach obcych. Wiele późniejszych wprowadzeń miało miejsce w Europie i wschodniej Ameryce Północnej. Stąd transportowano dodatkowe populacje do pobliskich portów. Europa i wschodnia Ameryka Północna są również możliwymi źródłami C. mutica w Nowej Zelandii .
Ameryka północna
Pierwsze okazy C. mutica poza jej rodzimym zasięgiem zostały znalezione w Zatoce Humboldta w Kalifornii przez Donalda M. Martina w 1973 roku. Martin błędnie zidentyfikował je jako podgatunek C. acanthogaster . Nazwał je Caprella acanthogaster humboldtiensis . Dodatkowe okazy (również traktowane jako C. acanthogaster lub C. acanthogaster humboldtiensis ) zostały znalezione w latach 1976-1978 z ujścia rzeki Oakland , Elkhorn Slough i zatoki San Francisco . Dopiero w 1981 roku okazy zostały poprawnie zidentyfikowane jako C. mutica przez Dana C. Marelli. Uważa się , że wraz z dodatkowymi okazami odkrytymi w 1983 r. w Coos Bay w stanie Oregon populacje te zostały wprowadzone na ten obszar w wyniku importu ostryg ostryg pacyficznych ( Crassostrea gigas ) z Japonii w celu hodowli ostryg . Ostrygi są zwykle transportowane z algami jako materiałem opakowaniowym, zwłaszcza Sargassum muticum , z którym związane są C. mutica .
Uważa się, że populacje C. mutica odkryte w Puget Sound w stanie Waszyngton w latach 70. XX wieku, jak również dodatkowe populacje odnotowane w stanach Oregon i Kalifornia w Stanach Zjednoczonych w latach 2000. pierwotne populacje.
C. mutica odkryto również w Ketchikan , Sitka , Juneau , Cordova , Kodiak , Zatoce Kachemak , Prince William Sound i Unalaska na Alasce w latach 2000-2003. Był to pierwszy przypadek znalezienia obcego gatunku morskiego na Aleucjach Wyspy . W 2009 roku odkryto, że rozprzestrzeniły się w Kolumbii Brytyjskiej w Kanadzie . Wskazuje to, że C. mutica całkowicie rozprzestrzeniła się na całe zachodnie wybrzeże Ameryki Północnej.
W 2003 roku badania przeprowadzone przez Massachusetts Institute of Technology (MIT) Sea Grant wzdłuż wybrzeża Atlantyku w Stanach Zjednoczonych ujawniły wiele ustalonych populacji w portach morskich wzdłuż wybrzeży od Connecticut do Maine . W tym samym roku C. mutica stwierdzono również w zatokach Passamaquoddy i Chaleur w Nowym Brunszwiku i Quebecu w Kanadzie .
Europa
C. mutica w Europie zostały po raz pierwszy znalezione w Holandii w 1995 r. Podczas inwentaryzacji gatunku Platvoet i in. Odzyskali kilka okazów nieznanego kaprellida. ze sztucznych struktur w okolicach Neeltje-Jans i bariery przeciwprzepięciowej Wschodniej Skaldy w Burghsluis w Zelandii . Podobnie jak w przypadku pierwszego odkrycia C. mutica w Ameryce Północnej, Platvoet et al. początkowo błędnie zidentyfikowali je jako nowy gatunek. Zwracając uwagę na podobieństwo kaprelidów do C. acanthogaster , nazwali ją Caprella macho . Później odkryto, że były to wprowadzone populacje C. mutica , a nie nowy gatunek.
Od tego czasu dodatkowe populacje wykryto w Belgii (1998), Norwegii (1999), Niemczech ( 2000), Szkocji (2000), Anglii (2003), Walii (2003), Irlandii (2003), Francji (2004) i Dania (2005). Występują w niezwykle gęstych populacjach i wszystkie są związane z obszarami o dużej aktywności człowieka. Uważa się, że zostały wprowadzone za pośrednictwem sprzętu żeglugowego i akwakultury ze Stanów Zjednoczonych i Azji. Od 2011 r. nie odnotowano żadnych obserwacji C. mutica wokół Półwyspu Iberyjskiego , Morza Bałtyckiego ani Morza Śródziemnego .
Nowa Zelandia
Caprella mutica po raz pierwszy wykryto w Nowej Zelandii w porcie Timaru na Wyspie Południowej w 2002 roku. Był to pierwszy przypadek C. mutica odnotowany na półkuli południowej. Od tego czasu bardziej ugruntowane populacje C. mutica znaleziono w Port Lyttelton w 2006 r. oraz w Marlborough Sounds i Wellington Harbor w 2007 r. Dodatkowe okazy wydobyto również z kadłubów statków w innych portach, chociaż nie wydaje się, że założyły kolonie w samych portach. Badania genetyczne populacji Nowej Zelandii sugerują możliwość, że zostały one wprowadzone wtórnie z nierodzimych populacji C. mutica na Atlantyku przez wody balastowe w skrzyniach morskich żeglugi międzynarodowej.
Uderzenie
Bezpośredni wpływ środowiskowy i ekonomiczny wprowadzonych populacji C. mutica pozostaje nieznany. Stanowią cenne źródło pożywienia dla większych drapieżników, zwłaszcza ryb. Na przykład w Nowej Zelandii stały się one częścią diety rodzimego konika morskiego ( Hippocampus brzucha ). W Europie dzikie i hodowlane ryby, takie jak zimnica zwyczajna ( Limanda limanda ), okoń europejski ( Perca fluviatilis ) i łosoś atlantycki ( Salmo salar ), spożywają duże ilości nierodzimej C. mutica .
Jednak ich większe rozmiary i bardzo agresywne zachowanie sprawiają, że są również poważnym zagrożeniem dla rodzimych gatunków krewetek szkieletowych. Badanie przeprowadzone w 2009 r. na rodzimych populacjach Caprella linearis , mniejszego gatunku kaprellidów w regionie Helgoland w Zatoce Niemieckiej na Morzu Północnym , wykazało , że C. linearis mniej więcej zniknęły i zostały zastąpione przez C. mutica . Porastające populacje C. mutica mogą również wiązać się z niewielkimi skutkami ekonomicznymi związanymi z kosztami ich usuwania z zanurzonych urządzeń akwakultury i kadłubów statków.
Kontrola
Nie są znane żadne skuteczne środki zwalczania inwazyjnych populacji Caprella mutica od 2012 r. Sugerowano, że można wykorzystać sezonowe wahania populacji. Wysiłki podejmowane w miesiącach zimowych, kiedy C. mutica są w stanie uśpienia i są najniższe, są potencjalnie bardziej skuteczne w zapobieganiu ich odbudowie w miesiącach letnich. Jednak ze względu na duże trudności w ich wykrywaniu i usuwaniu metody kontroli będą prawdopodobnie koncentrować się na ochronie rodzimych populacji gatunków, a nie na zwalczaniu ustalonej C. mutica .