Fomoksanton A

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
rel -(5R , 5′R , 6R , 6′R , 10aR ,10′aR ) -10a ,10′a-bis[(acetyloksy)metylo]-1,1′,8,8′-tetrahydroksy-6,6′-dimetylo-9,9′-diokso-5,5′,7,7′,9,9 ′,10a,10′a-oktahydro-6 H ,6′ H-[4,4′-biksanteno] -5,5′ - diylu dioctan |
|
| Inne nazwy PXA
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
|
|
|
|
| Nieruchomości | |
| C38H38O16 _ _ _ _ _ | |
| Masa cząsteczkowa | 750,70 g/mol |
| Wygląd | żółte ciało stałe |
| Gęstość | ~1,53 g/cm3 |
| nie rozpuszczalny | |
| Rozpuszczalność w DMSO | dobry, ale niestabilny |
| Rozpuszczalność w EtOH | umiarkowany |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Mikotoksyna , fomoksanton A , w skrócie PXA , jest toksycznym produktem naturalnym , który wpływa na mitochondria . Jest najbardziej toksycznym i najlepiej zbadanym z naturalnie występujących fomoksantonów . Niedawno wykazano, że PXA indukuje szybkie, niekanoniczne rozszczepienie mitochondriów , powodując fragmentację macierzy mitochondrialnej , podczas gdy zewnętrzna błona mitochondrialna może pozostać nienaruszona. Wykazano, że proces ten jest niezależny od rozszczepienia i fuzji mitochondriów regulatory DRP1 i OPA1 .
Właściwości i struktura

Fomoksantony zostały nazwane na cześć grzyba Phomopsis , z którego zostały po raz pierwszy wyizolowane, oraz od ich struktury ksantonoidalnej , co oznacza, że mają struktury podobne do związku ksantonu (na zdjęciu po lewej). Z chemicznego punktu widzenia fomoksantony są dimerami dwóch tetrahydroksantonów, co oznacza, że składają się z dwóch podjednostek ksantonoidów, z których każda ma cztery grupy hydroksylowe . Dwie podjednostki fomoksantonów są ze sobą połączone kowalencyjnie . Sam PXA jest homodimerem, co oznacza, że składa się z dwóch identycznych podjednostek. Obie te podjednostki są diacetylowane tetrahydroksantony, więc dwie z ich grup hydroksylowych zostały zastąpione grupami acetylowymi . Położenie wiązania między dwiema podjednostkami dimeru jest jedyną różnicą strukturalną między PXA a jego mniej toksycznymi izomerami, fomoksantonem B (PXB) i dicerandrolem C : W PXA dwa monomery ksantonoidowe są połączone symetrycznie w pozycji C-4,4 ', podczas gdy w PXB są połączone asymetrycznie w C-2,4', aw dicerandrolu C są połączone symetrycznie w C-2,2' . W przeciwnym razie te trzy związki są strukturalnie identyczne. Fomoksantony są strukturalnie blisko spokrewnione z kwasy sekalonowe , inna klasa dimerycznych mikotoksyn tetrahydroksantonowych, z którymi mają wspólne kilka właściwości. Warto zauważyć, że zarówno fomoksantony, jak i kwasy sekalonowe są niestabilne po rozpuszczeniu w polarnych rozpuszczalnikach , takich jak DMSO , z wiązaniem kowalencyjnym między dwoma monomerami przesuwającymi się między wiązaniami 2,2′-, 2,4′- i 4,4′. Dwa fomoksantony PXA i PXB mogą zatem powoli izomeryzować do siebie nawzajem, jak również do zasadniczo nietoksycznego dicerandrolu C, co powoduje utratę aktywności PXA w czasie po rozpuszczeniu w polarnym rozpuszczalniku.
Występowanie
Jako produkty naturalne , PXA i inne fomoksantony występują jako metabolity wtórne w grzybach z rodzaju Phomopsis o tej samej nazwie , zwłaszcza w gatunku Phomopsis longicolla . Grzyb ten jest endofitem rośliny namorzynowej Sonneratia caseolaris . Jednak został również zidentyfikowany jako patogen w innych roślinach, takich jak soja , u której powoduje chorobę zwaną rozkładem nasion Phomopsis (PSD).
Przygotowanie
Zarówno PXA, jak i PXB zostały odkryte w 2001 roku, a ich przygotowanie poprzez izolację z kultur grzybów Phomopsis opisano w odpowiedniej publikacji. H2O Pokrótce kultury , ekstrakt MeOH z Phomopsis miesza się z i przemywa heksanem . Następnie fazę wodną suszy się, a pozostałość rozpuszcza w EtOAc , przemywa H2O , zatęża i wielokrotnie oczyszcza metodą chromatografii wykluczania . Otrzymaną mieszaninę PXA i PXB rozdziela się HPLC . Zmodyfikowana metoda, w której wstępną ekstrakcję przeprowadza się EtOAc zamiast MeOH i pomija etap suszenia, opisano w 2013 roku.
Używa
Fomoksanton A został po raz pierwszy zidentyfikowany podczas badań przesiewowych pod kątem związków przeciwmalarycznych . Wykazał silne działanie antybiotyczne przeciwko wielolekoopornemu szczepowi głównego czynnika wywołującego malarię , pierwotniaka pasożytniczego Plasmodium falciparum . To samo badanie wykazało również działanie antybiotyczne PXA przeciwko Mycobacterium tuberculosis i przeciwko trzem zwierzęcym liniom komórkowym, z których dwie pochodziły z ludzkich komórek nowotworowych. Odkrycia te nie tylko wykazały, że PXA ma działanie antybiotyczne przeciwko bardzo różnym organizmom, ale także zapoczątkowały dalsze badania, które badały PXA jako potencjalny antybiotyk lub lek przeciwnowotworowy . Późniejsze badanie wykazało również aktywność antybiotyczną PXA wobec glonów Chlorella fusca , grzyba Ustilago violacea i bakterii Bacillus megaterium . Tak szeroki zakres działania dyskwalifikował go jako specyficzny antybiotyk, który mógłby być stosowany w leczeniu chorób zakaźnych , pozostała jednak nadzieja, że może być stosowany jako lek przeciwnowotworowy. Wstępne wyniki badań na ludzkich komórkach nowotworowych i komórkach nienowotworowych sugerowały, że PXA może być bardziej toksyczny dla tych pierwszych niż dla tych drugich, chociaż wyniki badań in vivo nie zostały jeszcze przedstawione.
Oprócz potencjalnego zastosowania medycznego, ostatnie odkrycia wskazują, że PXA może mieć zastosowanie jako narzędzie badawcze w badaniu dynamiki błony mitochondrialnej, w szczególności niekanonicznego rozszczepienia mitochondrialnego i przebudowy macierzy mitochondrialnej.
Aktywność biologiczna
Ponieważ PXA ma działanie antybiotyczne przeciwko organizmom tak różnorodnym, jak bakterie, pierwotniaki, grzyby, rośliny i komórki zwierzęce, w tym ludzkie komórki nowotworowe, musi wpływać na cechę komórkową, która jest ewolucyjnie wysoce konserwatywna. Niedawne badania wykazały, że PXA bezpośrednio wpływa na mitochondria, zakłócając zarówno ich funkcje biochemiczne, jak i architekturę błony. Mitochondria to organelle komórkowe obecne u prawie wszystkich organizmów eukariotycznych . Zgodnie z teorią symbiogenezy , pochodzą z bakterii i mają z nimi wiele wspólnych cech, w tym kilka właściwości ich składu błony.
Jedną z głównych funkcji mitochondriów jest wytwarzanie komórkowej waluty energetycznej ATP w procesie fosforylacji oksydacyjnej (OxPhos). OxPhos zależy od potencjału błony mitochondrialnej , który jest generowany przez łańcuch transportu elektronów (ETC) poprzez zużycie tlenu . Wykazano, że PXA zakłóca wszystkie te funkcje mitochondriów: nie tylko zmniejsza syntezę ATP i depolaryzuje mitochondria, ale także hamuje ETC i komórkowe zużycie tlenu. To odróżnia go od środków rozprzęgających jak protonofory . Chociaż zmniejszają one również syntezę ATP i depolaryzują mitochondria, jednocześnie zwiększają oddychanie z powodu zwiększonej aktywności ETC w celu przywrócenia potencjału błonowego.
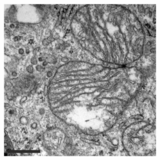
Oprócz tego hamowania funkcji mitochondriów, PXA zaburza również ich architekturę błonową. W wielu typach komórek mitochondria zwykle tworzą skomplikowaną sieć rur, która przechodzi ciągły proces zrównoważonego rozszczepienia mitochondriów i fuzji mitochondriów . Leczenie PXA lub wieloma innymi stresorami mitochondrialnymi, takimi jak protonofory, powoduje nadmierne rozszczepienie, które skutkuje fragmentacją mitochondriów. Jednak w przypadku PXA wykazano, że ten proces fragmentacji różni się od fragmentacji kanonicznej, powodowanej przez inne czynniki, takie jak protonofory, na kilka sposobów: po pierwsze, jest znacznie szybszy, co skutkuje całkowitą fragmentacją w ciągu minuty, w przeciwieństwie do około 30–60 minut w przypadku fragmentacji kanonicznej; po drugie, jest niezależny od regulatorów rozszczepienia i fuzji mitochondriów DRP1 i OPA1; i po trzecie, podczas gdy PXA powoduje fragmentację obu zewnętrznej błonie mitochondrialnej (OMM) i macierzy mitochondrialnej w komórkach typu dzikiego , powoduje wyłączną fragmentację macierzy w komórkach pozbawionych DRP1. Ta ostatnia cecha jest szczególnie niezwykła, ponieważ u wyższych eukariotów nie jest znany żaden aktywny mechanizm wyłącznego rozszczepienia macierzy. Badanie ultrastruktury mitochondriów wykazało, że PXA powoduje cristae i całkowite zniekształcenie macierzy mitochondrialnej. Prawdopodobnie dzięki temu efektowi PXA indukuje zaprogramowaną śmierć komórki w postaci apoptozy .
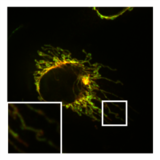
Normalna, cylindryczna morfologia mitochondriów w komórce HeLa , w której wyeliminowano mediator rozszczepienia DRP1 . Obraz nakładki macierzy mitochondrialnej (zielony) i OMM (czerwony).
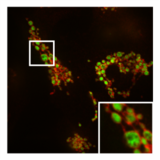
Traktowanie komórek z nokautem DRP1 za pomocą PXA powoduje nadmierne rozszczepienie IMM, podczas gdy OMM kurczy się wokół niego, ale pozostaje nienaruszony.
Linki zewnętrzne
-
 Media związane z Phomoxantonem w Wikimedia Commons
Media związane z Phomoxantonem w Wikimedia Commons