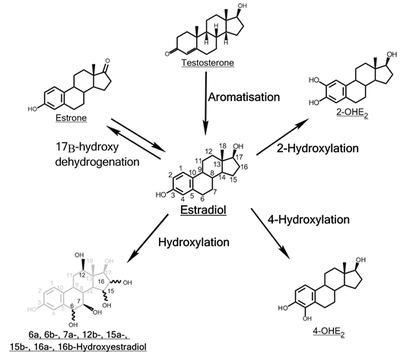
Hydroksylacja estradiolu
Hydroksylacja estradiolu jest jedną z głównych dróg metabolizmu estrogenowego hormonu steroidowego estradiolu . Jest hydroksylowany do estrogenów katecholowych 2-hydroksyestradiolu i 4-hydroksyestradiolu oraz do estriolu (16α-hydroksyestradiolu). Reakcje te są katalizowane przez enzymy cytochromu P450 głównie w wątrobie , ale także w różnych tkanki .
2-hydroksylacja
Dodanie grupy hydroksylowej w pozycji C2 stanowi główny wątrobowy szlak metabolizmu estradiolu, w którym pośredniczą CYP1A2 , CYP2C8 , CYP2C9 i CYP3A4 . W pozawątrobowej 2-hydroksylacji pośredniczą głównie CYP1A1 i CYP3A4 .
2-Hydroksyestradiol (2-OHE 2 ) może podlegać trzem przemianom metabolicznym: metylacji z wytworzeniem 2-meOHE 2 , utlenieniu z wytworzeniem chinonów lub odwodornieniu z wytworzeniem 2-OHE 1 .
2-OHE 2 może wiązać się z receptorami estrogenowymi , ale ze znacznie niższym powinowactwem. Metabolit ten ma kilka konsekwencji fizjologicznych: zdolność wpływania na sygnalizację wewnątrzkomórkową, wydzielanie hormonów przysadki mózgowej, powstawanie rodników i chinonów oraz hamowanie powstawania nowotworów. Wykazano słabą aktywność rakotwórczą, prawdopodobnie z powodu rodników i indukcji pęknięć jednoniciowego DNA.
Inaktywacja 2-OHE 2 jest katalizowana przez katecholo-O-metylotransferazę (COMT), przy czym COMT wykazuje szybsze tempo metylacji 2-OHE 2 w porównaniu z 4-OH-E 2 . COMT, enzym przenoszony przez krew, pośredniczy w najpowszechniejszej postaci inaktywacji 2- lub 4-hydroksyestradiolu, oprócz glukuronidacji i siarczanowania. Jednak ta inaktywacja może pozwolić na akumulację 4-OHE 2 , ponieważ 2-OHE 2 hamuje metylację 4-OHE 2 przez COMT, ale 4-OHE 2 nie hamuje 2-OH-E 2 w zamian metylacja.
, że aktywność przeciwnowotworowa 2 -meOE2 jest zależna od efektów antyproliferacyjnych i przeciwprzerzutowych. Wydaje się, że hamowanie proliferacji komórkowej i przerzutów następuje poprzez indukcję kaspazy-8 , po której następuje kaspaza-3 i ostatecznie fragmentacja DNA. Indukcja apoptozy przez 2-meOE2 może być zależna lub niezależna od p53 . Stwierdzono również, że 2-meOE2 hamuje aktywność aromatazy, obniżając w ten sposób syntezę E2 in situ w tkance nowotworowej. 2-meOE 2 ma większe powinowactwo wiązania do globulina wiążąca hormony płciowe (SHBG) niż E 2 i 2-OH-E 2 i nie ma powinowactwa do receptora estrogenowego.
2-meOE 2 jest również silnym inhibitorem angiogenezy w tkankach nowotworowych. Podawanie tego metabolitu estradiolu zapobiega wzrostowi mięśni gładkich naczyń. To hamowanie angiogenezy jest eliminowane przez jednoczesne podawanie z cytochromu P450 i COMT, co potwierdza udział enzymów cytochromu P450 w blokowaniu dopływu krwi do guza.
Dalsza aktywność przeciwnowotworowa 2-meOE2 została zidentyfikowana poprzez immunomodulację. Cytokiny IL-6 i TNFα , jak również prostaglandyna PGE2 , są zdolne do stymulowania aktywności aromatazy. Ponieważ makrofagi i limfocyty są obecne w tkance piersi, zapewnia to niepokojące sposoby zwiększania biosyntezy estradiolu in situ. 2-meOE 2 jest w stanie zmniejszyć o połowę podstawową aktywność aromatazy w fibroblastach sutka , prawdopodobnie poprzez destabilizację mikrotubul które pośredniczą w translokacji receptorów cytokin do błony plazmatycznej. Zaobserwowano również zahamowanie syntezy receptora cytokin oraz blokadę autokrynnego i parakrynnego działania cytokin i PGE 2 .
4-hydroksylacja

Enzymem najbardziej odpowiedzialnym za 4-hydroksylację estradiolu jest CYP1B1 . U ludzi mRNA i białko CYP1B1 wykazują konstytutywną ekspresję w płucach i nerkach, a także w tkankach regulowanych estrogenami, takich jak piersi, jajniki i macica. Podczas gdy 4-hydroksylacja stanowi drugorzędny szlak w wątrobie, większy udział ekspresji CYP1B1 w tkankach pozawątrobowych przesuwa równowagę na korzyść tworzenia 4-OH- E2 . Uważa się, że 4-OH-E 2 jest najbardziej rakotwórczym ze wszystkich metabolitów estradiolu, zwłaszcza biorąc pod uwagę, że CYP1B1 wykazuje nadekspresję w nowotworach raka sutka.
4-OH-E2 , podobnie jak 2-OH-E2 , może być fizjologicznie aktywny, jak również rakotwórczy. 4-OH-E2 jest zdolny do wiązania ER ze zmniejszoną szybkością dysocjacji i przedłużoną aktywacją, indukując w ten sposób wzrost i proliferację komórek, wydzielanie hormonów gruczołowych przysadki i wytwarzanie prostaglandyn.
Das i in. zaangażowany 4-OH-E 2 w indukcję genów reagujących na estrogen, odpowiedź, która wykazywała częściowe zniesienie lub brak zniesienia przez jednoczesne podawanie z antyestrogenem, dostarczając dowodów na zdolność 4-OH-E 2 do przeprowadzania genetycznej regulacji w górę poprzez szlak niezależny od sygnalizacji ER. Efekty niezależne od wiązania ER obejmują pękanie jednoniciowego DNA, zwłaszcza podczas interakcji synergistycznej z tlenkiem azotu w ludzkich komórkach raka piersi oraz wytwarzanie chinonów i wolnych rodników.
CYP1B1 może być indukowany przez E2 . ERα, po związaniu się z estradiolem, oddziałuje z CYP1B1 ERE , stymulując ekspresję CYP1B1. Tak więc, chociaż E 2 powoduje zmiany genetyczne sprzyjające własnej inaktywacji, spadek aktywności estrogenowej daje toksykologicznie aktywny metabolit, który stanowi dodatkowy szlak karcynogenezy zależnej od estradiolu .
4-OH-E 2 ma taki sam schemat metaboliczny jak 2-OH-E 2 : metylacja do 4-metoksyestradiolu (4-meOE 2 ), utlenianie do chinonów lub odwodornienie do 4-OH-E 1 . Koniugacja przez wszechobecny COMT reprezentuje najpowszechniejszy pozawątrobowy szlak inaktywacji 4-OH- E2 . Jednakże, jeśli homeostaza estrogenu jest zachwiana przez wzrost CYP1B1 i spadek COMT, wystąpi większy stopień tworzenia genotoksycznego chinonu z 4-OH-E2 . 4-OHE 2 może być utleniany przez mikrosomalne CYP lub peroksydazy z wytworzeniem estradiolo-3,4-semichinonu. Ten semichinon może ulegać cyklom redoks z tlenem, tworząc estradiolo-3,4-chinon (E 2-3,4 -Q) i nadtlenek. E2-3,4 -Q można przekształcić z powrotem w 4-OHE2 w jednym etapie za pomocą reduktazy chinonowej lub w dwóch kolejnych etapach katalizowanych przez reduktazę P450 za pośrednictwem semichinonowego związku pośredniego . Aktywność GSH/S-transferazy może znosić poziomy E2-3,4 - Q poprzez tworzenie koniugatów glutationu.
E2-3,4 -Q jest silnym nukleofilem i łatwo reaguje z elektrofilowym DNA . Daje to tworzenie adduktów DNA 4-OHE 2-1 -N7Gua i 4-OHE 2-1 -N3Ade poprzez addycję Michaela . Destabilizacja wiązania glikozylowego między zasadą azotową a cukrem rybozy tworzy miejsca apurynowe, ponieważ niestabilne addukty są tracone z DNA. 4-OHE 2 -1-N7Gua ma stosunkowo powolny okres półtrwania w usuwaniu ok. 3 godziny, dając wystarczająco dużo czasu mechanizmom naprawy wycinania zasad, aby skorygować zmianę. Jednak 4-OHE 2 -1-N3Ade wykazuje natychmiastowe oczyszczenie, co prowadzi do podatnej na błędy naprawy i indukcji mutacji. Rzeczywiście, wykazano, że E2-3,4-Q powoduje mutacje A-do-G w genie kodującym H-ras, przy czym ras są niezbędne do prawidłowej regulacji odpowiedzi komórkowej na czynniki wzrostu . Chociaż 2- i 4-OHE 2 mają podobne potencjały redoks, a zatem podobną aktywność cykliczną redoks, większa zdolność rakotwórcza 4-OHE 2 można przypisać zwiększonej reaktywności z DNA. Innym szkodliwym efektem cyklu redoks estrogenu jest wytwarzanie rodników ponadtlenkowych i hydroksylowych. Kataliza reduktazy P450 wytwarza rodniki nadtlenkowe, które w obecności dysmutazy ponadtlenkowej i Fe 3+ mogą tworzyć wysoce reaktywne rodniki hydroksylowe zdolne do uszkodzenia praktycznie wszystkich makrocząsteczek.
16α-hydroksylacja
Poprzez działanie izoform CYP1A1 , CYP1A2 , CYP2C8 i CYP3A , 16α-hydroksyestradiol (16α-OHE 2 ), znany również jako estriol, jest wytwarzany w dużych ilościach podczas ciąży. 16α-OHE 2 można odwodornić do 16α-hydroksyestronu (16α-OHE 1 ), metabolitu, który, jak wykazano, wiąże się kowalencyjnie z receptorem estrogenowym poprzez tworzenie zasady Schiffa. To wiązanie kowalencyjne występuje między karbonylkiem steroidu a grupą ε-aminową lizyny. Teoretycznie 16α-OHE 1 może również wiązać DNA, chociaż tego nie zaobserwowano. 16α-OHE2 jest silnym agonistą ER, zdolnym do stymulacji proliferacji komórkowej na poziomie zbliżonym do uzyskiwanego z E2 . Chociaż badania na modelach guza nerki chomika wykazały słabą rakotwórczość, potencjał rakotwórczy 16α-OHE 2 u ludzi pozostaje nieznany.
Inne hydroksylacje
Funkcja pozostałych hydroksylowanych metabolitów E2 ( 6α-, 6β-, 7α-, 12β-, 15α-, 15β- i 16β-OHE2 ) pozostaje do wyjaśnienia. Niektóre z tych metabolitów, takie jak 15α-OHE 2 , są wydalane w stosunkowo dużych ilościach u kobiet w ciąży, prawdopodobnie służąc jako wskaźnik dobrego zdrowia płodu .