Odkrycie i rozwój inhibitorów integrazy
Pierwszy przypadek ludzkiego wirusa niedoboru odporności ( HIV ) odnotowano w Stanach Zjednoczonych na początku lat 80. Odkryto wiele leków leczących tę chorobę, ale mutacje w wirusie i oporność na leki utrudniają rozwój. Integraza jest wirusowym enzymem , który integruje DNA retrowirusa z genomem komórki gospodarza . Inhibitory integrazy to nowa klasa leków stosowanych w leczeniu HIV. Pierwszy inhibitor integrazy, raltegrawir , został zatwierdzony w 2007 roku, a inne leki były w badaniach klinicznych w 2011 roku.
Historia
Organizm wykorzystuje swój układ odpornościowy do ochrony przed bakteriami, wirusami i innymi istotami chorobotwórczymi, a gdy tego nie robi, pojawiają się choroby niedoboru odporności. Jedną z takich chorób jest zespół nabytego niedoboru odporności ( AIDS ), który jest najczęściej wynikiem zakażenia ludzkim wirusem niedoboru odporności (HIV). Zidentyfikowano dwa blisko spokrewnione typy HIV, HIV-1 i HIV-2 . Podczas gdy HIV-2 rozprzestrzenia się w Indiach i Afryce Zachodniej, HIV-1 jest bardziej zjadliwy i jest główną przyczyną AIDS na całym świecie. Chociaż niektórzy pacjenci mają różne wyniki, w większości przypadków osoby zakażone wirusem HIV rozwijają AIDS i ostatecznie umierają z powodu infekcji oportunistycznych lub raka . Integracja z genomem retrowirusa ma kluczowe znaczenie dla ekspresji genów i replikacji wirusa . Genom wirusa jest poddawany odwrotnej transkrypcji do DNA zakażonej komórki przez wirusową odwrotną transkryptazę , DNA jest następnie integrowany z chromosomami komórki gospodarza za pomocą wirusowej integrazy. Transkrypty RNA są wytwarzane ze zintegrowanego wirusowego DNA i służą zarówno jako mRNA do kierowania syntezą białek wirusowych, jak i później jako genomy RNA nowych cząstek wirusowych. Cząsteczki wirusa uciekają z komórki przez pączkowanie z błony plazmatycznej, z których każda jest zamknięta w otoczce błony .
W tym procesie integraza HIV-1 jest niezbędna, a zatem bardzo obiecującym celem dla projektowania leków przeciw AIDS. Selektywne projektowanie leków jest możliwe, ponieważ integraza HIV-1 nie ma znanego odpowiednika komórkowego. Odkryto i zaprojektowano wiele inhibitorów integrazy, ale tylko kilka z nich zostało rozwiniętych i dotarło do II lub III fazy badań klinicznych . Raltegrawir (nazwa handlowa Isentress) uzyskał przyspieszoną zgodę Amerykańskiej Agencji ds. Żywności i Leków (FDA) w październiku 2007 r. oraz EMEA (obecnie EMA ) w grudniu 2007 r. Był sprzedawany jako lek przeciwretrowirusowy (ARV) dla dorosłych zakażonych wirusem HIV-1 który był już narażony na co najmniej trzy klasy leków antyretrowirusowych i wykazywał oporność wielolekową. Ogólnie istnieją dwie główne grupy inhibitorów integrazy; Inhibitory przenoszenia nici integrazy (INSTI) i inhibitory wiązania integrazy (INBI). INSTI hamują wiązanie kompleksu przedintegracyjnego ( PIC ) i DNA gospodarza, a INBI hamują wiązanie integrazy i wirusowego DNA. Raltegrawir jest inhibitorem integrazy INSTI, który hamuje zarówno replikację HIV-1, jak i HIV-2. Jest silniejszy niż inne znane wcześniej inhibitory integrazy, a także powoduje mniej skutków ubocznych. Raltegrawir, Elwitegrawir, Dolutegrawir i Biktegrawir są jedynymi inhibitorami integrazy HIV-1 stosowanymi w leczeniu zakażeń wirusem HIV S/GSK1349572 .
Enzym integraza HIV-1
Integraza HIV-1 (IN) jest kluczowym enzymem w mechanizmie replikacji retrowirusów. Odpowiada za przeniesienie wirusowo kodowanego DNA do chromosomu gospodarza, co jest niezbędnym zdarzeniem w replikacji retrowirusa. Ponieważ IN nie ma odpowiednika w komórce gospodarza, inhibitory integrazy mają wysoki indeks terapeutyczny , ponieważ nie zakłócają normalnych procesów komórkowych.
Struktura
IN należy, zarówno mechanicznie, jak i strukturalnie, do nadrodziny transferaz polinukleotydylowych 10 i składa się z 288 aminokwasów, które tworzą białko o masie cząsteczkowej 32 kDa. Retrowirusy kodują swoje enzymy (proteazę, odwrotną transkryptazę i integrazę) genem POL z końcem 3 kodującym IN.
IN składa się z 3 strukturalnie niezależnych, funkcjonalnych domen (patrz ryc. 1).:
1. Domena N-końcowa (NTD) obejmuje aminokwasy 1–50 i zawiera dwie reszty histydyny (His12 i His16) oraz dwie reszty cysteiny (Cys40 i Cys43), z których wszystkie są całkowicie konserwatywne i tworzą motyw palca cynkowego HHCC . Pojedyncze mutacje którejkolwiek z tych czterech reszt zmniejszają aktywność enzymatyczną IN. Motyw palca cynkowego HHCC chelatuje jeden atom cynku na monomer IN . NTD jest wymagany do multimerów wyższego rzędu , co wydaje się być jego główną rolą. Multimeryzacja wymaga atomu cynku, który stabilizuje fałd.
2. Domena rdzenia katalitycznego (CCD), która obejmuje aminokwasy 51-212, zawiera miejsce aktywne IN, ale nie może katalizować integracji pod nieobecność NTD i CTD (domena C-końcowa). CCD zawiera trzy całkowicie konserwowane ujemnie naładowane aminokwasy; D64, D116 i E152. Aminokwasy te tworzą motyw DDE, który koordynuje jony metali dwuwartościowych (Mg 2+ lub Mn 2+ ). Te jony metali są niezbędne do katalizy integracji. CCD ma mieszaną strukturę β i α z pięcioma arkuszami β i sześcioma helisami α , które są połączone elastycznymi pętlami. Elastyczne pętle umożliwiają zmiany konformacyjne, które są wymagane do przetwarzania 3´ wirusowego DNA i reakcji przeniesienia nici (STF), które są dwoma kluczowymi etapami reakcji integracji. CCD ma zasadnicze znaczenie dla tych etapów, a podstawienie którejkolwiek z reszt w motywie DDE radykalnie hamuje aktywność IN.
3. Domena C-końcowa (CTD), która obejmuje aminokwasy 213–288, wiąże DNA niespecyficznie, a jej interakcja z NTD i CCD jest wymagana do przetwarzania IN 3´ i przenoszenia nici. CTD jest najmniej konserwowaną z trzech domen. IN działa jako multimer i dimeryzacja jest wymagana na etapie przetwarzania 3', przy czym tetrameryczny IN katalizuje reakcję przeniesienia nici. [ potrzebne źródło ]
Funkcjonować
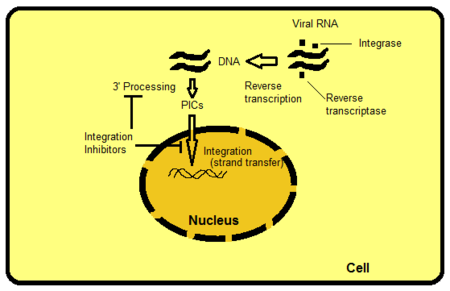
Integracja HIV-1 zachodzi poprzez wieloetapowy proces, który obejmuje dwie reakcje katalityczne: 3´endonukleolityczne przetwarzanie końców prowirusowego DNA (określane jako przetwarzanie 3´) oraz integracja wirusowego DNA poddanego obróbce 3´ z DNA komórkowym (określane jako przeniesienie nici). W przetwarzaniu 3' IN wiąże się z krótką sekwencją znajdującą się na każdym końcu długiego powtórzenia końcowego (LTR) wirusowego DNA i katalizuje cięcie endonukleotydu. Powoduje to eliminację dinukleotydu z każdego z 3´-końców LTR. Rozszczepiony DNA jest następnie używany jako substrat do integracji lub przenoszenia nici. Przeniesienie nici to transestryfikacji obejmująca bezpośredni atak nukleofilowy grupy 3'hydroksylowej dwóch nowo przetworzonych wirusowych końców 3'-DNA na szkielet fosfodiestrowy docelowego DNA gospodarza. Prowadzi to do kowalencyjnej insercji wirusowego DNA do genomu zainfekowanej komórki. Przeniesienie nici następuje jednocześnie na obu końcach wirusowej cząsteczki DNA, z przesunięciem dokładnie pięciu par zasad między dwoma przeciwległymi punktami wstawienia. Reakcja integracji jest zakończona przez usunięcie niesparowanych dinukleotydów z 5'-końca wirusowego DNA, naprawę jednoniciowych przerw utworzonych między cząsteczkami wirusowego i docelowego DNA oraz ligację 3'-końca z 5'-końcem DNA gospodarza. Metale dwuwartościowe, Mg2 + lub Mn2 + , są wymagane do etapów obróbki 3' i przenoszenia nici, jak również do składania IN na DNA specyficznego dawcy wirusowego w celu utworzenia kompleksu, który jest kompetentny do pełnienia obu funkcji. Ponieważ obfitość magnezu (Mg 2+ ) w stosunku do manganu (Mn 2+ ) w ludzkich komórkach jest 1 000 000 razy większa, magnez wydaje się łatwiej dostępnym dwuwartościowym kofaktorem do integracji.
Mechanizm akcji
Istnieje kilka sposobów ukierunkowania na integrazę, ale inhibicja transferu nici jest najbardziej intuicyjnie oczywista i jak dotąd najłatwiejsza do zrealizowania. Inne cele obejmują, na przykład, domeny białkowe poza miejscem aktywnym IN. Domeny oddziałują z DNA wirusa lub gospodarza i są ważne dla wiązania się z enzymem. Możliwe jest zakłócenie funkcji enzymu poprzez przerwanie lub usunięcie tych wiązań. PIC to multimeryczna struktura białkowa wewnątrz komórki gospodarza, złożona zarówno z białek wirusowych, jak i gospodarza. Integraza jest częścią wirusowego komponentu PIC. Uważa się, że białka wirusowe i gospodarza PIC modulują wewnętrzną aktywność enzymu, przenoszą PIC do jądra i bezpośrednio integrują wirusowy DNA z aktywnym transkrypcyjnie regionem genomu gospodarza. Gdyby możliwe było wykluczenie pewnych białek z PIC, zablokowałoby to zdolność wirusa do integracji z genomem gospodarza. Proces, w którym retrowirusowy RNA jest transkrybowany do DNA, a następnie integrowany z genomem komórki gospodarza, pokazano na rycinie 2.
Inhibitory przeniesienia nici IN (INSTI)
Mg 2+ i Mn 2+ są krytycznymi kofaktorami w fazie integracji. Inaktywacja tych kofaktorów (np. poprzez chelatację) powoduje upośledzenie czynnościowe IN. Ta koncepcja daje naukowcom możliwość zaprojektowania i opracowania wysoce wydajnych inhibitorów IN (INI). W rzeczywistości wszystkie małocząsteczkowe INI HIV-1, które są obecnie badane, zawierają motyw strukturalny, który koordynuje dwa dwuwartościowe jony magnezu w miejscu aktywnym enzymu.
Raltegrawir i elwitegrawir mają ten sam mechanizm działania przeciwko integrazie: wiążą się z miejscem aktywnym jonów Mg 2+ . Konkurencyjne inhibitory konkurują bezpośrednio z wirusowym DNA o wiązanie z integrazą w celu zahamowania przetwarzania 3'-końca. W ten sposób inhibitory całkowicie blokują miejsce aktywne przed wiązaniem się z docelowym DNA. To hamowanie nazywa się hamowaniem przenoszenia nici .
Hamowanie interakcji LEDGF/p75-integraza
Czynnik wzrostu pochodzący z nabłonka soczewki ( LEDGF/p75 ) jest białkiem gospodarza, które wiąże się z integrazą i ma kluczowe znaczenie dla replikacji wirusa. Mechanizm działania nie jest dokładnie znany, ale dowody sugerują, że LEDGF/p75 kieruje integrazą w celu wstawienia wirusowego DNA do aktywnych transkrypcyjnie miejsc genomu gospodarza. Inhibitory tego białka są już opracowywane i opatentowane. Prawdopodobnie będą wysoce swoiste wobec celu i mniej podatne na rozwój oporności.
Inhibitory wiązania IN
Inną klasą INI mogą być inhibitory wiązania IN (INBI), takie jak V-165. V-165 jest związkiem, który hamuje integrację, ale bez oczywistego wpływu na syntezę wirusowego DNA. Kiedy zbadano mechanizm działania, wykazano, że V-165 zakłóca tworzenie wirusowego kompleksu DNA-IN. Ze względu na działanie zakłócające jest klasyfikowany jako inhibitor wiązania IN. Inne związki, takie jak styrylochinoliny, mają podobny mechanizm, konkurując z substratem LTR o wiązanie IN.
Projekt leku
Wiążący
INSTI wiążą się ściśle i specyficznie z IN, który jest związany z końcami DNA poprzez chelatowanie jonów metali dwuwartościowych (Mg 2+ ), co jest koordynowane przez triadę katalityczną, tj. motyw DDE. Motyw DDE znajduje się w CCD IN i jest miejscem aktywnym enzymu, dlatego INSTI są tak zwanymi inhibitorami miejsca aktywnego. INSTI wiążą się ze specyficznym miejscem blisko motywu DDE IN, miejscem, które jest obecne tylko w konformacji, która pojawia się po przetworzeniu końców 3' wirusowego DNA. Wirusowe DNA może równie dobrze tworzyć część miejsca wiązania inhibitora. Wiązanie jest formą inhibicji allosterycznej , ponieważ implikuje zablokowanie specyficznego kompleksu integraza-wirusowy DNA. Powoduje to selektywne hamowanie reakcji przenoszenia nici, bez znaczącego wpływu na reakcję przetwarzania 3'. INSTI mogą zatem być bardziej specyficzne i wiązać się selektywnie z docelowym miejscem wiązania DNA, a zatem być mniej toksyczne niż dwufunkcyjne inhibitory, które są zdolne do wiązania się zarówno z miejscem wiązania dawcy, jak i docelowym.
INBI również wiążą się z IN, ale mechanizm działania jest nieznany, więc wiązania nie można szczegółowo opisać.
Zależność struktura-aktywność (SAR)
Do wiązania integrazy niezbędne są dwa składniki strukturalne: hydrofobowe ugrupowanie benzylowe , które zakopuje się w wysoce hydrofobowej kieszeni w pobliżu miejsca aktywnego; oraz triadę chelatującą, która wiąże się z dwoma jonami Mg 2+ w regionie raczej hydrofilowym , zakotwiczając inhibitor na powierzchni białka (patrz ryc. 3). W rzeczywistości wszystkie silne inhibitory integrazy zawierają podstawiony składnik benzylowy, który ma kluczowe znaczenie dla utrzymania siły łączenia 3'-końca. Usunięcie grupy benzylowej zapobiega funkcji hamującej. lipofilowe są zatem korzystne dla hamowania przenoszenia nici, w szczególności podstawienia tiofenylowe , furanylowe i (tiofen-2-ylo)fenylowe. Heteroaromatyczna amina i amid również powodują wzrost działania hamującego przetwarzanie 3'.
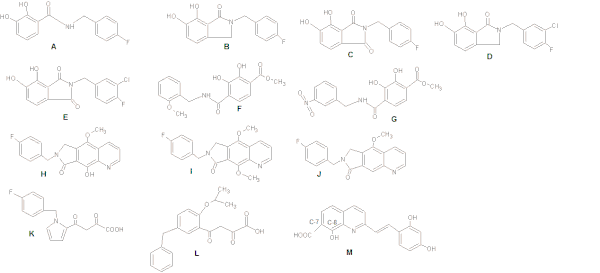
Kiedy badano inhibitory IN na bazie katecholu, zaobserwowano, że utrzymywanie płaskiej relacji z bis-hydroksylowanym pierścieniem arylowym zwiększa siłę działania. Aktywność hamującą można dalej optymalizować przez włączenie podstawnika metachlorowego, wzmacniając oddziaływanie grupy benzylowej z sąsiednią kieszenią hydrofobową (patrz figura 4: Struktury AG).
Grupa hydroksylowa podstawiona benzylem (ryc. 4 H) poprawia zdolność chelatowania metali (w porównaniu ze strukturą J na ryc. 4), podczas gdy grupa metoksylowa (I) jest znacznie słabsza ze względu na zderzenie steryczne dodatkowej grupy metylowej z metalami katalitycznymi .
Podczas badania pochodnych diketo centralny pierścień pirolu o strukturze K na ryc. 4 został zastąpiony serią układów aromatycznych o różnych schematach podstawień. Zapewniło to optymalną względną orientację łańcucha miejsc kwasu benzylowego i kwasu diketokwasowego (DKA). Struktura L na ryc. 4 spowodowało 100-krotny wzrost siły działania.
Benard i wsp. (2004) zsyntetyzowali INI z podjednostką chinoliny i pomocniczym pierścieniem aromatycznym połączonym funkcjonalizowanymi odstępnikami, takimi jak ugrupowanie amidowe, hydrazydowe , mocznikowe i hydroksyprop-1-en-3-onowe. Stwierdzili, że najbardziej obiecujące są pochodne zawierające grupy amidowe. Dzięki syntezie serii styrylochinonów naukowcy odkryli, że grupa karboksylowa przy C-7, grupa hydroksylowa przy C-8 w podjednostce chinoliny i pomocniczy pierścień fenylowy (Rysunek 4: Struktura M) są wymagane do hamowania, chociaż zmiany pierścienia są tolerowane. Do działania hamującego wymagane są również dwie grupy hydroksylowe na pomocniczym pierścieniu fenylowym.
Farmakofor
Ponieważ informacje o krytycznej strukturze katalizy integrazy HIV są rzadkie, trudno jest znaleźć dokładny farmakofor do jej hamowania. Wang i wsp. (2010) mieli nadzieję, że badając SAR i farmakofor rusztowania z podwójnym inhibitorem, skupiając się zarówno na integrazie, jak i odwrotnej transkryptazie (RT), możliwe będzie zaobserwowanie aktywności antyintegrazy. Badając SAR inhibitorów integrazy HIV, można było stwierdzić, że dla optymalnego hamowania integrazy farmakofor wymaga regiospecyficznej (N-1) DKA o określonej długości. Funkcjonalność DKA lub jej heterocykliczny bioizoster , który selektywnie hamuje przenoszenie nici, wydaje się być obecny we wszystkich głównych chemotypach inhibitorów integrazy. Jak wyszczególniono w powyższym omówieniu SAR, dwoma niezbędnymi strukturalnymi składnikami INI są ugrupowanie hydrofobowe benzylu i triada chelatująca do wiązania jonów Mg2 + . Aby triada wiązała jony Mg 2+ , musi być zjonizowana (patrz rys. 5), a zatem bioizoster farmakoforu również musi być zjonizowany, a bioizoster farmakoforu benzylu musi być bardzo hydrofobowy.
Jednak pomimo wcześniejszych sukcesów w rozwoju klinicznym (raltegrawir), brakuje szczegółowego modelu wiązania, więc okazało się, że trudno jest ustrukturyzować podstawę projektu inhibitorów integrazy. Po połączeniu farmakoforu kwasu salicylowego i katecholu powstały nowe rusztowania chemiczne. Sąsiednie grupy hydroksylowe i karboksylowe kwasu salicylowego mogą wiązać się z jonami metali i służyć jako ich farmakofor. Polihydroksylowane inhibitory aromatyczne są głównie aktywne przeciwko reakcjom przenoszenia nici i przetwarzaniu 3', co sugeruje mechanizm ukierunkowany na oba etapy. Jest to bardzo ważna część związku, ponieważ może być stosowana do wiązania metalu dwuwartościowego w miejscu aktywnym IN i jako taka jest skuteczna przeciwko szczepom wirusowym, które są oporne na specyficzne inhibitory przenoszenia nici.
Opór
Odkryto, że ponad 60 odmian mutacji INSTI powoduje oporność in vivo i in vitro . Z powodu tych mutacji i rozwoju oporności inhibitory są mniej skuteczne przeciwko wirusowi. Oporność INI odpowiada oporności innych leków ARV. Pierwsza oporność na IN jest spowodowana mutacjami pierwotnymi, które zmniejszają wrażliwość na INI w połączeniu z mutacjami wtórnymi, które dodatkowo zmniejszają wrażliwość wirusa i/lub naprawiają zmniejszoną sprawność wirusa. Po drugie, istnieje genetyczna bariera dla oporności na INI, określona przez liczbę mutacji wymaganych do utraty klinicznej aktywności INI. Po trzecie, istnieje rozległa, ale niepełna oporność krzyżowa wśród INI. Pętla zawierająca reszty aminokwasowe 140-149 znajduje się w domenie rdzenia katalitycznego i jest ważna dla funkcji IN, jak wspomniano wcześniej. Ta pętla jest elastyczna i chociaż jej rola nie jest do końca znana, uważa się, że jest ważna, a jej funkcje krytyczne dla wiązania DNA. Ta oporność pojawia się w obrębie mutacji w tym regionie kodującym IN. Oporność na raltegrawir i elwitegrawir wynika przede wszystkim z tych samych dwóch szlaków mutacji, ale w przypadku każdego z leków zaangażowane są również inne mutacje pierwotne. Niektóre mutacje zwiększają oporność na leki w większym stopniu niż inne. Na przykład jeden z najczęstszych szlaków mutacji zwiększa oporność na raltegrawir nawet 100 razy bardziej niż drugi najczęstszy. Oporność na inhibitor integrazy S/GSK1349572 jest wciąż rozwijana i oporność nie została w pełni scharakteryzowana. Kiedy oceniano go razem z pierwotnymi mutacjami raltegrawiru i elwitegrawiru, nie wykazywał on oporności krzyżowej, co oznacza, że może być użyteczny przeciwko wirusom opornym na leki. Raltegrawir ma ograniczone wchłanianie jelitowe i dlatego oporności nie można pokonać przepisując większe dawki. Nowsze leki mają gwarancję przezwyciężenia tej wady farmakologicznej i uzyskania stężenia w osoczu wystarczająco wysokiego, aby atakować wirusy oporne na raltegrawir.
Aktualny stan
Poszukiwanie nowych sposobów usprawnienia leczenia pacjentów zakażonych wirusem HIV jest nieustanne. Biorąc pod uwagę doświadczenie, które zostało zebrane od lat 80. XX wieku, kiedy to opracowywano leki ARV, pojawienie się INSTI jako nowej, silnej klasy leków ARV sygnalizuje nową erę w leczeniu HIV. Opracowanie udanego leczenia INSTI zostało zakończone, gdy firma Merck Sharp & Dohme Limited odkryła raltegrawir. Warunkowe pozwolenie na dopuszczenie do obrotu zostało wydane w grudniu 2007 roku przez Komisję Europejską i było ważne w całej Unii Europejskiej . W 2009 roku pozwolenie to zostało przekształcone w pełne pozwolenie na dopuszczenie do obrotu , aw tym samym roku FDA zmieniła zatwierdzenie z przyspieszonego na tradycyjne i wymieniła lek jako środek pierwszego rzutu w leczeniu ARV. Drugi lek INSTI, elwitegrawir, został zidentyfikowany przez Japan Tobacco, a badania kliniczne rozpoczęły się w 2005 r. W 2011 r. lek był nadal w fazie trzeciej badań klinicznych, w których porównuje się go z raltegrawirem, u pacjentów, którzy byli wcześniej leczeni, a także znajduje się w drugiej fazie rozwoju u osób nieleczonych w ramach leczenia wielolekowego. S/GSK1349572 to inhibitor integrazy odkryty przez firmę ViiV/Shinongi, który w 2011 roku wchodził w trzecią fazę badań klinicznych. Ten nowy lek jest obiecujący i wydaje się być dobrze tolerowany oraz jak dotąd wykazuje lepsze wyniki niż zarówno raltegrawir, jak i elwitegrawir.
Ponieważ pojawiły się problemy z opornością na raltegrawir i elwitegrawir, naukowcy rozpoczęli prace nad nowymi inhibitorami integrazy drugiej generacji, takimi jak opracowany w 2009 roku przez firmę Merck MK-2048 . Jest to prototyp INSTI drugiej generacji, który pozostaje silny przeciwko wirusom zawierającym mutacje przeciwko raltegrawirowi i elwitegrawirowi. Mechanizm działania i SAR MK-2048 jest taki sam jak w przypadku innych INSTI, strukturę MK-2048 pokazano na rycinie 6 z zaznaczonym podstawowym farmakoforem.
Chociaż omówione powyżej leki są obiecujące, ich rozwój jest jeszcze bardzo długi i nadal wiele rzeczy nie wiadomo na temat skuteczności, bezpieczeństwa i mechanizmu działania tych leków.
Zobacz też
- Raltegrawir
- Elwitegrawir
- Integraza
- Inhibitor integrazy
- HIV
- Odwrotna transkryptaza
- MK-2048
- Dolutegrawir
- Biktegrawir