Odkrycie i rozwój bezpośrednich inhibitorów trombiny
Bezpośrednie inhibitory trombiny (DTI) to klasa leków przeciwzakrzepowych , które można stosować w zapobieganiu i leczeniu zatorowości i zakrzepów krwi spowodowanych różnymi chorobami . Hamują trombinę , proteazę serynową , która na wiele sposobów wpływa na kaskadę krzepnięcia . DTI przeszły szybki rozwój od lat 90-tych. Dzięki postępowi technologicznemu w inżynierii genetycznej możliwa stała się produkcja rekombinowanej hirudyny , co otworzyło drzwi dla tej nowej grupy leków. Przed zastosowaniem DTI terapia i profilaktyka antykoagulacji pozostawały takie same przez ponad 50 lat z wykorzystaniem pochodnych heparyny i warfaryny , które miały dobrze znane wady. DTI są nadal w fazie rozwoju, ale badania skupiły się na inhibitorach czynnika Xa , a nawet podwójnych inhibitorach trombiny i fXa, które mają szerszy mechanizm działania poprzez hamowanie zarówno czynnika IIa (trombiny), jak i Xa . Niedawny przegląd patentów i literatury na temat inhibitorów trombiny wykazał, że opracowanie allosterycznych i wielomechanizmowych inhibitorów może utorować drogę do bezpieczniejszego antykoagulantu.
Historia
przeciwzakrzepowa ma długą historię. W 1884 roku John Berry Haycraft opisał substancję znajdującą się w ślinie pijawek, Hirudomedicis , która miała działanie przeciwzakrzepowe. Nazwał substancję „ Hirudyna ” od nazwy łacińskiej. Używanie pijawek leczniczych można datować aż do starożytnego Egiptu. Na początku XX wieku Jay McLean, L. Emmet Holt Jr. i William Henry Howell odkryli antykoagulacyjną heparynę , którą wyizolowali z wątroby (hepar). Heparyna pozostaje jednym z najskuteczniejszych antykoagulantów i jest nadal stosowana, chociaż ma swoje wady, takie jak konieczność dożylnego i zmienna krzywa dawka-odpowiedź ze względu na znaczne wiązanie z białkami. W latach 80. opracowano heparynę drobnocząsteczkową (LMWH). Otrzymywane są z heparyny na drodze depolimeryzacji enzymatycznej lub chemicznej i mają lepsze właściwości farmakokinetyczne niż heparyna. W 1955 roku odnotowano pierwsze kliniczne zastosowanie warfaryny , antagonisty witaminy K. Warfaryna była pierwotnie używana jako trutka na szczury w 1948 roku i uważana za niebezpieczną dla ludzi, ale próba samobójcza sugerowała, że jest ona stosunkowo bezpieczna dla ludzi. Antagoniści witaminy K są obecnie najczęściej stosowanymi doustnymi antykoagulantami, a warfaryna była 11. najczęściej przepisywanym lekiem w Stanach Zjednoczonych w 1999 roku i jest obecnie najczęściej przepisywanym doustnym antykoagulantem na całym świecie. Warfaryna ma jednak swoje wady, podobnie jak heparyna, takie jak wąski indeks terapeutyczny i liczne interakcje z żywnością i lekami oraz wymaga rutynowego monitorowania antykoagulacji i dostosowania dawki. Ponieważ zarówno heparyna, jak i warfaryna mają swoje wady, trwają poszukiwania alternatywnych antykoagulantów, a DTI okazują się godnymi konkurentami. Pierwszym DTI była w rzeczywistości hirudyna, która stała się łatwiej dostępna dzięki inżynierii genetycznej . Obecnie jest dostępny w postaci rekombinowanej jako lepirudyna (Refludan) i desyrudyna (Revasc, Iprivask). Następnie opracowano inne DTI z analogiem hirudyny, biwalirudyną, a następnie drobnocząsteczkowymi DTI. Jednak takie DTI miały również skutki uboczne, takie jak powikłania krwotoczne i toksyczność wątroby, a ich długoterminowe skutki były wątpliwe. [ potrzebne źródło ]
Mechanizm akcji
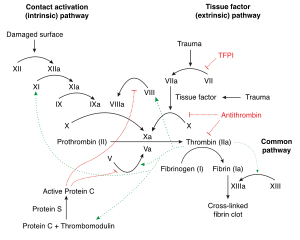
Kaskada krzepnięcia krwi
Kiedy naczynie krwionośne pęka lub ulega uszkodzeniu, czynnik VII wchodzi w kontakt z czynnikami tkankowymi , co rozpoczyna proces zwany kaskadą krzepnięcia krwi . Jego celem jest zatrzymanie krwawienia i naprawa uszkodzeń tkanek. , wzrasta ryzyko zakrzepów lub zatorów . Jak sama nazwa wskazuje, kaskada jest procedurą wieloetapową, w której główny produkt, trombina , powstaje w wyniku aktywacji różnych proenzymów (głównie proteaz serynowych) na każdym etapie kaskady. Trombina ma wiele zastosowań, ale głównie przekształca rozpuszczalny fibrynogen w nierozpuszczalny kompleks fibryny . Ponadto aktywuje czynniki V , VIII i XI , wszystko przez rozszczepienie sekwencji GlyGlyGlyVal Arg-Gly Pro i PhePheSerAla Arg-Gly His, selektywnie między argininą (Arg) i glicyną (Gly). Czynniki te generują więcej trombiny. Trombina aktywuje również czynnik XIII , który stabilizuje kompleks fibryny, a tym samym skrzep i stymuluje płytki krwi , które pomagają w krzepnięciu. Biorąc pod uwagę tak szerokie działanie trombiny, jest ona dobrym celem dla leków przeciwzakrzepowych, takich jak heparyna, warfaryna i DTI, oraz leków przeciwpłytkowych, takich jak aspiryna.
Strony wiążące
Trombina należy do rodziny proteaz serynowych . Ma 3 domeny wiążące , z którymi wiążą się leki hamujące trombinę. Te proteazy mają głęboką wąską szczelinę jako aktywne miejsce wiązania , które składa się z dwóch subdomen β-beczek , które tworzą szczelinę powierzchniową, która wiąże peptydy substratowe . Wydaje się, że powierzchnia w szczelinie ogranicza dostęp do cząsteczek przez zawadę steryczną , to miejsce wiązania składa się z 3 aminokwasów, Asp -102, His -57 i Ser -195. Trombina ma również dwa egzozyty (1 i 2). Trombina różni się nieco od innych proteaz serynowych, ponieważ egzozyt 1 wiąże aniony i wiąże się z fibryną i innymi podobnymi substratami, podczas gdy egzozyt 2 jest domeną wiążącą heparynę.
hamowanie DTI
.
DTI hamują trombinę na dwa sposoby; dwuwartościowe DTI blokują jednocześnie miejsce aktywne i egzozyt 1 i działają jako kompetycyjne inhibitory fibryny, podczas gdy jednowartościowe DTI blokują tylko miejsce aktywne i dlatego mogą zarówno hamować niezwiązaną, jak i związaną z fibryną trombinę. Natomiast leki heparyny wiążą się w miejscu egzozytnym 2 i tworzą pomost między trombiną a antytrombiną , naturalnym antykoagulacyjnym substratem powstającym w organizmie i silnie katalizującym jego działanie. Ale heparyna może również tworzyć pomost między trombiną a fibryną, który wiąże się z egzozytem 1, co chroni trombinę przed hamowaniem funkcji kompleksu heparyna-antytrombina i zwiększa powinowactwo trombiny do fibryny. Wykazano, że DTI, które wiążą się z miejscem wiązania anionów, inaktywują trombinę bez odłączania trombiny od fibryny, co wskazuje na oddzielne miejsce wiązania fibryny. DTI nie są zależne od kofaktorów , takich jak antytrombina, w celu hamowania trombiny, więc mogą zarówno hamować wolną / rozpuszczalną trombinę, jak i trombinę związaną z fibryną, w przeciwieństwie do heparyny. Hamowanie jest nieodwracalne lub odwracalne. Odwracalne zahamowanie często wiąże się z mniejszym ryzykiem krwawienia. Dzięki takiemu działaniu DTI mogą być stosowane zarówno w profilaktyce , jak i leczeniu zatorowości/zakrzepów.
Kieszenie strony aktywnej
DTI, które pasują do aktywnego miejsca wiązania, muszą pasować do kieszeni hydrofobowej (S1), która zawiera resztę kwasu asparaginowego na dole, która rozpoznaje zasadowy łańcuch boczny. Miejsce S2 ma pętlę wokół tryptofanu , która zamyka hydrofobową kieszeń, która może rozpoznawać większe reszty alifatyczne . Miejsce S3 jest płaskie, a miejsce S4 jest hydrofobowe, ma tryptofan wyłożony leucyną i izoleucyną .
Na-(2-naftylo-sulfonylo-glicylo)-DL-p-amidynofenyloalanylo-piperydyna (NAPAP) wiąże trombinę w kieszeniach S1, S2 i S4. Grupa amidynowa na NAPAP tworzy dwukleszczowy mostek solny z Asp głęboko w kieszeni S1, piperydynowa przejmuje rolę reszty proliny i wiąże się w kieszeni S2, a pierścienie naftylowe cząsteczki tworzą oddziaływanie hydrofobowe z Trp w S4 kieszeń. Firmy farmaceutyczne wykorzystały wiedzę strukturalną NAPAP do opracowania DTI. Dabigatran, podobnie jak NAPAP, wiąże się z kieszeniami S1, S2 i S4. benzamidynowa na strukturze dabigatranu wiąże się głęboko w kieszeni S1, metylobenzimidazol dobrze pasuje do hydrofobowej kieszeni S2, a Ile i Leu na dnie kieszeni S4 wiąże się z grupą aromatyczną dabigatranu.
Rozwój leków
Pochodne Hirudyny
pochodne hirudyny są biwalentnymi DTI, blokują zarówno miejsce aktywne, jak i egzozyt 1 w nieodwracalnym kompleksie stechiometrycznym 1: 1 . Miejsce aktywne jest miejscem wiązania globularnej końca aminowego , a miejsce zewnętrzne 1 jest miejscem wiązania kwaśnej domeny końca karboksylowego hirudyny. Natywna hirudyna, 65-aminokwasowy polipeptyd , jest wytwarzana w gruczołach przygardłowych pijawek lekarskich. Dzisiejsze hirudyny są wytwarzane przez rekombinowaną biotechnologię przy użyciu drożdży. Te rekombinowane hirudyny nie mają siarczanowej w Tyr-63 i dlatego są nazywane desulfatohirudynami. Mają 10-krotnie mniejsze powinowactwo wiązania trombiny w porównaniu z natywną hirudyną, ale pozostają wysoce specyficznym inhibitorem trombiny i mają stałą hamowania dla trombiny w zakresie pikomolowym. Klirens nerkowy i degradacja w większości odpowiadają za ogólnoustrojowy klirens desulfatohirudyn, a u pacjentów z przewlekłą chorobą nerek dochodzi do kumulacji leku . Leki te nie powinny być stosowane u pacjentów z zaburzeniami czynności nerek, ponieważ nie ma swoistego antidotum , które odwracałoby ich działanie. Hirudyny podaje się pozajelitowo , zwykle we wstrzyknięciu dożylnym. 80% hirudyny jest rozprowadzane w kompartmencie pozanaczyniowym , a tylko 20% znajduje się w osoczu . Obecnie najpowszechniejszymi desulfatohirudynami są lepirudyna i desyrudyna.
Hirudin
W metaanalizie 11 randomizowanych badań z udziałem hirudyny i innych DTI w porównaniu z heparyną w leczeniu ostrego zespołu wieńcowego (ACS) stwierdzono, że hirudyna ma znacznie większą częstość krwawień w porównaniu z heparyną. Hirudyna nie jest zatem zalecana do leczenia OZW i obecnie nie ma wskazań klinicznych.
Lepirudyna
Lepirudyna jest zarejestrowana do leczenia trombocytopenii indukowanej heparyną (HIT) w USA, Kanadzie, Europie i Australii. HIT jest bardzo poważnym zdarzeniem niepożądanym związanym ze stosowaniem heparyny i występuje zarówno w przypadku heparyny niefrakcjonowanej, jak i LMWH, choć w mniejszym stopniu w przypadku tej drugiej. Jest to immunologicznym , które wynika z odpowiedzi immunologicznej aktywującej płytki krwi wywołanej interakcją heparyny z czynnikiem płytkowym 4 (PF4). Kompleks PF4-heparyna może aktywować płytki krwi i może powodować zakrzepicę żylną i tętniczą. Gdy lepirudyna wiąże się z trombiną, hamuje jej działanie prozakrzepowe. trzy badania prospektywne , zwane trombocytopenią związaną z heparyną (HAT) 1, 2 i 3, w których porównano lepirudynę z historyczną grupą kontrolną w leczeniu HIT. We wszystkich trzech badaniach wykazano, że stosowanie lepirudyny zmniejsza ryzyko nowej zakrzepicy, ale zwiększa ryzyko poważnego krwawienia. Uważa się, że większa częstość występowania poważnych krwawień jest wynikiem zatwierdzonego schematu dawkowania, który był zbyt wysoki, w związku z czym zalecana dawka została zmniejszona o połowę w stosunku do dawki początkowej. Od maja 2012 Bayer HealthCare , jedyny producent zastrzyków lepirudyny, zaprzestał produkcji. Spodziewają się, że dostawy od hurtowników wyczerpią się do połowy 2013 roku.
Desyrudyna
Desyrudyna jest zarejestrowana do leczenia żylnej choroby zakrzepowo-zatorowej (ŻChZZ) w Europie, aw USA trwają obecnie liczne badania III fazy. Przeprowadzono dwa badania porównujące desyrudynę z enoksaparyną (LMWH) lub heparyną niefrakcjonowaną. W obu badaniach desyrudyna została uznana za skuteczniejszą w zapobieganiu ŻChZZ. Desyrudyna zmniejszała również częstość proksymalnej zakrzepicy żył głębokich . Częstość krwawień była podobna w przypadku desyrudyny i heparyny.
Biwalirudyna
Biwalirudyna , polipeptyd złożony z 20 aminokwasów, jest syntetycznym analogiem hirudyny. Podobnie jak hirudyny jest również dwuwartościowym DTI. Ma domenę D-Phe-Pro-Arg-Pro na końcu aminowym, która jest połączona przez cztery reszty Gly z analogiem dodekapeptydu na końcu karboksylowym hirudyny. Domena końca aminowego wiąże się z miejscem aktywnym, a domena końca karboksylowego wiąże się z egzozytem 1 na trombinie. W odróżnieniu od hirudyny, raz związana trombina rozszczepia wiązanie Arg-Pro na końcu aminowym biwalirudyny iw rezultacie przywraca funkcje miejsca aktywnego enzymu. Mimo że karboksy-końcowa domena biwalirudyny jest nadal związana z egzozytem 1 trombiny, powinowactwo wiązania zmniejsza się po uwolnieniu końca aminowego. Pozwala to substratom na konkurowanie z rozszczepioną biwalirudyną o dostęp do egzozytu 1 na trombinie. Stosowanie biwalirudyny badano głównie w przypadku ostrego zespołu wieńcowego. Kilka badań wskazuje, że biwalirudyna nie jest gorsza od heparyny i że biwalirudyna wiąże się z mniejszą częstością krwawień. W przeciwieństwie do hirudyny, biwalirudyna jest tylko częściowo (około 20%) wydalana przez nerki, inne miejsca, takie jak metabolizm wątrobowy i proteoliza , również przyczyniają się do jej metabolizmu, dzięki czemu jest bezpieczniejsza w stosowaniu u pacjentów z zaburzeniami czynności nerek; jednak w ciężkich zaburzeniach czynności nerek konieczne jest dostosowanie dawki.
Drobnocząsteczkowe bezpośrednie inhibitory trombiny
Drobnocząsteczkowe bezpośrednie inhibitory trombiny (smDTI) to niepeptydowe małe cząsteczki, które specyficznie i odwracalnie hamują zarówno wolną, jak i związaną ze skrzepem trombinę, wiążąc się z miejscem aktywnym cząsteczki trombiny. Zapobiegają ŻChZZ u pacjentów poddawanych stawu biodrowego i kolanowego . Zaletą tego typu DTI jest brak konieczności monitorowania, szeroki indeks terapeutyczny oraz możliwość podania drogą doustną . Teoretycznie są wygodniejsze niż zarówno antagonista witaminy K, jak i LMWH. Badania będą jednak musiały wykazać wskazania stosowania i ich bezpieczeństwo.
SmDTI uzyskano stosując projekt peptydomimetyczny z resztą P1 z samej argininy (np. argatroban) lub substratów podobnych do argininy, takich jak benzamidyna (np. NAPAP).
Argatroban
Argatroban to mały jednowartościowy DTI utworzony z reszty P1 z argininy. Wiąże się z miejscem aktywnym trombiny. Rentgenowska struktura kryształu pokazuje, że pierścień piperydyny wiąże się w kieszeni S2, a grupa guanidynowa wiąże się wiązaniami wodorowymi z Asp189 w kieszeni S1. Jest podawany jako bolus dożylny , ponieważ wysoce zasadowa guanidyna o pKa 13 zapobiega jej wchłanianiu z przewodu pokarmowego . Okres półtrwania w osoczu wynosi około 45 minut. Ponieważ argatroban jest metabolizowany w wątrobie i wydalany głównie przez drogi żółciowe , konieczne jest dostosowanie dawki u pacjentów z zaburzeniami czynności wątroby , ale nie z uszkodzeniem nerek. Argatroban jest dopuszczony w USA od 2000 r. do leczenia zakrzepicy u pacjentów z HIT, a od 2002 r. do leczenia przeciwzakrzepowego u pacjentów z HIT w wywiadzie lub zagrożonych HIT poddawanych przezskórnym interwencjom wieńcowym (PCI). Po raz pierwszy została wprowadzona w Japonii w 1990 roku do leczenia chorób naczyń obwodowych.
Ximelagatran
Publikacja struktury krystalicznej NAPAP-fila zapoczątkowała wiele badań nad inhibitorami trombiny. NAPAP jest aktywnym inhibitorem trombiny. Wypełnia kieszenie S3 i S2 swoimi naftalenu i piperydyny . Firma AstraZeneca wykorzystała te informacje do opracowania melagatranu. Związek był słabo dostępny po podaniu doustnym, ale po renowacji otrzymali podwójny prolek , który był pierwszym doustnym DTI w badaniach klinicznych , ximelagatran . Ximelagatran był na rynku europejskim przez około 20 miesięcy, kiedy został zawieszony. Badania wykazały, że leczenie przez ponad 35 dni wiązało się z ryzykiem toksycznego działania na wątrobę . Nigdy nie został zatwierdzony przez FDA .

eteksylan dabigatranu
Naukowcy z firmy Boehringer Ingelheim wykorzystali również opublikowane informacje na temat struktury krystalicznej NAPAP-fIIa, poczynając od struktury NAPAP, która doprowadziła do odkrycia dabigatranu , który jest związkiem bardzo polarnym i dlatego nie jest aktywny po podaniu doustnym. Maskując amidyny jako karbaminian -ester i przekształcając karboksylan w ester , byli w stanie wytworzyć prolek zwany eteksylanem dabigatranu, wysoce lipofilowy , wchłaniany w przewodzie pokarmowym i dostępny biologicznie doustnie podwójny prolek, taki jak ksymelagatran, z okresem półtrwania w osoczu wynoszącym około 12 godzin. Eteksylan dabigatranu jest szybko wchłaniany , nie wchodzi w interakcje z enzymami cytochromu P450 oraz innymi pokarmami i lekami, nie wymaga rutynowego monitorowania, ma szeroki indeks terapeutyczny i podawanie w ustalonej dawce, co jest doskonałym bezpieczeństwem w porównaniu z warfaryną. W przeciwieństwie do ksymelagatranu, długotrwałe leczenie eteksylanem dabigatranu nie zostało powiązane z toksycznością dla wątroby, ponieważ lek jest głównie eliminowany (>80%) przez nerki. Eteksylan dabigatranu został zatwierdzony w Kanadzie i Europie w 2008 roku do zapobiegania ŻChZZ u pacjentów poddawanych operacjom stawu biodrowego i kolanowego. W październiku 2010 roku amerykańska FDA zatwierdziła eteksylan dabigatranu do zapobiegania udarom mózgu u pacjentów z migotaniem przedsionków (AF). Wiele firm farmaceutycznych próbowało opracować leki DTI dostępne biologicznie po podaniu doustnym, ale eteksylan dabigatranu jako jedyny trafił na rynek.
W metaanalizie z 2012 roku dabigatran był związany ze zwiększonym ryzykiem zawału mięśnia sercowego (MI) lub ACS , gdy był testowany z różnymi kontrolami w szerokim spektrum pacjentów.
Tabela 1: Podsumowanie charakterystyk DTI
| Dwuwartościowy/jednowartościowy | Droga podania | Metabolizm | Wiązanie z aktywnym miejscem i/lub egzozytem 1 | Wskazania | Ograniczenia | Zalety | |
| Rdzenny Hirudin | B | (pozajelitowo) | Nie ma żadnych wskazań | ||||
| Lepirudyna | B | Pozajelitowe (iv/sc) | Nerkowy | Nieodwracalny | Zapobieganie dalszej zakrzepicy u pacjentów z HIT | Wąski TI, potencjalnie nasilone krwawienia, u 40% powstają przeciwciała przeciwhirudyczne, konieczność dawkowania w zależności od masy ciała | |
| Desyrudyna | B | Pozajelitowe (iv/sc) | Nerkowy | Nieodwracalny | Europa: leczenie ŻChZZ USA: Profilaktyka DVT u pacjentów poddawanych operacji wymiany stawu biodrowego | Mniejsza potrzeba podawania dawek w zależności od masy ciała i rutynowego monitorowania w porównaniu z lepirudyną z powodu podawania podskórnego | |
| Biwalirudyna | B | Pozajelitowe (iv) | Rozszczepienie proteolityczne, wątroba, 20% nerki | Odwracalny | Zapobieganie ostrym powikłaniom niedokrwiennym u pacjentów z niestabilną dusznicą bolesną oraz zagrożonych HIT poddawanych PTCA lub PCI | W ciężkich zaburzeniach czynności nerek konieczne jest dostosowanie dawki | Zmniejszone ryzyko krwawienia dzięki odwracalnemu wiązaniu, lepszy profil bezpieczeństwa w porównaniu z r-hirudynami, szybki początek działania |
| Argatroban | u | Pozajelitowe (iv) | Wątroby, głównie dróg żółciowych | Odwracalny | Profilaktyka i leczenie zakrzepicy u pacjentów z HIT | Nie jest wymagana dawka bolusa | |
| Ximelagatran | u | Doustny | Wątrobiany | Odwracalny | Europa: Zapobieganie ŻChZZ USA: FDA nigdy nie wydała zgody |
Długotrwała terapia (>35 dni) wiąże się z hepatotoksycznością – wycofana z rynku w Europie | |
| eteksylan dabigatranu | u | Doustny | Głównie w nerkach, pozostała część jest sprzężona z kwasem glukuronowym w wątrobie | Odwracalny | Profilaktyka udaru mózgu i zatorowości u pacjentów z AF | Szybki początek działania, brak interakcji z CYP450, pokarmem lub lekami, szeroki TI, podawanie ustalonej dawki i dobry profil bezpieczeństwa, niezwiązany z hepatotoksycznością przy długotrwałym stosowaniu |
iv: dożylne , sc: podskórne , HIT: małopłytkowość poheparyna , ŻChZZ: żylna choroba zakrzepowo -zatorowa , DVT: zakrzepica żył głębokich , PTCA: przezskórna śródnaczyniowa angioplastyka wieńcowa, PCI: przezskórna interwencja wieńcowa , FDA: Food and Drug Administration , AF: migotanie przedsionków , TI: Indeks terapeutyczny
Stan 2014
W 2014 roku dabigatran pozostaje jedynym zatwierdzonym doustnym DTI i dlatego jest jedyną alternatywą DTI dla antagonistów witaminy K. Istnieją jednak nowe doustne leki przeciwzakrzepowe, które znajdują się obecnie we wczesnych i zaawansowanych stadiach rozwoju klinicznego . Większość z tych leków należy do klasy bezpośrednich inhibitorów czynnika Xa , ale istnieje jeden DTI o nazwie AZD0837, który jest kolejnym związkiem ximelgatranu opracowywanym przez firmę AstraZeneca. Jest prolekiem silnego , kompetycyjnego, odwracalnego inhibitora wolnej i związanej z fibryną trombiny o nazwie ARH0637. Rozwój AZD 0837 zostaje przerwany. Ze względu na zidentyfikowane ograniczenia długoterminowej stabilności produktu leczniczego AZD0837 o przedłużonym uwalnianiu, badanie kontrolne przeprowadzone przez ASSURE dotyczące zapobiegania udarom u pacjentów z niezastawkowym migotaniem przedsionków zostało przedwcześnie zamknięte w 2010 roku po 2 latach. Odnotowano również liczbowo wyższą śmiertelność w przypadku warfaryny. W badaniu fazy 2 dotyczącym AF średnie stężenie kreatyniny w surowicy wzrosło o około 10% w stosunku do wartości wyjściowych u pacjentów leczonych AZD0837, które powróciło do wartości wyjściowych po zaprzestaniu leczenia. Zaprzestano opracowywania innych doustnych DTI, takich jak Sofigatran firmy Mitsubishi Tanabe Pharma . Inną strategią opracowywania doustnych leków przeciwzakrzepowych jest strategia podwójnych inhibitorów trombiny i fXa, o której informowały niektóre firmy farmaceutyczne, w tym Boehringer Ingelheim. Związki te wykazują korzystne działanie przeciwkrzepliwe in vitro .