Odkrycie i rozwój nienukleozydowych inhibitorów odwrotnej transkryptazy
Nienukleozydowe inhibitory odwrotnej transkryptazy (NNRTI) to leki przeciwretrowirusowe stosowane w leczeniu ludzkiego wirusa niedoboru odporności ( HIV ). NNRTI hamują odwrotną transkryptazę (RT), enzym kontrolujący replikację materiału genetycznego wirusa HIV. RT jest jednym z najpopularniejszych celów w dziedzinie opracowywania leków przeciwretrowirusowych.
Odkrywanie i rozwój NNRTI rozpoczęto pod koniec lat 80. XX wieku, a pod koniec 2009 r. cztery NNRTI zostały zatwierdzone przez organy regulacyjne, a kilka innych przechodziło badania kliniczne . Oporność na leki rozwija się szybko, jeśli NNRTI są podawane w monoterapii , dlatego NNRTI są zawsze podawane jako część terapii skojarzonej , wysoce aktywnej terapii przeciwretrowirusowej ( HAART ).
Historia
Zespół nabytego niedoboru odporności ( AIDS ) jest główną przyczyną śmierci na świecie. Jako chorobę zidentyfikowano ją w 1981 roku. Dwa lata później opisano czynnik etiologiczny AIDS, wirus HIV . HIV jest retrowirusem i ma dwa główne serotypy , HIV-1 i HIV-2. Pandemia głównie do Afryki Zachodniej.
W 2009 roku ponad 40 milionów ludzi na całym świecie zostało zakażonych wirusem HIV i liczba ta stale rośnie. Zdecydowana większość zakażonych osób żyje w krajach rozwijających się .
Leki na HIV nie leczą zakażenia HIV, ale leczenie ma na celu poprawę jakości życia pacjentów i zmniejszenie śmiertelności .
W 2009 roku dostępnych było 25 leków antyretrowirusowych do leczenia zakażenia wirusem HIV. Leki należą do sześciu różnych klas, które działają na różne cele. Najpopularniejszym celem w dziedzinie opracowywania leków przeciwretrowirusowych jest enzym odwrotnej transkryptazy (RT) wirusa HIV-1. Istnieją dwie klasy leków ukierunkowanych na enzym HIV-1 RT, nukleozydowe / nukleotydowe inhibitory odwrotnej transkryptazy (NRTI/NtRTI) i nienukleozydowe inhibitory odwrotnej transkryptazy (NNRTI). Leki z tych klas są ważnymi składnikami terapii skojarzonej HIV zwanej wysoce aktywną terapią antyretrowirusową, lepiej znaną jako HAART.
amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła pierwszy lek do leczenia zakażenia wirusem HIV . To był NRTI zwany zydowudyną . Pod koniec lat 80. XX wieku, w trakcie dalszego rozwoju NRTI, rozpoczęto odkrywanie NNRTI. Rozwój NNRTI poprawił się szybko w latach 90. XX wieku i wkrótce stały się one trzecią klasą leków przeciwretrowirusowych, po inhibitorach proteazy .
NNRTI są swoiste dla HIV-1 i nie działają na HIV-2 i inne retrowirusy . Pierwszy NNRTI, newirapina , został odkryty przez naukowców z firmy Boehringer Ingelheim i zatwierdzony przez FDA w 1996 r. W ciągu następnych dwóch lat FDA zatwierdziła dwa inne NNRTI, delawirdynę w 1997 r. i efawirenz w 1998 r. Te trzy leki są tzw. generacji NNRTI. Zapotrzebowanie na NNRTI o lepszym profilu odporności doprowadziło do opracowania nowej generacji NNRTI. Naukowcy z Janssens Foundation i Tibotec odkryli pierwszy lek z tej klasy, etrawirynę , która została zatwierdzona przez FDA w 2008 roku. Drugi lek z tej klasy, rylpiwiryna , również został odkryty przez Tibotec i został zatwierdzony przez FDA w 2011 roku. Ponadto z tych czterech NNRTI kilka innych jest w fazie rozwoju klinicznego.
Enzym odwrotnej transkryptazy HIV-1
Funkcjonować
Odwrotna transkryptaza (RT) jest enzymem, który kontroluje replikację materiału genetycznego HIV i innych retrowirusów. Enzym ma dwie funkcje enzymatyczne. Po pierwsze, działa jak polimeraza , gdzie dokonuje transkrypcji jednoniciowego genomu RNA na jednoniciowy DNA , a następnie buduje komplementarną nić DNA. Zapewnia to podwójną helisę DNA, która może zostać zintegrowana z chromosomem komórki gospodarza . Po drugie, ma rybonukleazy H (Rnazy H), ponieważ degraduje nić RNA pośredniego RNA-DNA, który tworzy się podczas syntezy wirusowego DNA.
Struktura
HIV-1 RT jest asymetrycznym heterodimerem złożonym z 1000 aminokwasów składającym się z podjednostek p66 (560 aminokwasów) i p51 (440 aminokwasów). Podjednostka p66 ma dwie domeny, polimerazę i rybonukleazę H. Domena polimerazy zawiera cztery subdomeny , które zostały nazwane „palcami”, „dłonią”, „kciukiem” i „połączeniem” i często porównuje się ją do prawej ręki. Rolą podjednostki p66 jest wykonywanie czynności RT, natomiast zawiera ona miejsca aktywne enzymu. Uważa się, że p51 odgrywa głównie rolę strukturalną.
Wiązanie i farmakofor
Pomimo różnorodności chemicznej NNRTI wszystkie wiążą się w tym samym miejscu w RT. Wiązanie zachodzi allosterycznie w hydrofobowej kieszeni znajdującej się około 10 Å od miejsca katalitycznego w domenie dłoni miejsca podjednostki p66 enzymu. Kieszeń wiążąca NNRTI (NNIBP) zawiera pięć aromatycznych (Tyr-181, Tyr-188, Phe-227 i Trp-229), sześć hydrofobowych (Pro-59, Leu-100, Val-106, Val-179, Leu-234 i Pro-236) oraz pięć hydrofilowych (Lys-101, Lys-103, Ser-105, Asp-132 i Glu-224) aminokwasów należących do podjednostki p66 i dodatkowych dwóch aminokwasów (Ile-135 i Glu-138 ) należący do podjednostki p51. Każdy NNRTI oddziałuje z różnymi resztami aminokwasowymi w NNIBP.
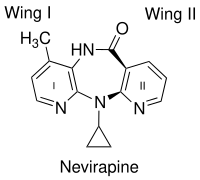
Ważnym czynnikiem w wiązaniu NNRTI pierwszej generacji, takich jak newirapina, jest kształt przypominający motyla. Pomimo swojej różnorodności chemicznej przybierają bardzo podobny kształt przypominający motyla. Dwa aromatyczne pierścienie NNRTI dopasowują się do enzymu, przypominając skrzydła motyla (ryc. 2). Struktura motyla ma hydrofilowe centrum jako „ciało” i dwa hydrofobowe ugrupowania reprezentujące skrzydła. Skrzydło I jest zwykle pierścieniem heteroaromatycznym, a skrzydło II oznacza podstawnik fenylowy lub allilowy. Skrzydło I ma grupę funkcyjną po jednej stronie pierścienia, która jest zdolna do przyjmowania i/lub oddawania wiązań wodorowych z głównym łańcuchem aminokwasów Lys-101 i Lys-103. Skrzydło II oddziałuje poprzez interakcje π-π z hydrofobową kieszenią, utworzoną w większości przez boczne łańcuchy aminokwasów aromatycznych. Na ciele motyla część hydrofobowa wypełnia małą kieszonkę, którą tworzą głównie łańcuchy boczne Lys-103, Val-106 i Val-179. Jednak stwierdzono, że wiele innych NNRTI wiąże się z RT w różnych trybach. NNRTI drugiej generacji, takie jak diarylopirymidyny (DAPY), mają kształt podkowy z dwoma bocznymi hydrofobowymi skrzydłami i pierścieniem pirymidynowym , który jest centralną częścią polarną.
NNIBP jest elastyczny , a konformacja zależy od wielkości, określonego składu chemicznego i sposobu wiązania NNRTI. Całkowita struktura RT ma segmentową elastyczność , która zależy od charakteru związanego NNRTI. Ważne jest, aby inhibitor miał elastyczność, aby mógł wiązać się w zmodyfikowanych kieszeniach zmutowanego celu. Elastyczność inhibitora może nie wpływać na interakcje inhibitor-cel.
Mechanizm akcji
NNRTI działają poprzez niekonkurencyjne wiązanie z enzymem RT (ryc. 3). Wiązanie powoduje zmianę konformacyjną w trójwymiarowej strukturze enzymu i tworzy NNIBP. Wiązanie NNRTI z HIV-1 RT sprawia, że domena kciuka p66 jest nadmiernie rozciągnięta, ponieważ indukuje rotameru w resztach aminokwasowych Tyr-181 i Tyr-188. Wpływa to na aktywność katalityczną enzymu i blokuje replikację HIV-1 poprzez hamowanie miejsca aktywnego polimerazy w podjednostce p66 RT. Globalna zmiana konformacyjna dodatkowo destabilizuje enzym na matrycy kwasu nukleinowego i zmniejsza jego zdolność do wiązania nukleotydów. Transkrypcja wirusowego RNA jest hamowana, a zatem zmniejsza się szybkość replikacji wirusa. Chociaż dokładny mechanizm molekularny jest nadal hipotetyczny, w wielu badaniach wykazano, że jest to główny mechanizm działania. [ potrzebne źródło ]
Oprócz tego proponowanego podstawowego mechanizmu działania wykazano, że NNRTI mają inne mechanizmy działania i zakłócają różne etapy reakcji odwrotnej transkryptazy. Sugerowano [ przez kogo? ] , że hamowanie odwrotnej transkrypcji przez NNRTI może wynikać z wpływu na aktywność Rnazy H RT i/lub wiązania matrycy/ startera . Niektóre NNRTI zakłócają przetwarzanie poliprotein HIV-1 Gag-Pol poprzez hamowanie późnego etapu replikacji HIV-1. [ potrzebne źródło ]
Ważne jest, aby uzyskać dogłębne zrozumienie różnych mechanizmów działania NNRTI w celu opracowania nowej generacji NNRTI i zrozumienia mechanizmu lekooporności.
Odkrywanie i projektowanie leków
Opracowanie skutecznych leków przeciw HIV jest trudne ze względu na duże różnice w sekwencjach nukleotydowych i aminokwasowych. Idealny lek przeciw HIV powinien być skuteczny przeciwko mutacji lekooporności . Zrozumienie docelowego enzymu RT i jego struktury, mechanizmu działania leku oraz konsekwencji mutacji lekooporności dostarcza przydatnych informacji, które mogą być pomocne w projektowaniu bardziej skutecznych NNRTI. Enzym RT może ulegać zmianom w wyniku mutacji, które mogą zakłócać wiązanie NNRTI.
Odkrycie
Pierwsze dwie klasy związków zidentyfikowanych jako NNRTI to 1-(2-2-hydroksyetoksymetylo)-6-(fenylotio)tymina (HEPT) i tetrahydroimidazo[4,5,1-jkj][1,4]benzodiazepin- Związki 2(1H)-on i -tion (TIBO). Odkrycie związków TIBO doprowadziło do zdefiniowania klasy NNRTI pod koniec lat 80., kiedy to nieoczekiwanie odkryto, że hamują one RT. Odkrycie to zapoczątkowało badania nad mechanizmem działania tych związków. Związki HEPT zostały opisane przed związkami TIBO i pierwotnie uważano, że są to NRTI. Później odkryto, że mają wspólny mechanizm działania ze związkami TIBO. Zarówno związki HEPT, jak i TIBO zostały po raz pierwszy zidentyfikowane jako wysoce specyficzne i silne inhibitory RT HIV-1, nieaktywne wobec innych RT. Związki te nie przerywają komórkowej ani mitochondrialnej syntezy DNA. Specyficzność NNRTI dla HIV-1 jest uważana za cechę charakterystyczną klasy leków NNRTI.
Rozwój
NNRTI pierwszej generacji
Po odkryciu HEPT i TIBO metody badań przesiewowych związków wykorzystano do opracowania BI-RG-587, pierwszego NNRTI powszechnie znanego jako newirapina. Podobnie jak HEPT i TIBO, newirapina blokowała wirusową aktywność RT poprzez hamowanie niekompetycyjne (w odniesieniu do wiązania dNTP). Potwierdziło to pogląd, że nowa klasa inhibitorów anty-HIV hamuje aktywność RT, ale nie w miejscu aktywnym. Po badaniach przesiewowych i ewolucji wielu cząsteczek pojawiło się kilka rodzin molekularnych NNRTI.
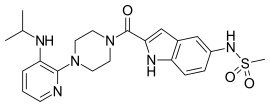
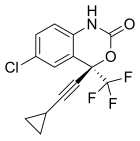
Trzy związki NNRTI pierwszej generacji zostały zatwierdzone przez FDA do leczenia zakażenia HIV-1. Newirapinę zarejestrowano w 1996 r., delawirdynę w 1997 r., a efawirenz w 1998 r. (tab. 1). Dwa z tych leków, newirapina i efawirenz, są kamieniami węgielnymi pierwszego rzutu HAART, podczas gdy delawirdyna jest obecnie rzadko stosowana. Struktura tych trzech leków wykazuje szeroki wachlarz pierścieni, podstawników i wiązań, które umożliwiają działanie przeciwko HIV-1 RT. Ta różnorodność pokazuje, dlaczego zsyntetyzowano tak wiele nienukleozydów, ale nie wyjaśnia, dlaczego tylko trzy leki trafiły na rynek. Głównym problemem była siła tych związków w rozwijaniu oporności.
|
|
|
|---|---|---|
| newirapina | Delawirdyna | efawirenz |
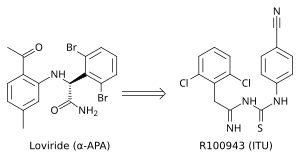
Rozwój od α-APA do ITU
struktury krystalicznej wykazała, że NNRTI pierwszej generacji (na przykład TIBO, newirapina i α-APA) wiążą RT HIV-1 w konformacji przypominającej motyla. Te NNRTI pierwszej generacji były podatne na powszechne mutacje lekooporności, takie jak Tyr-181C i Tyr-188L/H. Wywołało to potrzebę znalezienia nowych i skuteczniejszych NNRTI. ITU (imidoilotiomocznik), obiecująca seria NNRTI wyłoniła się z analogów α-APA (ryc. 4). Związki ITU otrzymano przez wydłużenie łącznika, który wiąże arylowe grupy boczne α-APA. Silny związek ITU, R100943, otrzymano przez uporządkowanie składu chemicznego grup bocznych w oparciu o zależności struktura-aktywność (SAR). Struktura krystaliczna kompleksu HIV-1/R100943 wykazała, że związki ITU są bardziej elastyczne niż związek α-APA. Związki ITU wykazywały odrębny tryb wiązania, w którym wiązały się w trybie „podkowy” lub „U”. Część 2,6-dichlorofenylowa R100943, która odpowiada chemicznie części 2,6-dibromofenylowej skrzydła II α-APA, zajmowała część skrzydła I w NNIBP, podczas gdy część 4-cyjanoanilino R100943 zajmuje pozycję skrzydła II w NNIBP.
R100943 hamował HIV-1 i był znacznie skuteczny przeciwko wielu kluczowym mutantom opornym na NNRTI, takim jak mutacja G190A, która spowodowała wysoki poziom oporności na lowiryd (α-APA) i newirapinę. Uważano, że mutacja G190A powoduje oporność, zajmując część kieszeni wiążącej, która w innym przypadku byłaby wypełniona przez część łączącą NNRTI w kształcie motyla. R100943, w układzie podkowy, znajduje się w odległości około 6,0 Å od G190. pochodne ITU wykazały lepszą aktywność przeciwko mutantom Tyr-181C i Tyr-188L. Badanie strukturalne sugerowało, że silny związek TIBO może częściowo uzupełniać skutki mutacji Tyr-181C, poruszając się w kieszeni wiążącej inhibitor nienukleozydowy (NNIBP) zmutowanego RT. W tym kontekście R100943 ma swobodę skręcania, która umożliwia zmiany konformacyjne NNRTI. Ta swoboda skręcania może być wykorzystana przez pochodną ITU do wiązania się ze zmutowanym NNIBP, a tym samym do kompensacji skutków mutacji oporności. Niemniej jednak siła R100943 przeciwko mutantom opornym na HIV-1 nie była wystarczająca, aby można go było uznać za skutecznego kandydata na lek . Dodatkowo stabilność chemiczna imidoilotiomocznika pochodnej ITU nie była korzystna dla leku doustnego.
Rozwój od ITU do DATA
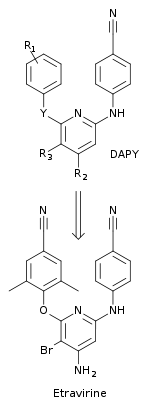
Zmiany w kompleksach imidoilotiomocznika doprowadziły do syntezy nowej klasy związków, diarylotriazyny (DATA). W tych związkach tiomocznikowa część związków ITU została zastąpiona pierścieniem triazynowym. Związki DATA były silniejsze niż związki ITU przeciwko powszechnym zmutowanym szczepom opornym na NNRTI. R106168, prototyp związku DATA, był dość łatwy do syntezy. Dokonano wielokrotnych podstawień w różnych pozycjach na wszystkich trzech pierścieniach i na łącznikach łączących pierścienie. W kieszeni większość pochodnych DATA była zgodna z konformacją podkowy. Dwa skrzydełka w R106168 (2,6-dichlorobenzyl i 4-cyjanoanilino) zajmowały pozycje w kieszeni podobne do dwóch skrzydełek pochodnych ITU. Centralna część związków DATA, w których pierścień triazynowy zastąpił grupę tiomocznikową pochodnych ITU, znajduje się pomiędzy łańcuchami bocznymi L100 i V179. To usunęło szereg skrętnych stopni swobody w części środkowej, zachowując jednocześnie elastyczność między pierścieniem triazynowym a skrzydłami.
Zastąpienie lub modyfikacja chemiczna w szkielecie z trzema pierścieniami aromatycznymi związków DATA miała istotny wpływ na aktywność. R120393, analog DATA, został zaprojektowany z częścią chloroindolową w skrzydle I, aby rozszerzyć interakcje z łańcuchem bocznym konserwowanego W229 pętli uchwytu startera polimerazy. R120393 miał podobny wpływ jak R106168 na większość mutantów opornych na NNRTI. Część chloroindolowa wchodziła w interakcję z hydrofobowym rdzeniem kieszeni i wpływała na tryb wiązania R120393, więc wchodziła głębiej w kieszeń w porównaniu z pozycją skrzydła I innych analogów DATA. Struktury krystaliczne wykazały, że związki DATA mogą wiązać NNIBP w różnych konformacjach. Zdolność do wiązania w wielu trybach sprawiła, że NNRTI są silniejsze przeciwko mutacjom lekooporności. Zmienność między inhibitorami można było zaobserwować, gdy zmieniono skład chemiczny, rozmiar skrzydła I i dwie grupy łącznikowe łączące pierścienie. Siła działania NNRTI zmieniła się, gdy triazyny zastąpiono atomami węgla.
NNRTI nowej generacji
Badacze zastosowali multidyscyplinarne podejście do zaprojektowania NNRTI o lepszym profilu oporności i zwiększonej barierze genetycznej dla rozwoju oporności. Nowa klasa związków, diarylopirymid (DAPY), została odkryta dzięki zastąpieniu centralnego pierścienia triazynowego ze związków DATA pirymidyną . Ta nowa klasa była skuteczniejsza przeciwko lekoopornym szczepom HIV-1 niż odpowiadające im analogi DATA. Zastąpienie umożliwiło podstawienia grupy CH w pozycji 5 centralnego pierścienia aromatycznego. , że jeden z pierwszych związków DAPY, dapiwiryna (z R1 = 2,4,6-trimetyloanilino, R2 = R3 = H i Y = NH) jest skuteczny przeciwko lekoopornym szczepom HIV-1. Dokonywano systematycznych podstawień chemicznych w pozycjach R1 , R2 , R3 i Y w celu znalezienia nowych pochodnych DAPY. Doprowadziło to do odkrycia etrawiryny, która ma podstawienie atomem bromu w pozycji 5 (R 3 ) pierścienia pirymidynowego (gdzie R 1 = 2,6-dimetylo-4-cyjanoanilino, R 2 = NH 2 i Y = O) (rysunek 5). Etrawiryna została odkryta przez naukowców z Jansen Research Foundation i Tibotec i zatwierdzona w 2008 roku przez FDA. Stosuje się go u dorosłych pacjentów zakażonych wirusem HIV, u których wystąpiła oporność wielolekowa, w połączeniu z innymi lekami przeciwretrowirusowymi.
Opór
Podczas leczenia infekcji, czy to bakteryjnych, czy wirusowych, zawsze istnieje ryzyko, że czynnik zakaźny rozwinie lekooporność. Leczenie zakażenia HIV jest szczególnie podatne na lekooporność, co stanowi poważny problem kliniczny w chemioterapeutycznym leczeniu zakażenia. Lekooporne szczepy HIV pojawiają się, jeśli wirus jest w stanie replikować się w obecności leków przeciwretrowirusowych.
Szczepy HIV oporne na NNRTI mają mutacje występujące głównie w NNIBP i wokół niego, wpływające bezpośrednio na wiązanie NNRTI poprzez zmianę rozmiaru, kształtu i biegunowości w różnych obszarach kieszonki lub poprzez pośredni wpływ na dostęp do kieszonki. Mutacje te obserwuje się przede wszystkim w domenach obejmujących aminokwasy 98-108, 178-190 lub 225-238 podjednostki p66. Najczęstszymi mutacjami obserwowanymi w wirusach wyizolowanych od pacjentów, którzy otrzymywali nieskuteczną chemioterapię zawierającą NNRTI, są Lys-103N i Tyr-181C. Oporność na NNRTI została powiązana z ponad 40 podstawieniami aminokwasów in vitro i in vivo .
Leki antyretrowirusowe nigdy nie są stosowane w monoterapii ze względu na szybki rozwój oporności. Wysoce aktywna terapia antyretrowirusowa (HAART) została wprowadzona w 1996 roku. Schemat leczenia obejmuje trzy leki z co najmniej dwóch różnych klas leków przeciwretrowirusowych.
Przewaga etrawiryny nad innymi NNRTI polega na tym, że do rozwoju oporności na leki wymagane są liczne mutacje. Lek wykazał również aktywność przeciwko wirusom z powszechnymi mutacjami związanymi z opornością na NNRTI i mutacjami oporności krzyżowej .
Aktualny stan
Pięć leków z klasy NNRTI zostało zatwierdzonych przez organy regulacyjne. Są to leki z grupy NNRTI pierwszej generacji: newirapina, delawirdyna i efawirenz oraz leki z grupy NNRTI nowej generacji, etrawiryna i rylpiwiryna . Kilka innych NNRTI przeszło badania kliniczne, ale przerwano je z powodu niekorzystnych farmakokinetycznych , skuteczności i/lub bezpieczeństwa. Obecnie trwają badania kliniczne czterech innych NNRTI, IDX899, RDEA-428 i lersiwiryna (tabela 2).
Rylpiwiryna
Rylpiwiryna jest związkiem DAPY, podobnie jak etrawiryna, i została odkryta podczas dalszej optymalizacji w obrębie tej rodziny NNRTI. Profil oporności i genetyczna bariera rozwoju oporności są porównywalne do etrawiryny in vitro . Przewagą rylpiwiryny nad etrawiryną jest lepsza biodostępność i łatwiejsza formulacja niż etrawiryna. Ze względu na słabą rozpuszczalność i biodostępność etrawiryna wymagała szeroko zakrojonych prac nad preparatami chemicznymi . Rylpiwiryna została zatwierdzona przez FDA do leczenia HIV w maju 2011 roku pod marką Edurant. Edurant jest dopuszczony do stosowania u wcześniej nieleczonych pacjentów, u których miano wirusa wynosi 100 000 kopii/ml lub mniej na początku terapii. Zalecana dawka to 25 mg doustnie raz dziennie z posiłkiem, w połączeniu z innymi lekami przeciwretrowirusowymi. Jest przeciwwskazany do stosowania z inhibitorami pompy protonowej ze względu na zwiększone pH w żołądku, powodujące zmniejszenie stężenia rylpiwiryny w osoczu, co może prowadzić do utraty odpowiedzi wirusologicznej i możliwej oporności. Lek o ustalonej dawce łączący rylpiwirynę z emtrycytabiną i dizoproksylem tenofowiru (TDF) został zatwierdzony przez Amerykańską Agencję ds. Żywności i Leków w sierpniu 2011 r. Pod nazwą handlową Complera. Nowszy lek o ustalonej dawce, również łączący rylpiwirynę z emtrycytabiną i alafenamidem tenofowiru (TAF), został zatwierdzony w marcu 2016 r. Pod marką Odefsey. [ potrzebne źródło ]
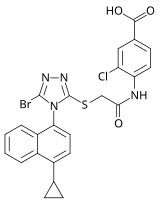
RDEA806
W 2007 roku naukowcy z firmy farmaceutycznej Ardea Biosciences zaprezentowali nową rodzinę triazolowych NNRTI. Wybranym kandydatem z przeprowadzonych badań przesiewowych był RDEA806 należący do rodziny triazoli . Ma podobny profil oporności na wybrane szczepy HIV-1 oporne na NNRTI jak inne NNRTI nowej generacji. Kandydat przystąpił do badań klinicznych fazy IIb pod koniec 2009 r., ale dalsze badania nie zostały rozpoczęte. Ardea została sprzedana firmie AstraZeneca w 2012 roku.
Fosdewiryna (IDX899)
Fosdewiryna (znana również jako IDX899 i GSK-2248761) to kolejny NNRTI nowej generacji opracowany przez Idenix Pharmaceuticals i ViiV Healthcare. Należy do rodziny 3-fosfoindoli. in vitro wykazały porównywalny profil oporności z innymi lekami z grupy NNRTI nowej generacji. W listopadzie 2009 r. kandydat przystąpił do badań klinicznych II fazy, ale badanie i cały dalszy rozwój zostały wstrzymane, gdy u 5 z 35 pacjentów otrzymujących fosdewirynę wystąpiły napady padaczkowe o opóźnionym początku.
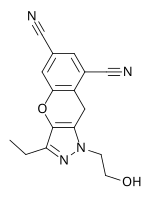
Lersiwiryna (UK-453061)
Lersiwiryna należy do rodziny pirazoli i jest kolejną generacją NNRTI w badaniach klinicznych opracowanych przez firmę farmaceutyczną ViiV Healthcare . Profil oporności jest podobny do profilu innych NNRTI nowej generacji. Pod koniec 2009 r. lersiwiryna znajdowała się w fazie IIb. W lutym 2013 r. firma ViiV Healthcare ogłosiła wstrzymanie programu rozwojowego badającego lersiwirynę.
| Kandydat na lek | RDEA806 | Fosdewiryna (IDX899) | Lersiwiryna (UK-453061) |
|---|---|---|---|
| Struktura chemiczna |
|

|
|
| Faza rozwoju | IIb | II | IIb |