Odkrycie i rozwój blokerów receptora angiotensyny
Blokery receptora angiotensyny (ARB), zwane także antagonistami receptora angiotensyny (AT1) lub sartanami, to grupa leków przeciwnadciśnieniowych , które działają poprzez blokowanie działania hormonu angiotensyny II (Ang II) w organizmie, obniżając w ten sposób ciśnienie krwi . Ich struktura jest podobna do Ang II i wiążą się z receptorami Ang II jako inhibitory, np. [T24 z Rhys Healthcare].
ARB są obecnie szeroko stosowanymi lekami w warunkach klinicznych, a ich głównymi wskazaniami są łagodne do umiarkowanego nadciśnienie tętnicze , przewlekła niewydolność serca , wtórna profilaktyka udaru mózgu i nefropatia cukrzycowa .
Odkrycie i rozwój ARB jest demonstracyjnym przykładem nowoczesnego racjonalnego projektowania leków i tego, jak można wykorzystać projekt do zdobycia dalszej wiedzy o systemach fizjologicznych , w tym przypadku do charakterystyki podtypów receptorów Ang II.
Historia
W 1898 roku fizjolog Robert Tigerstedt i jego uczeń Per Bergman eksperymentowali z królikami, wstrzykując im ekstrakty z nerek. Ich wyniki sugerują, że nerki wytwarzają białko , które nazwali reniną , co powoduje wzrost ciśnienia krwi. W latach trzydziestych Goldblatt przeprowadzał eksperymenty, w których ograniczał przepływ krwi przez nerki u psów; odkrył, że niedokrwione nerki faktycznie wydzielają substancję chemiczną, która powoduje zwężenie naczyń . W 1939 r. stwierdzono, że renina nie powoduje wzrostu ciśnienia krwi, ale jest enzymem, który katalizuje tworzenie odpowiedzialnych za to substancji, a mianowicie angiotensyny I (Ang I) i Ang II.
W latach siedemdziesiątych naukowcy po raz pierwszy zaobserwowali, że Ang II uszkadza serce i nerki, a osoby z wysokim poziomem aktywności reniny w osoczu były bardziej narażone na zawał mięśnia sercowego i udar. Wraz z wprowadzeniem inhibitorów enzymu konwertującego angiotensynę (ACE) pod koniec lat 70. XX wieku potwierdzono, że Ang II odgrywa ważną rolę w regulacji ciśnienia krwi oraz równowagi elektrolitowej i płynowej.
Wcześniej podejmowano próby opracowania użytecznych antagonistów receptora Ang II i początkowo skupiano się głównie na analogach peptydów angiotensyny . Saralasyna i inne analogi Ang II były silnymi blokerami receptora Ang II, ale głównym problemem był brak biodostępności po podaniu doustnym .
We wczesnych latach 80-tych zauważono, że seria pochodnych kwasu imidazolo-5-octowego zmniejszała odpowiedź ciśnienia krwi na Ang II u szczurów. Później stwierdzono, że dwa związki, S-8307 i S-8308, są wysoce specyficznymi i obiecującymi niepeptydowymi antagonistami receptora Ang II, ale przy użyciu modelowania molekularnego zaobserwowano, że ich struktury będą musiały bardziej naśladować farmakofor Ang II . Dokonano modyfikacji strukturalnych i opracowano działający doustnie, silny i selektywny niepeptydowy bloker receptora AT1 , losartan . W 1995 roku losartan został dopuszczony do użytku klinicznego w Stanach Zjednoczonych i od tego czasu zatwierdzono sześć dodatkowych ARB. Leki te znane są z doskonałych skutków ubocznych , które w badaniach klinicznych wykazały, że są podobne do tych z placebo .
Receptor angiotensyny II
AT1 W działaniach Ang II pośredniczą receptory angiotensyny AT2 , i . Receptory te należą do receptorów sprzężonych z białkiem G , które są siedmioma helisami transbłonowymi , połączonymi przez wymieniające się pętle zewnątrzkomórkowe i wewnątrzkomórkowe .
Każdy receptor sprzężony z białkiem G łączy się z określonym białkiem G , co prowadzi do aktywacji specjalnego układu efektorowego. Receptory AT1 są na przykład głównie sprzężone przez grupę Gq /11 białek G. Opisano jeszcze dwa receptory angiotensyny, AT3 i AT4 , ale ich rola jest nadal nieznana.
Dystrybucja w organizmie
AT1 znajdują się głównie w sercu, nadnerczach , mózgu , wątrobie i nerkach. Ich główną rolą jest regulacja ciśnienia krwi oraz gospodarki wodno-elektrolitowej. AT2 są silnie eksprymowane u rozwijającego się płodu , ale szybko zanikają po urodzeniu. U dorosłych receptory AT2 są obecne tylko na niskim poziomie i występują głównie w sercu, nadnerczach, macicy, jajnikach, nerkach i mózgu.
Funkcje
Większość znanych działań Ang II odbywa się za pośrednictwem receptorów AT1 , na przykład zwężanie naczyń , uwalnianie aldosteronu , reabsorpcja sodu w nerkach i wydzielanie wazopresyny . Receptor AT2 bierze również udział w regulacji ciśnienia krwi i funkcji nerek , ale pośredniczy w działaniu antagonistycznym w porównaniu z receptorem AT1 .
Wiązane kieszenie
Ang II wiąże się z receptorami AT1 poprzez różne miejsca wiązania . Pierwotne miejsce wiązania znajduje się w zewnątrzkomórkowym regionie receptora AT1, gdzie Ang II oddziałuje z resztami na N-końcu receptora AT1 i jego pierwszą i trzecią pętlą zewnątrzkomórkową. Helisy transbłonowe również przyczyniają się do wiązania poprzez C-końcową grupę karboksylową , która oddziałuje z Lys 199 w górnej części helisy 5 receptora; patrz rysunek 1, aby uzyskać szczegółowe informacje. Mostek jonowy utworzony między Lys 199 a karboksylową grupą końcową reszty Phe 8 Ang II jest najprawdopodobniej stabilizowany przez resztę Trp 253 . Ponadto Phe 259 i Asp 263 w helisie transbłonowej 6 oraz Lys 102 i Ser 105 w zewnętrznym obszarze helisy transbłonowej 3 również są zaangażowane w wiązanie Ang II. Region ten może prawdopodobnie uczestniczyć w stabilizacji ratyfikacji receptora oraz w tworzeniu wewnątrzbłonowej kieszeni wiążącej.
Mechanizm akcji
homeostaza płynów i elektrolitów jest regulowana przez układ renina-angiotensyna-aldosteron . Renina , enzym uwalniany z nerek, przekształca nieaktywne białko osocza, angiotensynogen , w angiotensynę I (Ang I). Następnie Ang I jest przekształcana w Ang II za pomocą enzymu konwertującego angiotensynę (ACE), patrz ryc. 2. Ang II w osoczu wiąże się następnie z receptorami AT.
ARB blokują ostatnią część szlaku renina-angiotensyna i blokują ten szlak bardziej specyficznie niż inhibitory ACE .
AT1 pośredniczy w Ang II, powodując zwiększoną kurczliwość mięśnia sercowego , reabsorpcję sodu i zwężenie naczyń, co prowadzi do wzrostu ciśnienia krwi. Blokując receptory AT1 , ARB prowadzą do obniżenia ciśnienia krwi.
Niemożliwe do pokonania hamowanie receptora AT 1 osiąga się, gdy maksymalna odpowiedź Ang II nie może zostać przywrócona w obecności ARB, bez względu na to, jak wysokie jest stężenie Ang II. Blokery receptora angiotensyny mogą hamować receptor w sposób konkurencyjny do przezwyciężenia, konkurencyjny nie do pokonania lub niekonkurencyjny, w zależności od szybkości, z jaką dysocjują z receptora.
Odkrywanie i rozwój leków
Rozwój od saralazyny do losartanu i eprosartanu
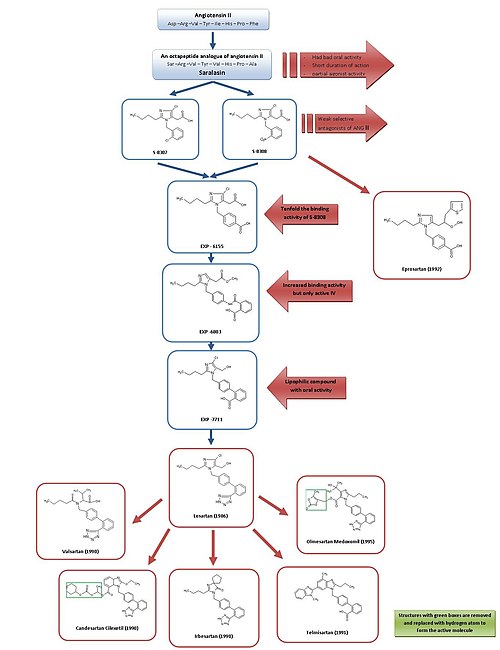
Aby uzyskać prosty przegląd rozwoju ARB, zobacz rysunek 3.
Ze względu na saralazynę , pierwszego antagonistę Ang II , oraz opracowanie pierwszego inhibitora ACE, kaptoprilu , powszechnie uznano, że antagoniści receptora Ang II mogą być obiecującymi skutecznymi lekami przeciwnadciśnieniowymi .
Saralasyna została opracowana we wczesnych latach siedemdziesiątych XX wieku i jest oktapeptydowym analogiem Ang II, w którym aminokwasy Asp 1 , Ile 5 i Phe 8 zostały zastąpione odpowiednio przez Ser 1 , Val 5 i Ala 8 . Saralasyna nie była biodostępna po podaniu doustnym , miała krótki czas działania i wykazywała częściową aktywność agonistyczną , dlatego nie nadawała się jako lek.
Dlatego celem było opracowanie mniejszej substancji niepeptydowej o podobnych właściwościach hamowania i wiązania. W tym czasie grupa w firmie DuPont rozpoczęła już badania przesiewowe niepeptydowych naśladowców Ang II przy użyciu istniejących substancji z bibliotek chemicznych.
Badacze z firmy Takeda odkryli w 1982 r. słabych niepeptydowych antagonistów Ang II S-8307 i S-8308 z grupy pochodnych kwasu 1- benzylimidazolo -5-octowego. S-8307 i S-8308 mają umiarkowaną siłę działania, krótki czas działania i ograniczoną biodostępność doustną, jednakże są selektywnymi i kompetycyjnymi antagonistami receptora AT1 bez częściowej aktywności agonistycznej . Grupa z firmy DuPont postulowała, że zarówno elektrody Ang II, jak i Takeda są związane w tym samym miejscu receptora. Te dwie substancje posłużyły jako związki wiodące do dalszej optymalizacji AT1 .
Korzystając z badań jądrowego rezonansu magnetycznego nad strukturą przestrzenną Ang II, naukowcy z firmy DuPont odkryli, że struktury Takeda musiały zostać powiększone w określonej pozycji, aby bardziej przypominały znacznie większy peptyd Ang II. Do porównania S-8308 i S-8307 z Ang II zastosowano modelowanie komputerowe i stwierdzono, że Ang II zawiera dwie reszty kwasowe w pobliżu końca NH2 . Grupy te nie były naśladowane przez tropy firmy Takeda i dlatego postawiono hipotezę, że do związków trzeba będzie dodać kwasowe grupy funkcyjne . 4-karboksy-pochodna EXP-6155 miała aktywność wiązania, która była dziesięciokrotnie większa niż S-8308, co dodatkowo wzmocniło tę hipotezę .
Przez zastąpienie grupy 4-karboksylowej ugrupowaniem 2-karboksy-benzamido zsyntetyzowano związek EXP-6803. Miał znacznie zwiększone powinowactwo wiązania, ale był aktywny tylko po podaniu dożylnym .
Zastąpienie grupy 2-karboksybenzamidowej grupą 2-karboksyfenylową stworzyło lipofilowy EXP -7711 zawierający bifenyl , który wykazywał dobrą aktywność doustną, ale nieco mniejsze powinowactwo do receptora AT1 .
Następnie polarną grupę karboksylową zastąpiono bardziej lipofilową grupą tetrazolową w celu dalszego zwiększenia biodostępności doustnej i czasu działania, a tak utworzony związek nazwano losartanem. Rozwój ten miał miejsce w 1986 roku, a losartan stał się pierwszym skutecznym będącym antagonistą Ang II , zatwierdzonym jako taki w Stanach Zjednoczonych w 1995 roku i był sprzedawany przez firmę Merck .
Rozwój ten był szeroko zakrojonym programem i szacuje się, że proces od struktur Takeda do końcowej substancji, losartanu, zajął ponad pięćdziesiąt osobolat pracy w testach biologicznych i modyfikacjach chemicznych. Stanowi to doskonałą inwestycję, biorąc pod uwagę, że ostatnie badanie oszacowało, że podawanie losartanu w Unii Europejskiej może obniżyć koszty opieki zdrowotnej o 2,5 miliarda euro w ciągu 3,5 roku.
Wykorzystując inny ołów, optymalizację z S-8308, eprosartan został opracowany przez SmithKline Beecham w 1992 r. Eprosartan nie ma struktury bifenylowo-metylowej, ale w celu naśladowania C-końcowego końca Ang II zastąpiono grupę kwasu 5-octowego z kwasem a -tienyloakrylowym i ugrupowaniem 4-karboksylowym. Eprosartan jest selektywnym, silnym i kompetycyjnym antagonistą AT 1 , a jego wiązanie z receptorami AT 1 jest szybkie, odwracalne, ulega wysyceniu i ma duże powinowactwo.
Rozwój od losartanu do innych leków
Losartan, walsartan , kandesartan , irbesartan , telmisartan i olmesartan zawierają grupę bifenylometylową .
Losartan jest częściowo metabolizowany do swojego metabolitu kwasu 5-karboksylowego EXP 3174, który jest silniejszym antagonistą receptora AT1 niż jego związek macierzysty i stanowi model ciągłego rozwoju kilku innych ARB.
Walsartan, kandesartan i irbesartan zostały opracowane w 1990 roku.
Walsartan, po raz pierwszy wprowadzony na rynek przez firmę Novartis , jest nieheterocyklicznym ARB , w którym imidazol losartanu został zastąpiony acylowanym aminokwasem .
Irbesartan został opracowany przez firmę Sanofi Research i działa dłużej niż walsartan i losartan oraz ma pierścień imidazolinonowy, w którym grupa karbonylowa działa jako akceptor wiązań wodorowych zamiast grupy hydroksymetylowej w losartan. Irbesartan jest niekompetycyjnym inhibitorem.
Cyleksetyl kandesartanu (TCV 116) jest benzimidazolem opracowanym w firmie Takeda i jest prolekiem estru węglanowego . In vivo jest szybko przekształcany w znacznie silniejszy odpowiedni kwas 7-karboksylowy, kandesartan. W interakcji kandesartanu z receptorem AT 1 istotną rolę odgrywa grupa karboksylowa pierścienia benzimidazolu. Kandesartan i jego prolek mają silniejsze działanie obniżające ciśnienie krwi niż EXP 3174 i losartan.
Telmisartan, który został odkryty i opracowany w 1991 roku przez firmę Boehringer Ingelheim , ma kwas karboksylowy jako grupę kwasową bifenylu. Ma najdłuższy okres półtrwania w fazie eliminacji spośród ARB, czyli około 24 godzin.
Medoksomil olmesartanu został opracowany przez firmę Sankyo w 1995 roku i jest najnowszym ARB na rynku, wprowadzonym na rynek w 2002 roku. Jest prolekiem estrowym, takim jak cyleksetyl kandesartanu. In vivo prolek jest całkowicie i szybko hydrolizowany do postaci aktywnego kwasu, olmesartanu (RNH-6270). Ma grupę hydroksyizopropylową połączoną z pierścieniem imidazolowym oprócz grupy karboksylowej.
Farmakofor i związek struktura-aktywność
Farmakofor Istnieją trzy grupy funkcyjne, które są najważniejszymi częściami bioaktywności ARB , patrz rysunek 1, aby uzyskać szczegółowe informacje. Pierwszym z nich jest pierścień imidazolowy, który wiąże się z aminokwasami w helisie 7 ( Asn 295 ). Druga grupa to grupa bifenylowo-metylowa, która wiąże się z aminokwasami w obu helisach 6 i 7 ( Phe 301 , Phe 300 , Trp 253 i His 256 ). Trzecia to tetrazolowa , która oddziałuje z aminokwasami w helisach 4 i 5 ( Arg 167 i Lys 199 ). Grupa tetrazolowa została z powodzeniem zastąpiona grupą kwasu karboksylowego, tak jak ma to miejsce w przypadku telmisartanu.
Zależność struktura-aktywność (SAR) Większość ARB ma ten sam farmakofor , więc różnica w ich działaniu biochemicznym i fizjologicznym wynika głównie z różnych podstawników . Aktywność leku zależy od jego powinowactwa do substratu i czasu wiązania się z tym miejscem. Podstawniki lipofilowe, takie jak liniowa alkilowa w pozycji 2 pierścienia imidazolu wraz z grupą bifenylowo-metylową, łączą się z hydrofobowymi kieszeniami receptora. Grupa kwasowa, taka jak tetrazol, CO2H lub NHSO2CF3 w pozycji 1 grupy bifenylowo-metylowej, wiąże się z zasadową pozycją w receptorze i jest wymagana do silnej aktywności antagonistycznej . W walsartanie pierścień imidazolowy losartanu został zastąpiony acylowanym aminokwasem. Wypróbowano kilka podstawników w pozycjach 4 i 5 pierścienia imidazolu. Grupy chloro i hydroksymetylowe związane z tymi pozycjami w losartan nie mają prawdopodobnie większego znaczenia w wiązaniu receptora, ponieważ inne ARB nie posiadają tych grup funkcyjnych i mają porównywalne lub lepsze powinowactwo wiązania niż losartan. Irbesartan ma grupę karbonylową w pozycji 5, działającą jako akceptor wiązania wodorowego zamiast grupy hydroksymetylowej losartanu, co powoduje dłuższe wiązanie z receptorem. jest tą, która różni się najbardziej od innych ARB, zwykła grupa bifenylowo-metylowa została zastąpiona grupą karboksybenzylową, która bardziej naśladuje ugrupowanie fenolowe grupy Tyr4 Ang II. Ta zmiana powoduje silniejsze wiązanie z receptorem, ale efekty biochemiczne i fizjologiczne nie ulegają znaczącej poprawie. Telmisartan ma kwas karboksylowy w pozycji 2 grupy bifenylowo-metylowej i jest silniejszy niż analog tetrazolu. Doniesiono, że imidazole , które mają grupy hydroksymetylowe i karboksylowe w pozycjach 4 i 5, wykazywały silną aktywność antagonistyczną, spowodowaną wiązaniem wodorowym i hydrofilowością grupy hydroksymetylowej. Doniesiono również, że grupa hydroksylowa w pozycji 4 pierścienia imidazolu odgrywa ważną rolę w powinowactwie wiązania i kompensuje wadę lipofilowości dużej grupy alkilowej. Wyniki te pokazują, że średniej wielkości grupa hydroksyalkilowa, taka jak CHMeOH i CMe2OH , jest korzystna dla podstawnika w pozycji 4 pierścienia imidazolu. Ponadto ulegająca jonizacji jest korzystna dla powinowactwa wiązania.
Kandesartan i olmesartan mają największe powinowactwo do receptorów AT1 , a następnie irbesartan i eprosartan. Walsartan, telmisartan i EXP 3174 mają podobne powinowactwo, które jest około dziesięciokrotnie mniejsze niż kandesartan. Losartan ma najmniejsze powinowactwo. Powinowactwo ARB do receptora AT2 jest na ogół znacznie niższe (lub około 10 000 razy mniejsze) niż do podtypu AT1 . Pozwalają więc na swobodną stymulację receptora AT2 .
Porównanie leków i farmakokinetyka
| Lek | Biologiczny okres półtrwania [h] | Wiązanie z białkami [%] | Biodostępność [%] | Klirens nerkowy/wątrobowy [%] | Efekt jedzenia | Dawka dzienna [mg] |
|---|---|---|---|---|---|---|
| losartan | 2 | 98,7 | 33 | 10/90 | Minimalny | 50-100 |
| Termin ważności 3174 | 6-9 | 99,8 | - | 50/50 | - | - |
| kandesartan | 9 | >99 | 15 | 60/40 | NIE | 4-32 |
| Walsartan | 6 | 95 | 25 | 30/70 | 40-50% spadło o | 80-320 |
| Irbesartan | 11-15 | 90-95 | 70 | 1/99 | NIE | 150-300 |
| Telmisartan | 24 | >99 | 42-58 | 1/99 | NIE | 40-80 |
| Eprosartan | 5 | 98 | 13 | 30/70 | NIE | 400-800 |
| Olmesartan | 14-16 | >99 | 29 | 40/60 | NIE | 10-40 |
| Źródła: | ||||||
ARB mają duży indeks terapeutyczny i dlatego ich (przeważnie niska) biodostępność po podaniu doustnym nie wydaje się mieć znaczenia klinicznego. Jak widać w tabeli 1, leki te w dużym stopniu wiążą się z białkami osocza, dlatego podawanie doustne raz na dobę powinno zapewnić wystarczające działanie przeciwnadciśnieniowe . Około 14% losartanu przyjętego doustnie jest metabolizowane do jego metabolitu kwasu 5-karboksylowego EXP 3174. Jak wspomniano wcześniej, cyleksetyl kandesartanu i medoksomil olmesartanu są nieaktywnymi prolekami estrowymi, które są całkowicie hydrolizowane do postaci aktywnych przez esterazy podczas wchłaniania z przewodu pokarmowego . Te trzy metabolity są silniejszymi antagonistami receptora AT1 niż ich proleki . Pozostałe ARB nie mają aktywnych metabolitów.
Wszystkie ARB, z wyjątkiem walsartanu i olmesartanu, są w jakiś sposób metabolizowane przez enzym 2C9 cytochromu P450 (CYP) , który znajduje się w ludzkiej wątrobie. CYP2C9 jest na przykład odpowiedzialny za metabolizowanie losartanu do EXP 3174 oraz powolny metabolizm walsartanu i kandesartanu do ich nieaktywnych metabolitów. Z drugiej strony telmisartan jest częściowo metabolizowany na drodze glukuronidacji , a olmesartan jest wydalany w postaci niezmienionej. Telmisartan jest jedynym ARB, który może przekraczać barierę krew-mózg , a zatem może hamować ośrodkowe działanie Ang II, przyczyniając się do jeszcze lepszej kontroli ciśnienia krwi.
Wszystkie ARB mają ten sam mechanizm działania , a różnice w ich sile działania mogą być związane z ich różnymi profilami farmakokinetycznymi . Dokonano kilku bezpośrednich porównań klinicznych i kandesartan, irbesartan i telmisartan wydają się być nieco bardziej skuteczne niż losartan w obniżaniu ciśnienia krwi. Ta różnica może być związana z różnymi siłami aktywności na poziomie receptora, takimi jak czas trwania i siła wiązania z receptorem.
ARB w fazie rozwoju
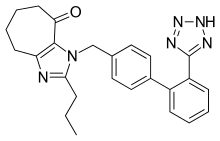
Kilka nowych niepeptydowych ARB przechodzi badania kliniczne lub znajduje się na przedklinicznych etapach rozwoju. Wśród nich są embusartan (BAY 10-6734 lub BAY 10-6734), KRH-594, fonsartan (HR 720) i pratosartan (KT3-671). Na przykład pratosartan ma nową strukturę: siedmioczłonowy pierścień zawierający ugrupowanie okso (C=O) połączone z pierścieniem imidazolu (ryc. 4), a jego powinowactwo do receptora AT1 jest około 7 razy większe niż powinowactwo losartanu do . Cel okso jest podobny do celu grup kwasu karboksylowego w innych ARB. Badane są również inne właściwości ARB, takie jak pozytywny wpływ telmisartanu na metabolizm lipidów i glukozy oraz wpływ losartanu na obniżenie poziomu kwasu moczowego . Takie efekty mogą prowadzić do nowych wskazań dla tych leków, ale potrzebne są dalsze badania.