Oktakarbonyl dikobaltu

|
|
|
|

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
Oktakarbonylodikobalt ( Co-Co )
|
|
| Inne nazwy Karbonyl kobaltu (2:8), di-mu-karbonyloheksakarbonylodikobalt, oktakarbonyl kobaltu, dimer tetrakarbonylu kobaltu, karbonyl dikobaltu, oktakarbonylodikobalt
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.030.454 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| Numer RTECS |
|
| UNII | |
| Numer ONZ | 3281 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| Co2 ( CO) 8 | |
| Masa cząsteczkowa | 341,95 g/mol |
| Wygląd | czerwono-pomarańczowe kryształy |
| Gęstość | 1,87 g/cm 3 |
| Temperatura topnienia | 51 do 52 ° C (124 do 126 ° F; 324 do 325 K) |
| Temperatura wrzenia | 52 ° C (126 ° F; 325 K) rozkłada się |
| nierozpuszczalny | |
| Ciśnienie pary | 0,7 mmHg (20°C) |
| Struktura | |
|
0 1,33 D (izomer C 2v ) D (izomer D 3d ) |
|
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
Potencjalny czynnik rakotwórczy |
| Oznakowanie GHS : | |
   
|
|
| Niebezpieczeństwo | |
| H251 , H302 , H304 , H315 , H317 , H330 , H351 , H361 , H412 | |
| P201 , P260 , P273 , P280 , P304+P340+P310 , P403+P233 | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | -23°C (-9,4°F) |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LD 50 ( mediana dawki )
|
15 mg/kg (doustnie, szczur) |
| NIOSH (limity ekspozycji na zdrowie w USA): | |
|
PEL (dopuszczalny)
|
nic |
|
REL (zalecane)
|
TWA 0,1 mg/ m3 |
|
IDLH (bezpośrednie zagrożenie)
|
ND |
| Karta charakterystyki (SDS) | Karta charakterystyki zewnętrznej |
| Związki pokrewne | |
|
Pokrewne karbonylki metali
|
Pentakarbonyl żelaza Diiron nonakarbonylu Tetrakarbonyl niklu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Oktakarbonyl dikobaltu jest związkiem kobaltu organicznego o składzie Co 2 (CO) 8 . Ten karbonylek metalu jest używany jako odczynnik i katalizator w chemii metaloorganicznej i syntezie organicznej i ma kluczowe znaczenie dla dobrze znanej chemii kobaltu organicznego . Jest macierzystym członkiem rodziny hydroformylowania . Każda cząsteczka składa się z dwóch atomów kobaltu związanych z ośmioma ligandami tlenku węgla , chociaż znanych jest wiele izomerów strukturalnych. Niektóre ligandy karbonylowe są nietrwałe .
Synteza, struktura, właściwości
Oktakarbonyl dikobaltu to pomarańczowe, piroforyczne ciało stałe. Jest syntetyzowany przez wysokociśnieniowe karbonylowanie soli kobaltu (II) :
- 2 (CH 3 COO) 2 Co + 8 CO + 2 H 2 → Co 2 (CO) 8 + 4 CH 3 COOH
Przygotowanie często prowadzi się w obecności cyjanku , przekształcając sól kobaltu(II) w kompleks heksacyjanokobaltanu(II), który reaguje z tlenkiem węgla dając K[Co(CO) 4 ] . W wyniku zakwaszenia powstaje wodorek tetrakarbonylu kobaltu , HCo(CO) 4 , który rozkłada się w pobliżu temperatury pokojowej do oktakarbonylu dikobaltu i wodoru. Można go również przygotować przez ogrzewanie metalicznego kobaltu do temperatury powyżej 250 ° C w strumieniu węgla pod ciśnieniem około 200 do 300 atm :
- 2 Co + 8 CO → Co 2 (CO) 8
Występuje jako mieszanina szybko ulegających przemianom izomerów . W roztworze znane są dwa izomery, które szybko ulegają wzajemnej przemianie:
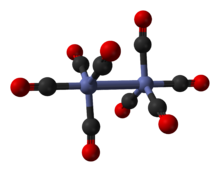
Główny izomer (po lewej w powyższym procesie równowagowym ) zawiera dwa mostkowe ligandy karbonylowe łączące centra kobaltu i sześć końcowych ligandów karbonylowych, po trzy na każdym metalu. Można to podsumować wzorem (CO) 3 Co(μ-CO) 2 Co(CO) 3 i ma symetrię C 2v . Ta struktura przypomina diiron-nonakarbonyl ( Fe 2 (CO) 9 ), ale z jednym mostkiem karbonylowym mniej. Odległość Co-Co wynosi 2,52 Å, a terminala Co-CO i mostka Co-CO wynoszą odpowiednio 1,80 i 1,90 Å. Analiza wiązania sugeruje brak bezpośredniego wiązania kobalt-kobalt.
Mniejszy izomer nie ma mostkujących ligandów karbonylowych, ale zamiast tego ma bezpośrednie wiązanie między centrami kobaltu i ośmioma końcowymi ligandami karbonylowymi, po cztery na każdym atomie metalu. Można to podsumować wzorem (CO) 4 Co-Co(CO) 4 i ma symetrię D 4d . Zawiera niemostkowane wiązanie kobalt-kobalt, które ma długość 2,70 Å w strukturze stałej, gdy krystalizuje razem z C 60 .
Reakcje
Zmniejszenie
Oktakarbonyl dikobaltu jest rozszczepiany redukcyjnie przez metale alkaliczne i pokrewne odczynniki. Otrzymane sole metali alkalicznych protonują, dając wodorek tetrakarbonylokobaltu :
- Co 2 (CO) 8 + 2 Na → 2 Na[Co(CO) 4 ]
- Na[Co(CO) 4 ] + H + → H[Co(CO) 4 ] + Na +
Reakcje z elektrofilami
Halogeny i pokrewne odczynniki rozszczepiają wiązanie Co – Co, dając pięciokoordynacyjne halotetrakarbonyle:
- Co 2 (CO) 8 + Br 2 → 2 Br [Co(CO) 4 ]
Trikarbonylonitrozyl kobaltu jest wytwarzany przez traktowanie oktakarbonylu dikobaltu tlenkiem azotu:
- Co 2 (CO) 8 + 2 NO → 2 Co (CO) 3 NO + 2 CO
Reakcje z alkinami
Reakcja Nicholasa jest reakcją podstawienia , w której grupa alkoksylowa znajdująca się na węglu α alkinu jest zastępowana innym nukleofilem . Alkin reaguje najpierw z oktakarbonylem dikobaltu, z którego powstaje stabilizowany kation propargilowy , który reaguje z nadchodzącym nukleofilem, a następnie produkt tworzy się w wyniku oksydacyjnej demetalacji.
Pausona -Khanda , w której alkin , alken i tlenek węgla cyklizują dając cyklopentenon , może być katalizowana przez Co 2 (CO) 8 , chociaż od tego czasu opracowano nowsze metody, które są bardziej wydajne:
Co 2 (CO) 8 reaguje z alkinami , tworząc stabilny kompleks kowalencyjny, który jest przydatny jako grupa ochronna dla alkinu. Sam ten kompleks można również zastosować w reakcji Pausona-Khanda.
Możliwe są wewnątrzcząsteczkowe reakcje Pausona-Khanda, w których materiał wyjściowy zawiera zarówno ugrupowania alkenowe, jak i alkinowe. W asymetrycznej syntezie alkaloidu Lycopodium huperzine -Q Takayama i współpracownicy zastosowali wewnątrzcząsteczkową reakcję Pausona-Khanda do cyklizacji enynu zawierającego pierwszorzędowy alkohol chroniony tert -butylodifenylosililem (TBDPS) . Przygotowanie ugrupowania cyklicznego siloksanu bezpośrednio przed wprowadzeniem oktakarbonylu dikobaltu zapewnia utworzenie produktu o pożądanej konformacji .

Cykl katalityczny hydroformylowania końcowego alkenu ( RCH=CH 2 ) do aldehydu ( RCH 2 CH Etap CHO 2 ): 1 : Dysocjacja tlenku węgla z wodorku tetrakarbonylu kobaltu z wytworzeniem HCo(CO) 3 , aktywnego ugrupowania katalitycznego Etap 2 : Centrum kobaltu tworzy wiązanie π z alkenem Krok 3 : Ligand alkenowy wstawia się w wiązanie kobalt-wodorek Krok 4 : Koordynacja dodatkowego ligandu karbonylowego Krok 5 : Migracyjna insercja ligandu karbonylowego do wiązania kobalt-alkil, przekształcanie alkilotetrakarbonylowy związek pośredni w acylotrikarbonyl. Etap 6 : Utleniająca addycja diwodoru prowadzi do kompleksu diwodorowego. Etap 7 : Produkt aldehydowy uwalniany w procesie eliminacji redukcyjnej , regenerujący aktywne związki katalityczne. Etap 8 : Nieproduktywna i odwracalna reakcja uboczna .
Hydroformylowanie
W wyniku uwodornienia Co 2 (CO) 8 powstaje tetrakarbonylowodorek kobaltu H[Co(CO) 4 ] :
- Co 2 (CO) 8 + H 2 → 2 H [Co (CO) 4 ]
Wodorek ten jest katalizatorem hydroformylowania – konwersji alkenów do aldehydów . Cykl katalityczny tego hydroformylowania przedstawiono na schemacie.
Zmniejszenie
Redukcja Co 2 (CO) 8 amalgamatem sodu daje sprzężoną zasadę H[Co(CO) 4 ] . Ta sól daje wodorek po zakwaszeniu, zapewniając alternatywną ścieżkę syntezy tego gatunku. Sole tej postaci są również produktami pośrednimi w szlaku syntezy cyjanku oktakarbonylu dikobaltu.
- Co 2 (CO) 8 + 2 Na → 2 Na[Co(CO) 4 ]
- Na[Co(CO) 4 ] + H + → H[Co(CO) 4 ] + Na +
Reakcje podstawienia
Ligandy CO można zastąpić ligandami trzeciorzędowej fosfiny , otrzymując Co 2 (CO) − 8 x (PR 3 ) x . Te objętościowe pochodne są bardziej selektywnymi katalizatorami reakcji hydroformylowania. „ Twarde ” zasady Lewisa, np. pirydyna , powodują dysproporcjonowanie :
- 12 C 5 H 5 N + 3 Co 2 (CO) 8 → 2 [Co (C 5 H 5 N) 6 ][Co (CO) 4 ] 2 + 8 CO

Konwersja do wyższych karbonylków
Ogrzewanie powoduje dekarbonylację i tworzenie dodekakarbonylu tetrakobaltu :
- 2 Co 2 (CO) 8 → Co 4 (CO) 12 + 4 CO
Podobnie jak wiele karbonylków metali, oktakarbonyl dikobaltu wyodrębnia halogenki z halogenków alkilu. W reakcji z bromoformem przekształca się w metylodynotrikobaltnonakarbonyl , HCCo 3 (CO) 9 , w reakcji, którą można wyidealizować jako:
- 9 Co 2 (CO) 8 + 4 CHBr 3 → 4 HCCo 3 (CO) 9 + 36 CO + 6 CoBr 2
Bezpieczeństwo
Co 2 (CO) 8 , lotne źródło kobaltu(0), jest samozapalne i podczas rozkładu uwalnia tlenek węgla . Narodowy Instytut Bezpieczeństwa i Higieny Pracy zalecił , aby pracownicy nie byli narażeni na stężenia większe niż 0,1 mg/m 3 w ciągu ośmiogodzinnej średniej ważonej w czasie, bez odpowiedniego sprzętu do ochrony dróg oddechowych .
- ^ a b c d e Kieszonkowy przewodnik NIOSH dotyczący zagrożeń chemicznych. "#0147" . Narodowy Instytut Bezpieczeństwa i Higieny Pracy (NIOSH).
- ^ a b Pauson, Peter L .; Stambuli, James P.; Chou, Teh-Chang; Hong, Bor-Cherng (2014). „Octakarbonylodikobalt”. Encyklopedia odczynników do syntezy organicznej . John Wiley & Synowie . s. 1–26. doi : 10.1002/047084289X.ro001.pub3 . ISBN 9780470842898 .
- ^ a b c d e f g h Donaldson, John Dallas; Beyersmann, Detmar (2005). „Kobalt i związki kobaltu”. Encyklopedia chemii przemysłowej Ullmanna . Wiley-VCH. doi : 10.1002/14356007.a07_281.pub2 . ISBN 3527306730 .
- ^ abcd Elschenbroich , C .; Salzer, A. (1992). Metaloorganiczne: zwięzłe wprowadzenie (wyd. 2). Weinheim: Wiley-VCH . ISBN 3-527-28165-7 .
- ^ abcd Sweany , Ray L .; Brązowy, Theodore L. (1977). „Widma w podczerwieni oktakarbonylu dikobaltu wyizolowanego z matrycy. Dowód na istnienie trzeciego izomeru”. Chemia nieorganiczna . 16 (2): 415–421. doi : 10.1021/ic50168a037 .
- ^ ab Gilmont , Paweł; Blanchard, Arthur A. (1946). „Dikobalt oktakarbonyl, kobalt nitrozylotrikarbonyl i kobalt tetrakarbonylo wodorek”. Syntezy nieorganiczne . 2 : 238–243. doi : 10.1002/9780470132333.ch76 . ISBN 9780470132333 .
- ^ ab Orchin, Milton (1953). „Uwodornianie związków organicznych za pomocą gazu syntezowego” . Postępy w katalizie . Tom. 5. Prasa akademicka . s. 385–415. ISBN 9780080565095 .
- ^ Sumner, G. Gardner; Klug, Harold P.; Aleksander, Leroy E. (1964). „Struktura krystaliczna oktakarbonylu dikobaltu”. Acta Crystallographica . 17 (6): 732–742. doi : 10.1107/S0365110X64001803 .
- ^ Zielony, Jennifer C .; Zielony, Malcolm LH ; Parkin, Gerard (2012). „Występowanie i reprezentacja trójśrodkowych wiązań dwuelektronowych w kowalencyjnych związkach nieorganicznych”. Komunikacja chemiczna . 2012 (94): 11481–11503. doi : 10.1039/c2cc35304k . PMID 23047247 .
- ^ Garcia, Thelma Y.; Fettinger, James C.; Olmstead, Marilyn M.; Balch, Alan L. (2009). „Wspaniała symetria: Krystalizacja niezmostkowanego izomeru Co 2 (CO) 8 w Co 2 (CO) 8 · C 60 ”. Komunikacja chemiczna . 2009 (46): 7143–7145. doi : 10.1039/b915083h . PMID 19921010 .
- ^ Mikołaj, Kenneth M. (1987). „Chemia i użyteczność syntetyczna kationów propargilu z kompleksem kobaltu”. wg. chemia Rez. (Recenzja). 20 (6): 207–214. doi : 10.1021/ar00138a001 .
- ^ Teobald, Barry J. (2002). „Reakcja Nicholasa: zastosowanie w syntezie kationów propargilowych stabilizowanych heksakarbonylem dikobaltu”. Czworościan (recenzja). 58 (21): 4133–4170. doi : 10.1016/S0040-4020(02)00315-0 .
- ^ ab Pauson , PL ; Khand, jm (1977). „Zastosowania kompleksów kobaltowo-karbonylowo-acetylenowych w syntezie organicznej”. Ann. NY Acad. nauka 295 (1): 2–14. Bibcode : 1977NYASA.295....2P . doi : 10.1111/j.1749-6632.1977.tb41819.x . S2CID 84203764 .
- ^ Blanco-Urgoiti, Jaime; Anorbe, Loreto; Pérez-Serrano, Leticia; Dominguez, Gema; Pérez-Castells, Javier (2004). „Reakcja Pausona-Khanda, potężne narzędzie syntetyczne do syntezy złożonych cząsteczek”. chemia soc. Obj. 33 (1): 32–42. doi : 10.1039/b300976a . PMID 14737507 .
- ^ Schore, Neil E. (1991). „Reakcja cykloaddycji Pausona-Khanda w syntezie cyklopentenonów”. Org. Reagować. 40 : 1–90. doi : 10.1002/0471264180.or040.01 . ISBN 0471264180 .
- ^ Gibson, Susan E.; Stevenazzi, Andrea (2003). „Reakcja Pausona-Khanda: nadeszła epoka katalityczna!”. Angew. chemia Int. wyd. 42 (16): 1800–1810. doi : 10.1002/anie.200200547 . PMID 12722067 .
- Bibliografia _ Kogure, Noriyuki; Kitajima, Mariko; Takayama, Hiromitsu (2011). „Asymetryczna synteza całkowita pentacyklicznego Lycopodium : Huperzine-Q”. Angew. chemia Int. wyd. 50 (35): 8025–8028. doi : 10.1002/anie.201103550 . PMID 21751323 .
- ^ Ho, Tse-Lok (2016). „Dikobalt oktakarbonylu” . Odczynniki Fiesersa do syntezy organicznej . Tom. 28. John Wiley & Synowie . s. 251–252. ISBN 9781118942819 .
- ^ a b Heck, Richard F .; Breslow, David S. (1961). „Reakcja hydrotetrakarbonylu kobaltu z olefinami”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 83 (19): 4023–4027. doi : 10.1021/ja01480a017 .
- ^ a b Halpern, Jack (2001). „Chemia metaloorganiczna u progu nowego tysiąclecia. Retrospekcja i perspektywa” . Chemia czysta i stosowana . 73 (2): 209–220. doi : 10.1351/pac200173020209 .
- ^ a b Pfeffer, M .; Grellier, M. (2007). „Kobalt metaloorganiczny”. Kompleksowa chemia metaloorganiczna III . Tom. 7. Elsevier . s. 1–119. doi : 10.1016/B0-08-045047-4/00096-0 . ISBN 9780080450476 .
- ^ Chini, P. (1968). „Zamknięte metalowe klastry karbonylowe”. Recenzje Inorganica Chimica Acta . 2 : 31–51. doi : 10.1016/0073-8085(68)80013-0 .
- ^ Nestlé, Mara O.; Hallgren, John E.; Seyferth, Dietmar; Dawson, Peter; Robinson, Brian H. (1980). μ 3 -Metylidyna i μ 3 -Benzylidyno-Tris(Trikarbonylokobalt) . Inorg. Syntezator. Syntezy nieorganiczne. Tom. 20. s. 226–229. doi : 10.1002/9780470132517.ch53 . ISBN 9780470132517 .
- ^ Cole Parmer MSDS
- ^ CDC - Kieszonkowy przewodnik NIOSH po zagrożeniach chemicznych




