Pomniejszy antygen zgodności tkankowej
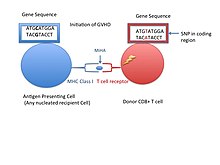
Pomniejszy antygen zgodności tkankowej (znany również jako MiHA ) to receptory na powierzchni komórkowej oddanych narządów, o których wiadomo, że dają odpowiedź immunologiczną w niektórych przeszczepach narządów. Powodują problemy z odrzuceniem rzadziej niż problemy z głównym kompleksem zgodności tkankowej (MHC). Mniejsze antygeny zgodności tkankowej (MiHA) to różnorodne, krótkie segmenty białek , określane jako peptydy. Te peptydy mają zwykle długość około 9-12 aminokwasów i są związane zarówno z głównym kompleksem zgodności tkankowej (MHC) klasy I, jak i klasy II białka. Sekwencje peptydów mogą się różnić między osobnikami, a różnice te wynikają z SNP w regionie kodującym genów, delecji genów , mutacji z przesunięciem ramki odczytu lub insercji . Około jedna trzecia scharakteryzowanych MiHA pochodzi z chromosomu Y. Białka składają się z pojedynczego immunogennego allelu HLA. Zanim staną się krótką sekwencją peptydową, białka wyrażane przez te polimorficzne lub zróżnicowane geny muszą zostać strawione w proteasomie do krótszych peptydów. Te endogenne lub własne peptydy są następnie transportowane do retikulum endoplazmatycznego z pompą transportera peptydów zwaną TAP , gdzie napotykają i wiążą się z cząsteczką MHC klasy I. Kontrastuje to z cząsteczek MHC klasy II , które są peptydami pochodzącymi z fagocytozy/endocytozy i molekularnej degradacji białek innych niż jednostki, zwykle przez komórki prezentujące antygen. Antygeny MiHA są albo wszechobecne w większości tkanek, takich jak skóra i jelita, albo w sposób restrykcyjny w komórkach odpornościowych.
Pomniejsze antygeny zgodności tkankowej wynikają z normalnych białek, które same w sobie są polimorficzne w danej populacji. Nawet jeśli dawca i biorca przeszczepu są identyczni pod względem głównych genów kompleksu zgodności tkankowej , różnice aminokwasowe w mniejszych białkach mogą powodować powolne odrzucanie przeszczepionej tkanki. Kilka zidentyfikowanych MiHA kodowanych autosomalnie i na chromosomie Y
Znane pomniejsze antygeny zgodności tkankowej
Poniższa tabela zawiera listę znanych MiHA, wariantów genów kodujących peptydy MiHA i ich ograniczone allele HLA.
| Identyfikator MiHA | Peptyd MiHA | Ograniczony HLA | Chromosom | Koordynować | Identyfikator SNP | Gen | Identyfikator genu zespołu |
|---|---|---|---|---|---|---|---|
| HA-1/A2 | VL[H/R]DDLLEA | A*02:01 | chr19 | 1068739 | rs1801284 | HMHA1 | ENSG00000180448 |
| HA-2 | YIGEVLVS[V/M] | A*02:01 | chr7 | 44977022 | rs61739531 | MYO1G | ENSG00000136286 |
| HA-8 | [R/P]TLDKVLEV | A*02:01 | chr9 | 2828765 | rs2173904 | KIAA0020 | ENSG00000080608 |
| HA-3 | V[T/M]EPGTAQY | *01:01 | chr15 | 85579423 | rs2061821 | AKAP13 | ENSG00000170776 |
| C19ORF48 | CIPPD[S/T]LLFPA | A*02:01 | chr19 | 50798945 | rs3745526 | C19ORF48 | ENSG00000167747 |
| LB-ADIR-1F | SVAPALAL[F/S]PA | A*02:01 | chr1 | 179082165 | rs2296377 | TOR3A | ENSG00000186283 |
| LB-HIVEP1-1S | SLPKH[S/N]VTI | A*02:01 | chr6 | 12123016 | rs2228220 | HIVEP1 | ENSG00000095951 |
| LB-NISCH-1A | ALAPAP[A/V]EV | A*02:01 | chr3 | 52489389 | rs887515 | NISCH | ENSG00000010322 |
| LB-SSR1-1S | [S/L]LAVAQDLT | A*02:01 | chr6 | 7310026 | rs10004 | SSR1 | ENSG00000124783 |
| LB-WNK1-1I | RTLSPE[I/M]ITV | A*02:01 | chr12 | 889199 | rs12828016 | WNK1 | ENSG00000060237 |
| T4A | GLYTYWSAG[A/E] | A*02:01 | chr3 | 140688418 | rs9876490 | PRZYTNIJ42 | ENSG00000155890 |
| UTA2-1 | QL[L/P]NSVLTL | A*02:01 | chr12 | 31981704 | rs2166807 | KIAA1551 | ENSG00000174718 |
| PANEL1 | RVWDLPGVLK | *03:01 | chr22 | 41940168 | rs5758511 | CENPM | ENSG00000100162 |
| SP110 | SLP[R/G]GTSTPK | *03:01 | chr2 | 230207994 | rs1365776 | SP110 | ENSG00000135899 |
| ACC-1C | DYLQ[Y/C]VLQI | A*24:02 | chr15 | 79971064 | rs1138357 | BCL2A1 | ENSG00000140379 |
| ACC-1Y | DYLQ[Y/C]VLQI | A*24:02 | chr15 | 79971064 | rs1138357 | BCL2A1 | ENSG00000140379 |
| P2RX7 | WFHHC[H/R]PKY | A*29:02 | chr12 | 121167552 | rs7958311 | P2RX7 | ENSG00000089041 |
| AKC-4 | ATLPLLCA[R/G] | A*31:01 | chr15 | 78944951 | rs2289702 | CTSH | ENSG00000103811 |
| AKC-5 | WATLPLLCA[R/G] | *33:03 | chr15 | 78944951 | rs2289702 | CTSH | ENSG00000103811 |
| LB-APOBEC3B-1K | [K/E]PQYHAEMCF | B*07:02 | chr22 | 38985821 | rs2076109 | APOBEC3B | ENSG00000179750 |
| LB-ARHGDIB-1R | LPRACW[R/P]EA | B*07:02 | chr12 | 14942624 | rs4703 | ARHGDIB | ENSG00000111348 |
| LB-BCAT2-1R | QP[R/T]RALLFVIL | B*07:02 | chr19 | 48799813 | rs11548193 | BCAT2 | ENSG00000105552 |
| LB-EBI3-1I | RPRARYY[I/V]QV | B*07:02 | chr19 | 4236999 | rs4740 | EBI3 | ENSG00000105246 |
| LB-ECGF-1H | RP[H/R]POWIETRZE | B*07:02 | chr22 | 50525826 | rs112723255 | TYMP | ENSG00000025708 |
| LB-ERAP1-1R | HPRQEQIALLA | B*07:02 | chr5 | 96803547 | rs26653 | ERAP1 | ENSG00000164307 |
| LB-FUCA2-1V | RLRQ[V/M]GSWL | B*07:02 | chr6 | 143502020 | rs3762002 | FUCA2 | ENSG00000001036 |
| LB-GEMIN4-1V | FPALRFVE[V/E] | B*07:02 | chr17 | 746265 | rs4968104 | GEMIN4 | ENSG00000179409 |
| LB-PDCD11-1F | GPDSSKT[F/L]LCL | B*07:02 | chr10 | 103434329 | rs2986014 | PDCD11 | ENSG00000148843 |
| LB-TEP1-1S | APDGAKVA[S/P]L | B*07:02 | chr14 | 20383870 | rs1760904 | TEP1 | ENSG00000129566 |
| LRH-1 | TPNQRQNVC | B*07:02 | chr17 | 3690983 | rs3215407 | P2X5 | ENSG00000083454 |
| ZAPHIR | IPRDSWWVEL | B*07:02 | chr19 | 57492212 | rs2074071 | ZNF419 | ENSG00000105136 |
| PODGRZEWANIE1 | ISKERA[E/G]AL | B*08:01 | chr1 | 236554626 | rs2275687 | PODGRZEWANIE1 | ENSG00000119285 |
| HA-1/B60 | KECVL[H/R]DDL | B*40:01 | chr19 | 1068739 | rs1801284 | HMHA1 | ENSG00000180448 |
| LB-SON-1R | SETKQ[R/C]TVL | B*40:01 | chr21 | 33553954 | rs13047599 | SYN | ENSG00000159140 |
| LB-SWAP70-1Q | MEQLE[Q/E]DGW | B*40:01 | chr11 | 9748015 | rs415895 | ZAMIANA70 | ENSG00000133789 |
| LB-TRIP10-1EPC | G[E/G][P/S]QDL[C/G]TL | B*40:01 | chr19 | 6751268 | rs1049229 | PODRÓŻ10 | ENSG00000125733 |
| SLC1A5 | AE[A/P]TANGGLAL | B*40:02 | chr19 | 46787917 | rs3027956 | SLC1A5 | ENSG00000105281 |
| AKC-2 | KEFED[D/G]IINW | B*44:03 | chr15 | 79970875 | rs3826007 | BCL2A1 | ENSG00000140379 |
| AKC-6 | MEIFIEVFSHF | B*44:03 | chr18 | 63953532 | rs9945924 | HMSD | ENSG00000221887 |
| HB-1H | EEKRGSL[H/Y]VW | B*44:03 | chr5 | 143820488 | rs161557 | HMHB1 | ENSG00000158497 |
| HB-1Y | EEKRGSL[H/Y]VW | B*44:03 | chr5 | 143820488 | rs161557 | HMHB1 | ENSG00000158497 |
| DPH1 | S[V/L]LPEVDVW | B*57:01 | chr17 | 2040586 | rs35394823 | DPH1 | ENSG00000108963 |
| UTDP4-1 | R[I/N]LAHFFCGW | DPB1*04 | chr9 | 128721272 | rs11539209 | ZDHHC12 | ENSG00000160446 |
| CD19 | WEGEPPC[L/V]P | DQB1*02:01 | chr16 | 28933075 | rs2904880 | CD19 | ENSG00000177455 |
| LB-PI4K2B-1S | SRSS[S/P]AELDRSR | DQB1*06:03 | chr4 | 25234395 | rs313549 | PI4K2B | ENSG00000038210 |
| LB-MTHFD1-1Q | SSIIAD[Q/R]IALKL | DRB1*03:01 | chr14 | 64442127 | rs2236225 | MTHFD1 | ENSG00000100714 |
| LB-LY75-1K | LGITYR[N/K]KSLMWF | DRB1*13:01 | chr2 | 159819916 | rs12692566 | LY75 | ENSG00000054219 |
| SLC19A1 | [R/H]LVCYLCFY | DRB1*15:01 | chr21 | 45537880 | rs1051266 | SLC19A1 | ENSG00000173638 |
| LB-PTK2B-1T | VYMND[T/K]SPLTPEK | DRB3*01:01 | chr8 | 27451068 | rs751019 | PTK2B | ENSG00000120899 |
| LB-MR1-1R | YFRLGVSDPI[R/H]G | DRB3*02:02 | chr1 | 181049100 | rs2236410 | MR1 | ENSG00000153029 |
Odpowiedź komórek T na MiHA
MiHA związane z MHC obecnym na powierzchni komórki mogą być rozpoznawane jako własne peptydy lub nierozpoznawane przez limfocyty T CD8 + lub CD4 +. Brak rozpoznawania limfocytu T przez ten własny antygen jest powodem, dla którego allogeniczny przeszczep komórek macierzystych dla genu dopasowanego do HLA lub MiHA rozwijającego się płodu w czasie ciąży może nie zostać rozpoznany przez limfocyty T i oznaczony jako obcy, co prowadzi do odpowiedzi immunologicznej. Chociaż receptory komórek B mogą również rozpoznawać MHC, wydaje się, że odpowiedzi immunologiczne są wywoływane tylko przez komórki T. Konsekwencje odpowiedzi immunologicznej obserwuje się w przypadku allogenicznego przeszczepu hematopoetycznych komórek macierzystych (HCT), gdy peptydy kodowane przez geny polimorficzne różnią się między limfocytami T biorcy i dawcy. W rezultacie limfocyty T dawcy mogą atakować komórki biorcy, co nazywa się chorobą przeszczep przeciw gospodarzowi ( GVHD ). Chociaż odrzucenie przeszczepu lub szpiku kostnego może mieć szkodliwe skutki, istnieją korzyści z immunoterapii, gdy cytotoksyczne limfocyty T są specyficzne dla własnego antygenu i mogą celować w antygeny ulegające selektywnej ekspresji na komórkach białaczkowych w celu zniszczenia tych komórek nowotworowych, co określa się mianem efektu przeszczep przeciw białaczce (GVL).
Rozpoznanie dojrzałej komórki T przez ten własny antygen nie powinno indukować odpowiedzi immunologicznej. Podczas selekcji grasicy zachodzącej w grasicy tylko tymocytu , który rozpoznaje cząsteczkę MHC klasy I lub klasy II plus peptyd, powinien przeżyć selekcję pozytywną . Istnieje jednak śmierć w wyniku apoptozy tymocytów, które nie wchodzą w interakcje z cząsteczkami MHC lub mają receptory o wysokim powinowactwie do własnego MHC i własnego antygenu, proces określany jako negatywny wybór. Dlatego proces pozytywnej i negatywnej selekcji oznacza, że mniej samoreaktywnych dojrzałych komórek T opuści grasicę i doprowadzi do problemów autoimmunologicznych.
Odkrycie MiHA
Znaczenie MiHA w odpowiedzi immunologicznej zostało rozpoznane po przeszczepie. Biorca rozwinął GVHD pomimo posiadania genów dopasowanych do HLA w głównym locus zgodności tkankowej. Eksperyment wzbudził pytania o możliwość istnienia MiHA. Mówiąc dokładniej, pierwszy MiHA został odkryty, gdy doszło do przeszczepu szpiku kostnego między płciami przeciwnymi. Biorczyni otrzymała komórki szpiku kostnego dopasowane do MHC, ale nadal miała aktywne cytotoksyczne komórki T (CD8+). Limfocyty T CD8+ były aktywne i celowały w męskie komórki szpiku kostnego. Stwierdzono, że męskie komórki szpiku kostnego prezentują peptyd w rowku MHC, kodowany przez gen na chromosomie Y. Peptyd był obcy dla żeńskich komórek T, a samice nie mają chromosomu Y, a zatem tego MiHA. MiHA kodowane przez chromosom Y są znane jako antygeny HY.
antygen HY
Antygeny HY są kodowane przez geny na chromosomie Y. Stwierdzono, że oba allele HLA klasy I i II prezentują te antygeny. Niektóre z tych antygenów są wszechobecne w jądrzastych komórkach męskich, a obecność tych antygenów wiąże się z większym ryzykiem rozwoju allogenicznego przeszczepu komórek macierzystych GVHD dla genu dopasowanego do HLA, gdy występuje mężczyzna biorca i kobieta dawczyni. HY MiHA odgrywają rolę w ciąży z płodem płci męskiej, ponieważ komórki płodu mogą przenikać z łożyska do krwioobiegu matki, gdzie matczyne limfocyty T reagują na obcy antygen prezentowany zarówno na MHC klasy I, jak i II. Dlatego limfocyty T CD8+ specyficzne dla HY rozwijają się we krwi matki i mogą atakować komórki płodu z jądrem wyrażającym antygen na cząsteczce MHC klasy I. Odpowiedź na te antygeny HY płodu jest związana z kobietami doświadczającymi wtórnego poronienia nawracającego, które wcześniej były w ciąży z płodem męskim. Kobiety z wcześniejszą ciążą męską mają limfocyty T, które wcześniej miały kontakt z tymi antygenami HY iw konsekwencji szybciej je rozpoznają. Stwierdzono, że kobiety z poronieniami nawracającymi zawierają również MHC II, które mają zdolność prezentowania tych antygenów komórkom pomocniczym T (CD4+), co jest istotne dla aktywacji CD8+.
Antygen zgodności tkankowej 1 (HA1)
HA1 wynika z SNP przekształcającego allel nieimmunogenny (KECVL R DDLLEA) w allel immunogenny (KECVL H DDLLEA). Ten SNP skutkuje lepszą zdolnością wiązania peptydu do rowka określonej cząsteczki MHC klasy I znajdującej się na komórkach prezentujących antygen. Znaczenie zmiany peptydu w postać immunogenną polega na tym, że teraz specyficzne limfocyty T ograniczone do HLA-A 0201 mogą rozpoznawać peptyd prezentowany przez cząsteczki HLA-A0201 MHC klasy I. To rozpoznanie prowadzi do odpowiedzi immunologicznej, jeśli limfocyty T rozpoznają peptyd jako obcy. To rozpoznanie ma miejsce, gdy dana osoba nie ma immunogennej wersji peptydu, ale jest narażona na peptyd HA-1 podczas ciąży lub allogenicznego przeszczepu komórek macierzystych. Podczas ciąży stwierdzono, że HA-1 płodu pochodzi z łożyska i zidentyfikowano specyficzne matczyne limfocyty T CD8+ rozpoznające tę MiHA.
Immunoterapia Efekt przeszczepu przeciwko białaczce
Komórki T CD8+, które są specyficzne dla MiHA, mogą celować w te antygeny, gdy ulegają one swoistej ekspresji na komórkach nowotworowych, co pozwala na zniszczenie szkodliwych komórek nowotworowych. U myszy wykazano, że limfocyty T CD8 + dawcy allogenicznego przeszczepu komórek macierzystych specyficzne dla MiHA znalezionego u biorcy hamują podział komórek białaczkowych . Istnieje jednak ryzyko rozwoju GVHD, jeśli komórki T są specyficzne dla MiHA wyrażanych wszechobecnie na nabłonku komórki. Mówiąc dokładniej, HA-8, UGT2B17 i SMCY MiHA, które są wszechobecne, stwarzają większe ryzyko rozwoju GVHD. Dlatego, aby zapobiec niekorzystnym skutkom GVHD, MiHA ograniczone do komórek odpornościowych są idealnymi celami dla przeszczepu przeciwko białaczce (GVL), ponieważ nie wszystkie komórki jądrzaste są celem odpowiadających komórek T. Przykładem idealnego celu jest MiHA HB-1, który jest silnie wyrażany w szkodliwych komórkach B, ale ma niską ekspresję w innych komórkach tkankowych.
Implikacje kliniczne
Immunizacja matek przeciwko antygenom mniejszej zgodności tkankowej (HY) swoistymi dla samców odgrywa rolę patogenną w wielu przypadkach wtórnego poronienia nawracającego , to jest nawracającego poronienia w ciążach następujących po poprzednim żywym porodzie. Przykładem tego efektu jest to, że stosunek liczby mężczyzn do kobiet u dzieci urodzonych przed i po wtórnym poronieniu nawracającym wynosi odpowiednio 1,49 i 0,76.
Zobacz też
Linki zewnętrzne
- Minor+histocompatibility+antygens w US National Library of Medicine Medical Subject Headings (MeSH)