HLA-A
| MHC klasa I , A | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| (heterodimer) | ||||||||||
 Ilustracja HLA-A
| ||||||||||
| Rodzaj białka | Białko transbłonowe | |||||||||
| Funkcjonować | Prezentacja peptydów do rozpoznawania immunologicznego | |||||||||
| ||||||||||
HLA-A to grupa ludzkich antygenów leukocytarnych (HLA), które są kodowane przez locus HLA-A , który znajduje się na ludzkim chromosomie 6p21.3. HLA jest głównego układu zgodności tkankowej (MHC) swoistym dla ludzi. HLA-A jest jednym z trzech głównych typów ludzkich białek transbłonowych MHC klasy I. Pozostałe to HLA-B i HLA-C . Białko jest heterodimerem i składa się z ciężkiego łańcucha α i mniejszego łańcucha β. Łańcuch α jest kodowany przez wariant genu HLA-A , a łańcuch β (β 2 -mikroglobulina mikroglobuliny β2 ) jest niezmienną cząsteczką . Białko mikroglobuliny β2 jest kodowane przez gen B2M, który u ludzi znajduje się na chromosomie 15q21.1 .
Cząsteczki MHC klasy I, takie jak HLA-A, są częścią procesu prezentującego krótkie polipeptydy układowi odpornościowemu. Te polipeptydy mają typowo długość 7-11 aminokwasów i pochodzą z białek ulegających ekspresji w komórce. Istnieją dwie klasy polipeptydów, które mogą być prezentowane przez białko HLA: te, które mają być wyrażane przez komórkę (własne) i te pochodzenia obcego (nie-własne). W normalnych warunkach cytotoksyczne limfocyty T , które normalnie patrolują organizm we krwi, „odczytują” prezentowany przez kompleks peptyd. Limfocyty T, jeśli funkcjonują prawidłowo, wiążą się tylko z peptydami innymi niż własne. Jeśli nastąpi wiązanie, rozpoczyna się seria zdarzeń, których kulminacją jest śmierć komórki poprzez apoptozę . W ten sposób ludzki organizm eliminuje wszelkie komórki zakażone wirusem lub wykazujące ekspresję białek, którymi nie powinny być (np. komórki rakowe).
U ludzi, podobnie jak w większości populacji ssaków, cząsteczki MHC klasy I są niezwykle zmienne w swojej strukturze pierwszorzędowej , a HLA-A zalicza się do genów o najszybciej ewoluującej sekwencji kodującej u ludzi. Według stanu na marzec 2022 r. Znanych jest 7452 alleli HLA-A kodujących 4305 białek aktywnych i 375 białek zerowych Ten poziom zmienności MHC klasy I jest główną przyczyną odrzucenia przeszczepu, ponieważ jest mało prawdopodobne, aby przypadkowy przeszczep między dawcą a gospodarzem doprowadził do dopasowania antygenów HLA-A, B lub C. Biolodzy ewolucyjni uważają również, że duża zmienność HLA jest wynikiem równoważenia sprzecznych czynników chorobotwórczych. Większa różnorodność HLA zmniejsza prawdopodobieństwo, że cała populacja zostanie zniszczona przez pojedynczy patogen, ponieważ niektóre osobniki będą wysoce odporne na każdy patogen. Wpływ zmienności HLA-A na progresję HIV/AIDS omówiono poniżej .
gen HLA-A
| HLA-A | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , Aw-33, Aw-74, główny zespół zgodności tkankowej, klasa I, A, HLA-A11, HLA-A33, HLA-DQB1, HLA-DRB1 Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Gen HLA-A znajduje się na krótkim ramieniu chromosomu 6 i koduje większy łańcuch α, składnik HLA-A. Zmienność łańcucha α HLA-A jest kluczem do funkcji HLA. Ta zmienność sprzyja różnorodności genetycznej w populacji. Ponieważ każdy HLA ma inne powinowactwo do peptydów o pewnych strukturach, większa różnorodność HLA oznacza większą różnorodność antygenów, które mają być „prezentowane” na powierzchni komórki, zwiększając prawdopodobieństwo, że podzbiór populacji będzie odporny na danego obcego najeźdźcę. Zmniejsza to prawdopodobieństwo, że pojedynczy patogen jest w stanie zniszczyć całą populację ludzką.
Każda osoba może eksprymować do dwóch typów HLA-A, po jednym od każdego z rodziców. Niektóre osoby odziedziczą ten sam HLA-A od obojga rodziców, zmniejszając ich indywidualną różnorodność HLA; jednak większość osób otrzyma dwie różne kopie HLA-A. Ten sam wzór dotyczy wszystkich grup HLA. Innymi słowy, każda osoba może wyrazić tylko jeden lub dwa z 2432 znanych alleli HLA-A.
Allele
Wszystkie HLA mają przypisaną nazwę przez Komitet Nazewnictwa Światowej Organizacji Zdrowia ds. Czynników Systemu HLA. Ta nazwa jest zorganizowana tak, aby dostarczyć jak najwięcej informacji o konkretnym allelu, zachowując jednocześnie jak najkrótszą nazwę. Nazwa HLA wygląda mniej więcej tak:
HLA-A*02:01:01:02L
Wszystkie allele otrzymują co najmniej czterocyfrową klasyfikację (HLA-A*02:12). A oznacza, do którego genu HLA należy dany allel. Istnieje wiele alleli HLA-A, więc klasyfikacja według serotypu upraszcza kategoryzację. Następna para cyfr wskazuje to przyporządkowanie. Na przykład HLA-A*02:02 zarchiwizowane 2013-12-16 w Wayback Machine , HLA-A*02:04 zarchiwizowane 2013-12-16 w Wayback Machine i HLA-A*02:324 zarchiwizowane 2013- 12-16 w Wayback Machine wszyscy należą do serotypu A2 (oznaczonego prefiksem *02). Ta grupa jest głównym czynnikiem odpowiedzialnym za kompatybilność HLA. Wszystkie liczby po tym nie mogą być określone przez serotypowanie i są określane przez sekwencjonowanie genów. Drugi zestaw cyfr wskazuje, jakie białko HLA jest produkowane. Są one przypisywane w kolejności odkrycia, a od grudnia 2013 r. Znanych jest 456 różnych białek HLA-A*02 (nazwy przypisane od HLA-A*02:01 do HLA-A*02:456). Najkrótsza możliwa nazwa HLA zawiera oba te szczegóły. Każde rozszerzenie poza to oznacza synonimiczne mutacje w regionie kodującym i mutacje poza regionem kodującym. Interpretacja rozszerzeń jest omówiona bardziej szczegółowo w aktualny system nazewnictwa HLA .
Białko
Białko kodowane przez gen HLA-A ma długość 365 aminokwasów i waży około 41 000 daltonów (Da). Zawiera 8 eksonów.
| egzon | Segment białkowy |
|---|---|
| 1 | Peptyd sygnałowy |
| 2 | domena α1 |
| 3 | domena α2 |
| 4 | domena α3 |
| 5 | region transbłonowy |
| 6 | ogon cytoplazmatyczny |
| 7 | ogon cytoplazmatyczny |
| 8 | Nieokreślony |
Peptyd sygnałowy HLA-A to seria hydrofobowych aminokwasów obecnych na N-końcu białka, które kierują je do retikulum endoplazmatycznego , gdzie następuje translacja pozostałych siedmiu domen. Trzy domeny α tworzą rowek wiążący, który utrzymuje peptyd do prezentacji komórkom t CD8+ . Region transbłonowy to region osadzony w dwuwarstwie fosfolipidowej otaczającej światło ER. białkiem transbłonowym o pojedynczym przejściu . Innymi słowy, pierwsze cztery domeny białka znajdują się w świetle ER, podczas gdy ostatnie trzy domeny są obecne na zewnątrz światła, nadając białku orientację wymaganą do prawidłowego funkcjonowania. Ostatnie trzy domeny białka tworzą ogon przede wszystkim Arkusze β , które pozostają w cytozolu komórki.
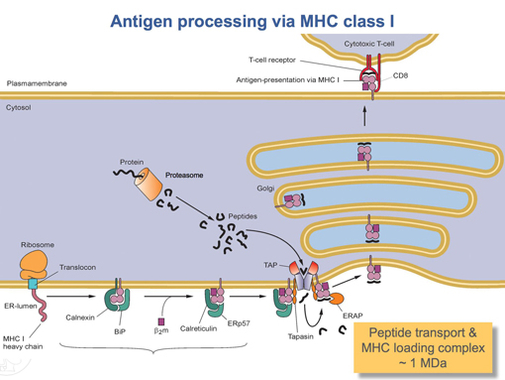
Gdy białko HLA-A zostanie całkowicie przetłumaczone, musi zostać złożone w odpowiedni kształt. Cząsteczkowe białko opiekuńcze zwane kalneksyną i enzym o nazwie ERp57 pomagają w procesie fałdowania. Calnexin utrzymuje łańcuch ciężki HLA-A, podczas gdy Erp57 katalizuje wiązania dwusiarczkowe między łańcuchem ciężkim a lekkim łańcuchem β2- mikroglobuliny . Wiązanie to indukuje zmianę konformacyjną w łańcuchu ciężkim, tworząc rowek wiążący. Kalneksyna następnie dysocjuje z kompleksem, obecnie określanym jako kompleks ładujący peptyd, i jest zastępowana kalretikuliną , inne białko opiekuńcze. Krótkie peptydy są nieustannie transportowane z okolic komórki do światła ER przez wyspecjalizowane białko transportowe zwane TAP . Następnie TAP wiąże się z kompleksem ładującym peptyd wraz z innym białkiem, zwanym tapasyną . W tym momencie peptydowy kompleks ładujący składa się z HLA-A (łańcuch ciężki), β2 -mikroglobulina (łańcuch lekki), enzym ERp57, białko opiekuńcze kalretikuliny, TAP (ze związanym fragmentem peptydowym) oraz tapasyna. Tapasin zwiększa stabilność TAP, oprócz stabilizacji całego peptydowego kompleksu ładującego. W tym momencie TAP uwalnia peptyd, który przetransportował do światła ER. Bliskość rowka wiążącego HLA-A do TAP zapewnia peptydowy kompleks ładujący. Zwiększa to prawdopodobieństwo, że peptyd znajdzie rowek. Jeśli powinowactwo peptydu do białka HLA-A jest wystarczająco duże, wiąże się w rowku. Badania sugerują, że tapasyna może aktywnie ładować peptydy z TAP do kompleksu HLA-A, jednocześnie utrzymując cząsteczki klasy I w świetle ER, aż do związania peptydu o wysokim powinowactwie.
Gdy peptyd o wystarczająco wysokim powinowactwie zwiąże się z MHC klasy I, kalretikulina, ERp57, TAP i tapasyna uwalniają cząsteczkę. W tym momencie kompleks klasy I składa się z białka HLA-A związanego z β2 -mikroglobulina i krótki peptyd. Nadal jest zakotwiczony w błonie ER przez domenę transbłonową. W pewnym momencie ER otrzyma sygnał, a część błony utrzymującej kompleks pęknie i zostanie przetransportowana do ciałek Golgiego w celu dalszego przetwarzania. Z ciałek Golgiego kompleks jest transportowany, ponownie przez transport pęcherzykowy, do błony komórkowej. To jest punkt, w którym wspomniana wcześniej orientacja staje się ważna. Część kompleksu HLA-A zawierająca peptyd musi znajdować się na zewnętrznej powierzchni błony komórkowej. Osiąga się to poprzez fuzję pęcherzyków z błoną komórkową.
Funkcjonować
Funkcja naturalna
Cząsteczki MHC klasy I prezentują układowi odpornościowemu małe peptydy, zazwyczaj o długości 7-10 aminokwasów. Glikoproteina zwana CD8 wiąże się z resztami 223-229 w domenie α3 HLA-A i ta glikoproteina stabilizuje interakcje między receptorem komórek t na cytotoksycznych (CD8 + ) limfocytach T i MHC klasy I. Receptor komórek T ma również potencjał wiązania się z peptydem prezentowanym przez MHC. W prawidłowo funkcjonującym układzie odpornościowym tylko komórki T, które nie wiążą własnych peptydów, są dopuszczane z grasicy, a zatem jeśli komórka T wiąże się z peptydem, musi to być peptyd obcy lub nieprawidłowy. Komórka T następnie inicjuje apoptoza , czyli programowana śmierć komórki. Proces ten może nastąpić już po 5 minutach od początkowej prezentacji obcego antygenu, chociaż zwykle potrzeba kilku godzin, aby śmierć stała się widoczna. Proces ten jest podstawą nabytej odporności i służy jako podstawowa obrona przed wirusami i innymi patogenami wewnątrzkomórkowymi.
Inne czynności
W latach sześćdziesiątych XX wieku stało się jasne, że czynniki działające na narządy i tkanki od dawców często powodowały zniszczenie oddanej tkanki przez układ odpornościowy gospodarza. MHC zostały pierwotnie odkryte w wyniku tej obserwacji ( więcej szczegółów w historii HLA ). Istnieją dwa rodzaje kompleksów prezentujących peptydy, MHC klasy I i klasy II. Każdy z nich ma wiele genów HLA, z których HLA-A jest tylko jednym. Istnieją trzy główne HLA, które powinny być dopasowane między dawcami i biorcami. Są to HLA-A, HLA-B (oba MHC klasy I) i HLA-DR (MHC klasy II). Jeśli dwie tkanki mają te same geny kodujące te trzy HLA, prawdopodobieństwo i nasilenie odrzucenia jest zminimalizowane.
Rola w chorobie
| Choroba powiązana | Serotypy | ||
| Zesztywniające zapalenie stawów kręgosłupa | A24 | ||
| Cukrzyca typu I | A1 | A24 | |
| Hemochromatoza (niższe komórki CD8+) | A3 | ||
| Myasthenia gravis | A3 | A24 | A30 |
| Białaczka, komórki T, dorosły | A26 | A68 | |
| Stwardnienie rozsiane | A3 | ||
| Podejrzenie wirusa brodawczaka. | A11 | ||
| Spontaniczna aborcja | A2 | ||
HLA służą jako jedyne ogniwo łączące układ odpornościowy z tym, co dzieje się wewnątrz komórek. Zatem jakakolwiek zmiana ze strony HLA, czy to zmniejszone wiązanie z pewnym peptydem, czy zwiększone wiązanie z pewnym peptydem, wyraża się odpowiednio jako zwiększona podatność na chorobę lub zmniejszona podatność na chorobę. Innymi słowy, niektóre HLA mogą być niezdolne do wiązania któregokolwiek z krótkich peptydów wytwarzanych przez proteolizę białek chorobotwórczych. W takim przypadku układ odpornościowy nie ma możliwości stwierdzenia, że komórka jest zainfekowana. W ten sposób infekcja może rozprzestrzeniać się w dużej mierze bez kontroli. To działa też w drugą stronę. Niektóre HLA wiążą patogenne fragmenty peptydowe z bardzo wysokim powinowactwem. To w istocie „doładowuje” ich układ odpornościowy w odniesieniu do tego konkretnego patogenu, umożliwiając im radzenie sobie z infekcją, która w innym przypadku mogłaby być katastrofalna.
HIV/AIDS
Jednym z najlepiej zbadanych przykładów zróżnicowanej regulacji immunologicznej patogenu jest ludzki wirus niedoboru odporności . Ponieważ HIV jest wirusem RNA, mutuje niezwykle szybko. To zmienia peptydy wytwarzane przez proteolizę, co zmienia peptydy, które mogą być prezentowane układowi odpornościowemu przez MHC zainfekowanej komórki. Każdy wirus z mutacją, która tworzy peptyd o wysokim powinowactwie do określonego HLA, jest szybko zabijany przez układ odpornościowy, a zatem nie przeżywa, a peptyd o wysokim powinowactwie nie jest już produkowany. Okazuje się jednak, że nawet HIV ma pewne konserwatywne regiony w swoim genomie, a jeśli HLA jest zdolny do wiązania się z peptydem wytwarzanym z konserwowanego regionu, HIV niewiele może zrobić, aby uniknąć wykrycia przez układ odpornościowy i zniszczenia. Jest to zasada leżąca u podstaw zróżnicowanego miana wirusa HIV, w którym pośredniczy HLA.
Przy ponad 2000 wariantach kodowanego HLA-A MHC trudno jest określić wpływ wszystkich wariantów na miano wirusa HIV. Jednak kilku wybranych zostało w to zamieszanych. Wykazano, że HLA-A*30 zmniejsza miano wirusa do mniej niż 10 000 kopii/milimetr sześcienny, co uważa się za dość niskie. Z drugiej strony, HLA-A*02 jest zaangażowany w wysokie miano wirusa (powyżej 100 000 kopii/milimetr sześcienny), gdy jest powiązany z HLA-B*45. Ponadto haplotypy HLA-A*23-C*07 i HLA-A*02-C*16 zazwyczaj wyrażały zwiększone miano wirusa w badanej populacji Zambijczyków. Jednym z najskuteczniejszych haplotypów hamujących HIV był HLA-A*30-C*03, a jednym z najmniej skutecznych był HLA-A*23*B*14. Podsumowując, HLA-A*23 był silnie skorelowany ze zwiększonym obciążeniem wirusem HIV wśród badanej populacji, chociaż należy zauważyć, że w przypadku próbek o różnym pochodzeniu etnicznym korelacja ta znacznie się zmniejsza.
Chociaż klasyfikacja wpływu poszczególnych genów i alleli HLA na obecność wirusa HIV jest trudna, wciąż można wyciągnąć pewne mocne wnioski. Osoby, które są homozygotyczne pod względem jednego lub więcej genów HLA klasy I, zwykle przechodzą do AIDS znacznie szybciej niż osoby heterozygotyczne. U niektórych osobników homozygotycznych tempo progresji jest dwukrotnie większe niż u heterozygot. Ta zróżnicowana progresja jest dość ściśle skorelowana ze stopniem heterozygotyczności. Podsumowując, niektóre allele HLA-A są związane z różnymi mianami wirusa u pacjentów zakażonych wirusem HIV; jednak ze względu na różnorodność tych alleli trudno jest sklasyfikować wpływ każdego allelu na regulację immunologiczną HIV. Niemniej jednak możliwe jest skorelowanie heterozygotyczności w allelach HLA-A ze zmniejszonym tempem progresji do AIDS.
Niektóre allele HLA nie tylko zwiększają lub zmniejszają oporność na HIV, ale HIV jest w stanie zmienić ekspresję HLA i robi to selektywnie, prowadząc do ograniczonej eliminacji przez komórki NK (komórki NK). Badania wykazały, że HIV obniża ekspresję MHC klasy I w zakażonych komórkach. Jednak robienie tego bezkrytycznie otwiera możliwość ataku komórek NK, ponieważ komórki NK reagują na obniżenie poziomu HLA-C i HLA-E. Oczywiście mechanizm ten wywarł selektywną presję na wirusa HIV. W ten sposób HIV rozwinął zdolność do obniżania poziomu HLA-A i HLA-B bez znaczącego zakłócania ekspresji HLA-C i HLA-E. Białko kodowane przez genom HIV, negatywny czynnik regulacyjny (Nef), indukuje tę zmianę przez wiązanie się z ogonem cytoplazmatycznym MHC klasy I, gdy znajduje się on jeszcze w retikulum endoplazmatycznym lub czasami, gdy znajduje się we wczesnych stadiach przemieszczania się przez ciała Golgiego. Ten kompleks MHC i Nef powoduje następnie, że białko adaptorowe 1 (AP-1) kieruje MHC do lizosomów w celu degradacji zamiast do błony komórkowej, gdzie normalnie funkcjonuje. Oprócz selektywnej regulacji w dół HLA, negatywny czynnik regulacyjny (Nef) umożliwia HIV obniżenie poziomu CD4 i CD8. Te glikoproteiny są niezbędne odpowiednio do wiązania pomocniczych komórek t i cytotoksycznych komórek t z MHC. Bez tych kofaktorów prawdopodobieństwo, że oba typy komórek t zwiążą się z HLA i zainicjują apoptozę, jest mniejsze, nawet jeśli HLA wyraża peptyd pochodzący z HIV (nie-własny). Oba te białka są również ukierunkowane na swoją cytoplazmatyczną domenę ogona. Połączenie tych zdolności znacznie zwiększa zdolność wirusa HIV do unikania wykrycia przez układ odpornościowy.
Streszczenie
HLA-A to jedna szczególna grupa ludzkich MHC klasy I. Składa się z kilkuset różnych genów i kilku tysięcy wariantów alleli. HLA-A ma kluczowe znaczenie dla odpowiedzi immunologicznej kontrolowanej przez cytotoksyczne komórki T na wirusy i inne patogeny wewnątrzkomórkowe. Ponieważ każdy gen HLA-A ma wysokie powinowactwo do nieco innych peptydów, niektóre HLA-A są związane ze zwiększonym ryzykiem, szybszym postępem i/lub zwiększoną ciężkością wielu chorób. Z podobnych powodów dopasowanie HLA-A jest niezbędne do udanych przeszczepów tkanek.
Linki zewnętrzne
- Antropologia molekularna Grupa Yahoo
- Baza danych częstotliwości alleli i haplotypów HLA
- Nazewnictwo HLA Pełna lista białek klasy I
- Przegląd wszystkich informacji strukturalnych dostępnych w PDB dla UniProt : P04439 (antygen zgodności tkankowej HLA klasy I, łańcuch alfa) w PDBe-KB .













































![2git: Human Class I MHC HLA-A2 in complex with the modified HTLV-1 TAX (Y5K-4-[3-Indolyl]-butyric acid) peptide](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1f/PDB_2git_EBI.jpg/180px-PDB_2git_EBI.jpg)
![2gj6: The complex between TCR A6 and human Class I MHC HLA-A2 with the modified HTLV-1 TAX (Y5K-4-[3-Indolyl]-butyric acid) peptide](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0c/PDB_2gj6_EBI.jpg/180px-PDB_2gj6_EBI.jpg)