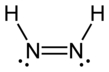diimid
|
|||
|
|||
| Nazwy | |||
|---|---|---|---|
|
nazwa IUPAC
diazen
|
|||
| Inne nazwy Diimid Diimina |
|||
| Identyfikatory | |||
|
|||
|
Model 3D ( JSmol )
|
|||
| CHEBI | |||
| ChemSpider | |||
| KEGG | |||
| Siatka | diazen | ||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| H2N2 _ _ _ | |||
| Masa cząsteczkowa | 30,030 g · mol -1 | ||
| Wygląd | Żółty gaz | ||
| Temperatura topnienia | -80 ° C (-112 ° F; 193 K) | ||
| Związki pokrewne | |||
|
Inne aniony
|
difluorek diazotu difosfenu |
||
|
Inne kationy
|
związki azowe | ||
|
Powiązane azany binarne
|
amoniak diazan triazan |
||
|
Związki pokrewne
|
izodiazen triazen tetrazen |
||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
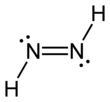
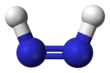
Diimid , zwany także diazenem lub diiminą , jest związkiem o wzorze (NH) 2 . Występuje w postaci dwóch izomerów geometrycznych , E ( trans ) i Z ( cis ). Termin diazen jest bardziej powszechny w przypadku organicznych pochodnych diimidu. Zatem azobenzen jest przykładem organicznego diazenu.
Synteza
Tradycyjna droga do diimidu obejmuje utlenianie hydrazyny nadtlenkiem wodoru lub powietrzem. Alternatywnie hydroliza azodikarboksylanu dietylu lub azodikarbonamidu daje diimid:
- (NCOOH) 2 → (NH) 2 + 2 CO 2
Obecnie diimid powstaje w wyniku termicznego rozkładu 2,4,6-triizopropylobenzenosulfonylohydrazydu.
Ze względu na swoją niestabilność diimid jest generowany i używany in situ . Powstaje mieszanina izomerów cis ( Z- ) i trans ( E- ). Oba izomery są niestabilne i przechodzą powolną interkonwersję. Izomer trans jest bardziej stabilny, ale izomer cis reaguje z substratami nienasyconymi, dlatego równowaga między nimi przesuwa się w kierunku izomeru cis zgodnie z zasadą Le Chateliera . Niektóre procedury wymagają dodania kwasów karboksylowych, które katalizują izomeryzację cis-trans. Diimid łatwo się rozkłada. Nawet w niskich temperaturach bardziej stabilny trans szybko podlega różnym reakcjom dysproporcjonowania, głównie tworząc hydrazynę i gazowy azot :
- 2 HN=NH → H 2 N–NH 2 + N 2
Ze względu na tę konkurencyjną reakcję rozkładu, redukcje diimidem zwykle wymagają dużego nadmiaru odczynnika prekursorowego.
Zastosowania w syntezie organicznej
Diimid jest czasami przydatny jako odczynnik w syntezie organicznej . Uwodornia alkeny i alkiny z selektywnym dostarczaniem wodoru z jednej strony substratu, co daje taką samą stereoselektywność jak katalizowana metalem syn - addycja H 2 . Jedynym uwalnianym produktem ubocznym jest gazowy azot. Chociaż metoda jest kłopotliwa, zastosowanie diimidu pozwala uniknąć konieczności stosowania wysokich ciśnień lub gazowego wodoru i katalizatorów metalicznych, które mogą być kosztowne. Mechanizm uwodornienia obejmuje sześcioczłonowy stan przejściowy C 2 H 2 N 2 :
Selektywność
Diimid jest korzystny, ponieważ selektywnie redukuje alkeny i alkiny i jest niereaktywny w stosunku do wielu grup funkcyjnych , które mogłyby zakłócać normalne katalityczne uwodornienie . Tak więc nadtlenki , halogenki alkilowe i tiole są tolerowane przez diimid, ale te same grupy byłyby zazwyczaj degradowane przez katalizatory metaliczne. Odczynnik preferencyjnie redukuje alkiny i niezakłócone lub napięte alkeny do odpowiednich alkenów i alkanów.
Powiązany
postać dikationowa , HNNH 2+ (diprotonowany diazot), ma najsilniejsze znane wiązanie chemiczne. Ten jon można traktować jako podwójnie protonowaną cząsteczkę azotu. Rząd względnej siły wiązania (RBSO) wynosi 3,38. FNNH 2+ i FNNF 2+ mają nieco mniejszą wytrzymałość wiązań.
- ^ a b Ohno, M .; Okamoto, M. (1973). „cis-Cyklododecen” . Syntezy organiczne . ; Tom zbiorowy , obj. 5, str. 281
- Bibliografia _ Holleman, AF (2001). „1.2.7: Diimina , N2H2 ” . Chemia nieorganiczna . Elsevier . P. 628. ISBN 9780123526519 .
- ^ Chamberlin, A. Richard; Sheppeck, James E.; Somoza, Alvaro (2008). „2,4,6-Triizopropylobenzenosulfonylohydrazyd”. Encyklopedia odczynników do syntezy organicznej . doi : 10.1002/047084289X.rt259.pub2 . ISBN 978-0471936237 .
- ^ abc Pasto , DJ ( 2001). „Diimid”. Encyklopedia odczynników do syntezy organicznej . John Wiley & Synowie. doi : 10.1002/047084289X.rd235 . ISBN 0471936235 .
- ^ Wiberg, Nils; Holleman, AF; Wiberg, Egon, wyd. (2001). „1.2.7 Diimina N2H2 [ 1.13.17 ] ”. Chemia nieorganiczna . Prasa akademicka. s. 628–632. ISBN 978-0123526519 .
- ^ Miller, CE (1965). „Uwodornianie diimidem”. Journal of Chemical Education . 42 (5): 254–259. Bibcode : 1965JChEd..42..254M . doi : 10.1021/ed042p254 .
- ^ ab Kalescky , Robert; Kraka, Elfi; Cremer, Dieter (12 września 2013). „Identyfikacja najsilniejszych wiązań w chemii”. Czasopismo Chemii Fizycznej A. 117 (36): 8981–8995. Bibcode : 2013JPCA..117.8981K . doi : 10.1021/jp406200w . PMID 23927609 .