inden
|
|

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
1H - inden |
|
| Inne nazwy Benzocyklopentadien Indonaften Bicyklo[4.3.0]nona-1,3,5,7-tetraen |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 635873 | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Bank Leków | |
| Karta informacyjna ECHA | 100.002.176 |
| Numer WE |
|
| 27265 | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 9 H 8 | |
| Masa cząsteczkowa | 116.16 |
| Wygląd | Bezbarwna ciecz |
| Gęstość | 0,997 g/ml |
| Temperatura topnienia | -1,8 ° C (28,8 ° F; 271,3 K) |
| Temperatura wrzenia | 181,6 ° C (358,9 ° F; 454,8 K) |
| Nierozpuszczalny | |
| Kwasowość ( p Ka ) | 20,1 (w DMSO) |
| −80,89 × 10 −6 cm3 / mol | |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
Zapalny |
| Punkt zapłonu | 78,3 ° C (172,9 ° F; 351,4 K) |
| NIOSH (limity ekspozycji na zdrowie w USA): | |
|
PEL (dopuszczalny)
|
nic |
|
REL (zalecane)
|
TWA 10 ppm (45 mg/m 3 ) |
|
IDLH (bezpośrednie zagrożenie)
|
ND |
| Związki pokrewne | |
|
Związki pokrewne
|
benzofuran , benzotiofen , indol |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
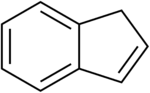
Inden jest łatwopalnym wielopierścieniowym węglowodorem o wzorze chemicznym C 9 H 8 . Składa się z pierścienia benzenowego skondensowanego z pierścieniem cyklopentenowym . Ta aromatyczna ciecz jest bezbarwna, chociaż próbki często są bladożółte. Głównym zastosowaniem przemysłowym indenu jest produkcja termoplastycznych żywic indenowo- kumaronowych . Podstawione indeny i ich blisko spokrewnione indany pochodne są ważnymi motywami strukturalnymi występującymi w wielu produktach naturalnych i biologicznie aktywnych cząsteczkach, takich jak sulindak .
Izolacja
Inden występuje naturalnie we frakcjach smoły węglowej wrzących w temperaturze około 175–185 ° C. Można go otrzymać przez ogrzewanie tej frakcji z sodem w celu wytrącenia stałego „sodio-indenu”. Ten etap wykorzystuje słabą kwasowość indenu, o czym świadczy jego deprotonowanie przez sód z wytworzeniem pochodnej indenylu. Sodio-inden jest ponownie przekształcany w inden przez destylację z parą wodną .
Reaktywność
Inden łatwo polimeryzuje . Utlenianie indenu kwasowym dichromianem daje kwas homoftalowy ( kwas o -karboksyfenylooctowy). Kondensuje ze szczawianem dietylu w obecności etanolanu sodu , tworząc ester indeno-szczawiowy, oraz z aldehydami lub ketonami w obecności alkaliów , tworząc benzofulweny, które są silnie zabarwione. Traktowanie indenu litoorganicznymi daje związki indenylowe litu :
Indenyl jest ligandem w chemii metaloorganicznej , dając początek wielu kompleksom indenylowym metali przejściowych .
Zobacz też
- ^ Międzynarodowa Unia Chemii Czystej i Stosowanej (2014). Nomenklatura chemii organicznej: zalecenia IUPAC i preferowane nazwy 2013 . Królewskie Towarzystwo Chemii . P. 207. doi : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ a b c d Kieszonkowy przewodnik NIOSH dotyczący zagrożeń chemicznych. "#0340" . Narodowy Instytut Bezpieczeństwa i Higieny Pracy (NIOSH).
- ^ Bordwell FG (1988). „Równowaga kwasowości w roztworze sulfotlenku dimetylu”. Rachunki badań chemicznych . 21 (12): 456–463. doi : 10.1021/ar00156a004 . Tabela pKa Bordwella w DMSO zarchiwizowana 09.10.2008 w Wayback Machine
- Bibliografia _ Qiu, Guanyinsheng (2014). „Generowanie pochodnych indenu przez reakcje tandemowe”. Synlett . 25 (19): 2703–2713. doi : 10.1055/s-0034-1379318 .
- Bibliografia _ Mildenberg, Rolf; Zander, Mechtylda; Hoke, Hartmut; McKillip, William; Freitag, Werner; Imöhl, Wolfgang. „Żywice syntetyczne”. Encyklopedia chemii przemysłowej Ullmanna . Weinheim: Wiley-VCH.
- ^ O'Connor, Józef M.; Casey, Charles P. (1987). „Chemia poślizgu pierścienia kompleksów cyklopentadienylu i indenylu metali przejściowych”. Recenzje chemiczne . 87 (2): 307–318. doi : 10.1021/cr00078a002 .
Linki zewnętrzne
- W. v. Miller, Rohde (1890). „Zur Synthese von Indenderivaten” . Berichte der Deutschen Chemischen Gesellschaft . 23 (2): 1881–1886. doi : 10.1002/cber.18900230227 .
- W. v. Miller, Rohde (1890). „Zur Synthese von Indenderivaten” . Berichte der Deutschen Chemischen Gesellschaft . 23 (2): 1887–1902. doi : 10.1002/cber.18900230228 .
- Finar, Illinois (1985). Chemia organiczna . Longman Naukowo-Techniczny. ISBN 0-582-44257-5 .
