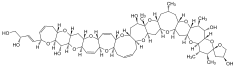
Fikotoksyna
Fikotoksyny (z greckiego phykos , „wodorosty” i toxikon , „toksyna”) to złożone allelopatyczne związki chemiczne wytwarzane przez wtórne szlaki metaboliczne alg eukariotycznych i prokariotycznych . Mówiąc prościej, są to toksyczne chemikalia syntetyzowane przez organizmy fotosyntetyzujące . Te metabolity (w większości przypadków) nie są szkodliwe dla producenta, ale mogą być toksyczne dla jednego lub wielu członków morskiej sieci troficznej . Ta strona koncentruje się na fitotoksynach wytwarzanych przez mikroalgi morskie ; jednakże algi słodkowodne i makroalgi są znanymi producentami fitotoksyn i mogą wykazywać analogiczną dynamikę ekologiczną. W pelagicznej morskiej sieci troficznej fitoplankton jest wypasany przez makro- i mikrozooplankton, a także konkuruje o składniki odżywcze z innymi gatunkami fitoplanktonu. Bakterie morskie próbują uzyskać udział w węglu organicznym, utrzymując symbiotyczne , pasożytnicze , komensalne lub drapieżne interakcje z fitoplanktonem. Inne bakterie rozkładają martwy fitoplankton lub zużywają węgiel organiczny uwolniony w wyniku lizy wirusa . Produkcja toksyn to jedna ze strategii, którą fitoplankton wykorzystuje do radzenia sobie z szeroką gamą drapieżników, konkurentów i pasożytów. Smetacek zasugerował, że „ewolucją planktonu rządzi ochrona, a nie konkurencja . Wiele kształtów planktonu odzwierciedla reakcje obronne na określone systemy ataków”. Rzeczywiście, fitoplankton zachowuje mnóstwo mechanicznych i chemicznych mechanizmów obronnych, w tym ściany komórkowe , kolce, łańcuchy/ kolonie powstawanie i wytwarzanie toksycznych chemikaliów. Te morfologiczne i fizjologiczne zostały przytoczone jako dowód na silną presję drapieżników w środowisku morskim. Jednak o znaczeniu konkurencji świadczy również produkcja fitotoksyn, które negatywnie wpływają na inne gatunki fitoplanktonu. Wiciowce (zwłaszcza wiciowce ) są głównymi producentami fitotoksyn; znane są jednak toksygenne okrzemki , sinice , prymnezjofity i raphidofity . Ponieważ wiele z tych allelochemikaliów jest dużych i kosztownych energetycznie w produkcji, są one syntetyzowane w małych ilościach. Wiadomo jednak, że fitotoksyny gromadzą się w innych organizmach i mogą osiągać wysokie stężenia podczas zakwitów glonów . Dodatkowo, jako biologicznie aktywne metabolity , fitotoksyny mogą już w niskich stężeniach powodować efekty ekologiczne. Efekty te mogą być subtelne, ale mogą potencjalnie wpłynąć na rozkład biogeograficzny fitoplanktonu i dynamikę kwitnienia.
Potencjalne skutki ekologiczne
Efekty przeciw wypasowi
Fikotoksyny mogą zapobiegać wypasowi na kilka sposobów: śmierć, bezpłodność lub odstraszanie. Niektóre dowody na działanie zapobiegające wypasowi:
- Teegarden odkrył, że trzy różne gatunki widłonogów były w stanie odróżnić produkującego saksytoksynę Alexandrium sp. i morfologicznie podobny nietoksyczny Alexandrium sp. środkami chemosensorycznymi . Te trzy różne gatunki widłonogów pasły się głównie na nietoksycznych Alexandrium spp. i unikał producenta saksytoksyny. Jednak wpływ odstraszania saksytoksyny różnił się w zależności od gatunku widłonogów. Oznacza to, że saksytoksyna produkująca Alexandrium sp. mają przewagę nad nietoksycznymi bruzdnicami.
- Miralto i in. odnotowali niski sukces wylęgowy jaj złożonych przez widłonogi, które żywiły się okrzemkami zawierającymi wielonienasycone aldehydy . Po spożyciu przez widłonogi aldehydy te wydają się zatrzymywać rozwój embrionalny. Może to potencjalnie zmniejszyć przyszłą populację widłonogów i sprzyjać przetrwaniu widłonogów, które nie zjadają tak wielu okrzemek.
Działanie przeciwdrobnoustrojowe
Produkcja fitotoksyn może być przydatna do zwalczania pasożytniczych lub glonobójczych bakterii heterotroficznych . Niektóre dowody działania przeciwdrobnoustrojowego:
- Bates i in. był w stanie zwiększyć kwasu domoikowego w seriach Pseudo-nitzschia poprzez ponowne wprowadzenie bakterii. Ponadto wieloseryjne hodowle P., które były całkowicie bezaksenowe (wolne od bakterii), wytwarzają mniej kwasu domoikowego niż wieloseryjne hodowle P., które zawierały bakterie od kilku pokoleń.
- Sieburth odkrył, że kwas akrylowy hamuje mikroflorę jelitową u pingwinów. Wysokie stężenia kwasu akrylowego były spożywane przez pingwiny w diecie eufazydów, która żywiła się Phaeocystis. Działanie przeciwdrobnoustrojowe kwasu akrylowego zostało zweryfikowane przez Slezak i in. który stwierdził, że kwas akrylowy będzie hamował produkcję bakterii w sytuacjach, gdy fitoplankton tworzy agregaty (np. śniegu morskiego lub Phaeocystis). Jednak produkcja kwasu akrylowego może również służyć do trzymania bakterii z dala od fitoplanktonu w bardziej rozcieńczonych stężeniach.
Konkurencyjne efekty
Ponieważ wiele różnych gatunków fitoplanktonu konkuruje o ograniczoną liczbę składników odżywczych (patrz Paradoks planktonu ), możliwe jest, że produkcja fitotoksyn jest wykorzystywana jako metoda zabijania konkurentów lub utrzymywania innego fitoplanktonu z dala od przestrzeni odżywczej producenta. Niektóre dowody efektów konkurencyjnych:
- Graneli wykazał, że Prymnesium spp. będzie wytwarzać fitotoksyny, które zabijają konkurentów przy ograniczeniu azotu lub fosforu.
- Fistarol i in. stwierdzono, że Alexandrium spp. wytwarzają toksyny, które spowalniają tempo wzrostu innego fitoplanktonu i zmieniają skład zbiorowisk .
- Prince i in. wykazali, że wydzieliny chemiczne z bruzdnic Karenia brevis zmniejszały tempo wzrostu i czasami zabijały konkurencyjne gatunki, zmniejszając ich wydajność fotosyntezy i zwiększając przepuszczalność błony .
Lista znanych fitotoksyn i mechanizmów działania
Większość scharakteryzowanych fitotoksyn ma pewien wpływ ekonomiczny lub zdrowotny na ludzi. Inne dobrze zbadane fikotoksyny to potencjalne lub istniejące farmaceutyki lub mają pewne zastosowanie w badaniach komórkowych. Dlatego nasz poziom wiedzy na temat poszczególnych toksyn niekoniecznie odzwierciedla ich znaczenie ekologiczne. Dodatkowo sposób działania i poziom toksyczności są efektami, które zostały udokumentowane na makroorganizmach (zwykle na myszach). Te tryby działania mogą być różne w pelagicznym środowisku morskim. Jednak jest mało prawdopodobne, aby synteza złożonych i kosztownych energetycznie chemikaliów była zachowana w czasie ewolucji, jeśli nie dają one producentowi pewnych korzyści. Nawet jeśli nie znamy jeszcze wpływu wielu toksyn na ich naturalne środowisko, sama ich obecność i imponująca różnorodność wskazują, że służą one jakimś ekologicznym celom.
Wymienione poniżej gatunki fitoplanktonu nie obejmują całego zakresu znanych gatunków toksycznych. Istnieją eksperymentalne dowody na to, że gatunki fitoplanktonu mają hamujący wpływ na pasące się zwierzęta lub inne gatunki fitoplanktonu, ale ich toksyny nie zostały zidentyfikowane.
Tabela wygenerowana na podstawie informacji z Cembella , Shimizu
| Grupa toksyn | Gatunki produkujące toksyny | Klasa | Charakterystyka | Sposób działania | Struktura |
|---|---|---|---|---|---|
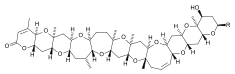
| kwas domoikowy | Pseudo-nitzschia spp. | Bacillariophyceae | Hydrofilowa N-toksyna | Agonista receptora glutaminianu |
|
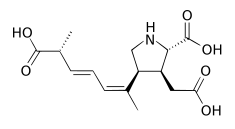
| Saksytoksyny (neosaksytoksyny, gonyautoksyny) | Alexandrium spp., Pyrodinium bahamense , Gymnodinium catenatum | Dinophyceae | Hydrofilowa N-toksyna | kanału Na + (miejsce 1) |
|
| Anabaena spp., Aphanizomenon spp., Cylindrospermopsis spp., Lyngbya spp., Planktothrix spp., Oscillatoria spp. | Cyjanobakteria | ||||
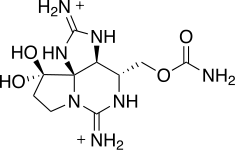
| Ciguatoksyna | Gambierdiscus toxicus | Dinophyceae | Polieterowa rama drabinkowa | Na + (miejsce 5) |
|
| kwas gambierowy | Gambierdiscus toxicus | Dinophyceae | Polieterowa rama drabinkowa | ||
| Maitotoksyny | Gambierdiscus toxicus | Dinophyceae | Polieterowa rama drabinkowa | Efektor kanałowy Ca 2+ |

|
| Osterotoksyna | Ostreopsis lenticularis | Dinophyceae | Polieterowa rama drabinkowa | Nieznany | |
| Cooliatoksyna | Coolia monotis | Dinophyceae | Polieterowa rama drabinkowa | Nieznany | |
| Brewetoksyny | Karenia brevis , K. brevi-sulcata | Dinophyceae | Polieterowa rama drabinkowa | Na + (miejsce 5) |

|
| Chatonella marina , C. antiqua , C. cf. brodawczak | Raphidophyceae | ||||
| Yessotoksyny | Protoceratium reticulatum , Lingulodinium polyedrum | Dinophyceae | Polieterowa rama drabinkowa | Wpływa na cykliczny AMP , cytotoksyczny |

|
| Kwas okadaikowy i dinofisistoksyny | Dinophysis spp., Prorocentrum spp. | Dinophyceae | Liniowy polieter | Inhibitor fosfatazy białkowej |

|
| pektenotoksyna | Dinophysis fortii , D. acuta | Dinophyceae | Makrocykliczny polieter | Nieznany, hepatotoksyczny | |
| Azaspriracydy | Protoperidinium crassipes | Dinophyceae | Liniowy polieter | Nieznany, neurotoksyczny | |
| Gymnodimina | Karenia selliformis | Dinophyceae | makrolid | Nieznany, potencjalnie neurotoksyczny | |
| prymnezyny | Prymnesium parvum | prymnesiophyceae | Liniowy polieter | Nieznany, potencjalny efektor kanałowy Ca 2+ | |
| Spirolid | Alexandrium ostenfeldii | Dinophyceae | Makrocykliczny polieter | Receptor muskarynowy lub inhibitor cholinesterazy | |
| Ostreocyna ( palytoksyna ) | Ostreopsis siamensis | Dinophyceae | Liniowy polieter | Na + /K + ATPazy zakłócacz |

|
| amfidynolid, karibenolid | Amphidinium spp. | Dinophyceae | Makrocykliczny polieter | Cytotoksyczny | |
| Goniodomin | Aleksandrium spp. | Dinophyceae | Makrocykliczny polieter | ||
| prorocentrolid | Prorocentrium Lima | Dinophyceae | Makrocykliczny polieter | ||
| Scytoficyny | Scytonema spp. | Cyjanobakteria | Liniowy polieter | Cytotoksyczny | |
| Tolytoksyna | Tolypothrix conglutinata var. kolorata | Cyjanobakteria | Liniowy polieter | Mikrofilament - środek depolimeryzujący | |
| Debromoaplysiatoksyna | Lyngbya majuscula | Cyjanobakteria | Liniowy polieter | Aktywator kinazy białkowej C |
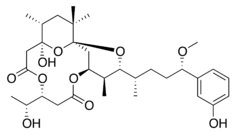
|
| amfidynole, amfiketyd | Amphidinium spp. | Dinophyceae | Poliketydy o otwartym łańcuchu | Przeciwgrzybicze | |
| Majukulamidy, kuracyny | Lyngbya majuscula | Cyjanobakteria | Poliketyd o otwartym łańcuchu | Inhibitor składania mikrotubulin | |
| Bacillariolidy | Multiserie pseudo-nitzschia | Bacillariophyceae | eikozanoid | Inhibitor fosfolipazy A2 | |
| Lyngbyatoksyny | Lyngbya majuscula | Cyjanobakteria | Prenylowana pochodna aminokwasu | Aktywator kinazy białkowej C |
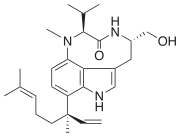
|
| Wielonienasycone aldehydy | Bacillariophyceae | Wielonienasycone aldehydy | Antymitotyczne , apoptoza _ | ||
| Euglenoficyna | Euglena sanguinea | Euglenoidea | Poliketyd | ||
| Karlotoksyna | karlodinium veneficum | Dinophyceae | Poliketyd / Polieter |

|
|
| Karmitoksyna | Armiger Karlodinium | Dinophyceae | Poliketyd / Polieter |
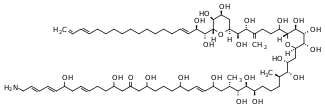
|
Rodzaje toksyn
Wydalone toksyny
Wydalane toksyny mogą pomóc odstraszyć drapieżniki i bakterie, które są przyciągane przez odpady fitoplanktonu. Wiadomo, że fitoplankton wydala metabolity odpadów do otaczającego środowiska. Jest to potencjalne źródło zmniejszonych składników odżywczych i węgla dla bakterii i może działać jako sygnał dla drapieżników, które mogą wykrywać i śledzić gradienty kairomonu w swoim środowisku. Wydalane toksyny wydają się najbardziej korzystne dla pojedynczej komórki pod względem ich zdolności do utrzymywania drapieżników i/lub pasożytów i glonobójców bakterie na odległość. Jednak ciągła produkcja i wydalanie toksyn wiąże się z kosztami metabolicznymi. Aby wydalane toksyny były skuteczne, muszą mieć niską masę cząsteczkową , aby szybko dyfundować w środowisku morskim i być tanie energetycznie w produkcji. Jednak wydalane toksyny mogą w rzeczywistości nie odstraszać większych, ruchliwych drapieżników, ponieważ dyfuzyjność molekularna jest powolna, a turbulencje w skali milimetrowej jest duża w wodzie. Wydalane fitotoksyny mogą działać jako repelenty, jeśli ich sygnał rejestruje się z taką samą prędkością, jak inne sygnały, które potencjalni pasący się mogą wykryć ( kairomony ), zakładając, że drapieżnik napotka oba te sygnały w tym samym czasie. Dodatkowo wydalane toksyny mogą być skuteczną metodą utrzymywania szkodliwych bakterii i innych konkurentów fitoplanktonu poza mikrostrefą składników odżywczych producenta fikotoksyn.
Kontakt z toksynami
Toksyny kontaktowe są skuteczne, jeśli oddziałują na pasożyta lub szkodliwą bakterię natychmiast po kontakcie z producentem fitoplanktonu. Toksyny te znajdują się na powierzchni komórki i są zazwyczaj klasyfikowane jako glikoproteiny , glikolipidy lub polipeptydy . Te toksyny musiałyby być wysoce specyficzne dla ich docelowych receptorów, aby były skuteczne.
Toksyny po spożyciu
Aby tego typu toksyny zaczęły działać, producenci toksyn po spożyciu muszą zostać skonsumowani przez pasącego się. Toksyny po spożyciu, znane również jako toksyny samobójcze, nie są korzystne dla poszczególnych komórek, ponieważ w przeciwieństwie do roślin lądowych fitoplankton nie ma tkanki ofiarnej. Jeśli jednak toksyny wewnętrzne spowodują śmierć, spowolnienie tempa wzrostu, bezpłodność lub odstraszenie drapieżnika, pozostali przedstawiciele społeczności planktonu mogą na tym skorzystać. Obrona zbiorowiska jest najbardziej korzystna w klonalnej , w której występują liczne gatunki toksyczne, na przykład podczas kwitnienia jednogatunkowego fitoplanktonu.
Mechanizmy sygnałowe obrony chemicznej
Tabela zmodyfikowana na podstawie Wolfe (2000)
| Wydalone toksyny | Kontakt z toksynami | Toksyny po spożyciu | |
|---|---|---|---|
| Cząsteczki | Małe cząsteczki, ale zróżnicowane struktury; organiczne i aminokwasy , cukry, krótkołańcuchowe lipidy i pochodne | Glikoproteiny , glikolipidy , polipeptydy | Różne: substancje toksyczne lub toksyny |
| Właściwości toksyn | Rozpuszczalność w wodzie , dyfuzyjność , labilność , toksyczność | Specyficzność, toksyczność | Toksyczność lub stężenie |
| Lokalizacja toksyny | Środowisko wodne | Powierzchnia komórki | Wnętrze komórki |
| Efekt lub sposób działania | Negatywna kineza/taksja : repelent | Zwolnij po zdobyciu: środek odstraszający | Późniejsze zahamowanie żerowania lub toksyczność zmniejszyło strawność lub wydajność wzrostu |
| Poziom korzyści | Osoba lub populacja, w tym konkurenci | Indywidualny | Genetycznie podobna populacja |
Metody wykrywania
Z technicznego punktu widzenia trudno jest zidentyfikować i scharakteryzować metabolit , który jest wytwarzany w niskich stężeniach i wydzielany do płynu zawierającego różnorodne inne metabolity. Allelopatia jest bardzo trudna do zaobserwowania w terenie (z wyjątkiem szkodliwych zakwitów glonów ), ponieważ produkcja fitotoksyn może być indukowana przez różne czynniki środowiskowe i może tworzyć kaskadę zdarzeń biotycznych i fizycznych, które trudno oddzielić od bezpośredniego allelopatycznego wpływu jednego gatunku na inny. Istnieje sześć punktów (podobnych w logice do postulatów Kocha ), które należy ustalić, aby rygorystycznie udowodnić, że jeden gatunek chemicznie hamuje inny w systemie ekologicznym
- należy wykazać wzór hamowania jednego gatunku [...] przez inny
- domniemany agresor [gatunek] musi wytworzyć toksynę
- musi istnieć sposób uwalniania toksyn z [gatunków] do środowiska
- musi istnieć sposób transportu i/lub akumulacji toksyn w środowisku
- dotknięty [gatunek] musi mieć jakieś sposoby pobierania toksyn
- obserwowanego wzorca hamowania nie można wytłumaczyć wyłącznie czynnikami fizycznymi lub innymi czynnikami biotycznymi, zwłaszcza współzawodnictwem i roślinożernością:
- stężenia, które mają wpływ na gatunki docelowe, muszą być realistyczne pod względem środowiskowym, biorąc pod uwagę szybkość transportu i rozprzestrzeniania się w środowisku wodnym
Niewiele (jeśli w ogóle) badań nad toksynami fitoplanktonu podjęło próbę rygorystycznego spełnienia wszystkich tych kryteriów. Wszystkie metody wykrywania fitotoksyn obejmują ekstrakcję potencjalnej toksyny z kultury fitoplanktonu; dlatego ważne jest ustalenie, czy toksyna jest wydzielana do pożywki , czy przechowywana w komórce fitoplanktonu. Ważne jest również, aby wiedzieć, czy organizm docelowy musi być obecny, aby wywołać syntezę toksyn.
Najczęściej obecność fikotoksyny jest weryfikowana przez frakcjonowanie pod kontrolą biologiczną . Próbka musi zostać frakcjonowana lub oddzielona od innych metabolitów i substancji chemicznych w pożywce za pomocą chromatografii . Te różne frakcje można następnie przetestować na gatunkach docelowych, aby określić, która próbka powoduje oczekiwany objaw allelopatyczny. To podejście jest przydatne do szybkiego izolowania allelochemikaliów, których struktura nie jest znana. Jednak testy biologiczne mogą generować fałszywe alarmy . Może się to zdarzyć, jeśli test biologiczny nie jest odpowiednio kontrolowany. Na przykład w mieszanej hodowli okresowej gatunki docelowe mogą umrzeć lub mieć zmniejszone tempo wzrostu z powodu konkurencji o składniki odżywcze, rozpuszczony węgiel nieorganiczny lub pH , które są zbyt niskie dla gatunku docelowego.
Rozwój genomiki , transkryptomiki , proteomiki i metabolomiki dostarcza obecnie ogromnych ilości danych biochemicznych. „ Profilowanie metaboliczne ” pozwala na porównanie próbek biologicznie aktywnych i nieaktywnych oraz identyfikację związków obecnych w niskich stężeniach za pomocą spektrometrii mas . Próbki te można następnie porównać za pomocą analizy głównych składników . Charakterystykę związków obecnych w próbce aktywnej (ale nie w próbce nieaktywnej) można następnie zidentyfikować i scharakteryzować przy użyciu standardowych metod spektroskopii mas. Znakowanie izotopowe można również wykorzystać do identyfikacji szlaków stosowanych w biosyntezie fitotoksyn .
Zobacz też
- Allelopatia
- Adaptacja przeciw drapieżnikom
- Obrony chemiczne
- Ekologia chemiczna
- Zabijanie ryb
- GEOHAB
- Szkodliwe zakwity glonów
- Fitotoksyna
- Plankton
- Obrona roślin przed roślinożercą
- ^ Smetaczek, V (2001). „Wodny wyścig zbrojeń” . Natura . 411 (6839): 745. Bibcode : 2001Natur.411..745S . doi : 10.1038/35081210 . PMID 11459035 .
- Bibliografia _ V. Smetaczek (1996). „Cykle życiowe organizmów, drapieżnictwo i struktura morskich ekosystemów pelaicznych” . Seria postępów w ekologii morskiej . 130 : 277–293. Bibcode : 1996MEPS..130..277V . doi : 10.3354/meps130277 .
- ^ a b c Cembella, AD (2003). „Ekologia chemiczna mikroglonów eukariotycznych w ekosystemach morskich”. Fykologia . 42 (4): 420–447. doi : 10.2216/i0031-8884-42-4-420.1 .
- ^ Teegarden, GJ (1999). „Selekcja wypasu widłonogów i dyskryminacja cząstek na podstawie zawartości toksyn PSP” . Seria postępów w ekologii morskiej . 181 : 163–176. Bibcode : 1999MEPS..181..163T . doi : 10.3354/meps181163 .
- Bibliografia _ i in. (1999). „Podstępny wpływ okrzemek na rozmnażanie widłonogów”. Natura . 402 (6758): 173–176. Bibcode : 1999Natur.402..173M . doi : 10.1038/46023 .
- ^ Bates, SS; DJ Douglas; GJ Doucette; Leger C (1995). „Wzmocnienie produkcji kwasu domoikowego poprzez ponowne wprowadzenie bakterii do kultur aksenowych wieloserii okrzemek Pseudo-nitzschia”. Naturalne toksyny . 3 (6): 428–435. doi : 10.1002/nt.2620030605 . PMID 8612005 .
- Bibliografia _ „Kwas akrylowy, zasada„ antybiotyku ”w Phaeocystis kwitnie w wodach Antarktyki” . nauka . 132 (3428): 676–677. Bibcode : 1960Sci...132..676M . doi : 10.1126/science.132.3428.676 . PMID 14446452 .
- ^ Ślęzak, DM; S Puskarić; GJ Herndl (1994). „Potencjalna rola kwasu akrylowego w zbiorowiskach bakterioplanktonu w morzu” (PDF) . Seria postępów w ekologii morskiej . 105 : 191–197. Bibcode : 1994MEPS..105..191S . doi : 10.3354/meps105191 .
- ^ Graneli, E (2006). „Zabij swoich wrogów i zjedz ich za pomocą swoich toksyn: strategia glonów”. African Journal of Marine Science . 28 (2): 331–336. doi : 10.2989/18142320609504172 .
- Bibliografia _ C Legrand; E Selander; C Hummerta; W Stolte; E Graneli (2004). „Allelopatia u Alexandrium spp.: wpływ na naturalne zbiorowisko planktonu i monokultury glonów” . Ekologia mikroorganizmów wodnych . 35 : 45–56. doi : 10.3354/ame035045 .
- ^ Książę, EK; TL Myers; J Kubanek (2008). „Wpływ szkodliwych zakwitów alg na konkurentów: mechanizmy allelopatyczne dinoflagellata czerwonego przypływu Karenia brevis” . Limnologii i Oceanografii . 53 (2): 531–541. Bibcode : 2008LimOc..53..531P . doi : 10.4319/lo.2008.53.2.0531 .
- Bibliografia _ „Metabolity drobnoustrojów: nowa perspektywa”. Roczny przegląd mikrobiologii . 50 : 431–465. doi : 10.1146/annurev.micro.50.1.431 . PMID 8905087 .
- Bibliografia _ Miejsce, Allen R.; Yoshida, Wesley; Anklin, Klemens; Hamann, Mark T. (2010-03-17). „Struktura i konfiguracja bezwzględna karlotoksyny-2, ichtoksyny z morskiego wiciowca karlodinium veneficum” . Dziennik Amerykańskiego Towarzystwa Chemicznego . Amerykańskie Towarzystwo Chemiczne (ACS). 132 (10): 3277–3279. doi : 10.1021/ja9091853 . ISSN 0002-7863 . PMC 2836391 .
- ^ Rasmussen, Silas Anzelm; Binzer, Sofie Bjørnholt; Hoeck, Casper; Meier, Sebastian; de Medeiros, Livia Soman; Andersen, Nikolaj Gedsted; Miejsce, Allenie; Nielsen, Kristian Fog; Hansen, Per Juel; Larsen, Thomas Ostenfeld (2017-04-05). „Karmitoksyna: zawierająca aminę polihydroksy-polienowa toksyna z Marine Dinoflagellate Karlodinium armiger” . Dziennik produktów naturalnych . Amerykańskie Towarzystwo Chemiczne (ACS). 80 (5): 1287–1293. doi : 10.1021/acs.jnatprod.6b00860 . ISSN 0163-3864 . PMC 6446557 .
- ^ abc Wolfe , GV (2000). „Ekologia obrony chemicznej morskiego planktonu jednokomórkowego: ograniczenia, mechanizmy i skutki”. Biuletyn Biologiczny . 198 (2): 225–244. CiteSeerX 10.1.1.317.7878 . doi : 10.2307/1542526 . JSTOR 1542526 . PMID 10786943 .
- ^ a b Pohnert, G; M Steinke; R Tollrian (2007). „Wskazówki chemiczne, metabolity obronne i kształtowanie międzygatunkowych interakcji pelagicznych”. Trendy w ekologii i ewolucji . 22 (4): 198–204. doi : 10.1016/j.tree.2007.01.005 . PMID 17275948 .
- ^ Willis, RJ (1985). „Historyczne podstawy pojęcia allelopatii”. Dziennik Historii Biologii . 18 (1): 71–102. doi : 10.1007/BF00127958 .
Dalsza lektura
- Ianora, A i in. „Esej syntezy HT Odum Nowe trendy w ekologii chemicznej morza”. Estuaria i wybrzeża 29 (2006): 531–551.
- Ianora, A i in. „Znaczenie ekologii chemicznej morza dla planktonu i funkcji ekosystemu: wschodząca dziedzina”. Narkotyki morskie 9 (2011): 1625–1648.
- Taylor, P i JH Landsberg. „Wpływ szkodliwych zakwitów glonów na organizmy wodne”. Recenzje w Fisheries Science 10 (2010): 113–390.
- Weisburg, MJ. „Płyn dynamiczny kontekst zachowania chemosensorycznego”. Biuletyn biologiczny 198 (2000): 188–202.
- Legrand, C, K Rengefors, GO Fistarol i E Graneli. „Allelopatia fitoplanktonu – aspekty biochemiczne, ekologiczne i ewolucyjne”. Phycologia 42 (2003): 406–419.
Linki zewnętrzne
- ROSEMEB: Rola metabolitów wtórnych w napędzaniu funkcjonalności ekosystemu i utrzymywaniu różnorodności
- The Journal of Chemical Ecology
- Sieć monitorowania fitoplanktonu NOAA (PMN)
- Szkodliwe algi: Instytucja Oceanograficzna Woods Hole
- Toksyczne i szkodliwe zakwity glonów: to, czego nie widać, może cię zranić