Nusinersen
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Spinraza |
| Inne nazwy | IONIS-SMN Rx , ISIS-SMN Rx |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a617010 |
| Dane licencyjne |
|
| Kategoria ciąży |
|
Drogi podania |
Dooponowo |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Biodostępność | 100% (dokanałowo) |
| Wiązanie białek | <25% (w płynie mózgowo-rdzeniowym), >94% (w osoczu) |
| Metabolizm | Hydroliza za pośrednictwem egzonukleazy (3'- i 5'). |
| Okres półtrwania w fazie eliminacji | 135–177 dni (w płynie mózgowo-rdzeniowym ), 63–87 dni (w osoczu ) |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| Bank Leków | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Dane chemiczne i fizyczne | |
| Formuła | C 234 H 323 N 61 Na 17 O 128 P 17 S 17 |
| Masa cząsteczkowa | - 7500,86 g ·mol 1 |
| |
Nusinersen , sprzedawany jako Spinraza , jest lekiem stosowanym w leczeniu rdzeniowego zaniku mięśni (SMA), rzadkiego zaburzenia nerwowo-mięśniowego . W grudniu 2016 roku stał się pierwszym zarejestrowanym lekiem stosowanym w leczeniu tego zaburzenia.
Ponieważ choroba, którą leczy, jest tak rzadka, Nusinersen ma tak zwaną nazwę „ leku sierocego ” w Stanach Zjednoczonych i Unii Europejskiej.
Zastosowania medyczne
Lek stosuje się w leczeniu rdzeniowego zaniku mięśni związanego z mutacją w genie SMN1 . Podaje się go bezpośrednio do ośrodkowego układu nerwowego (OUN) za pomocą wstrzyknięcia dokanałowego .
W badaniach klinicznych lek zatrzymał postęp choroby. U około 60% niemowląt dotkniętych rdzeniowym zanikiem mięśni typu 1 poprawia funkcje motoryczne.
Skutki uboczne
U osób leczonych nusinersenem występowało zwiększone ryzyko infekcji i przekrwienia górnych i dolnych dróg oddechowych, infekcji ucha, zaparć, aspiracji do płuc , ząbkowania i skoliozy . Istnieje ryzyko zahamowania wzrostu niemowląt i dzieci . U starszych uczestników badań klinicznych najczęstszymi zdarzeniami niepożądanymi były ból głowy, ból pleców i inne działania niepożądane wstrzyknięcia do rdzenia kręgowego , takie jak ból głowy po przebiciu opony twardej .
Chociaż nie obserwowano tego u pacjentów biorących udział w badaniu, zmniejszenie liczby płytek krwi oraz ryzyko uszkodzenia nerek są teoretycznym ryzykiem związanym ze stosowaniem leków antysensownych , dlatego podczas leczenia należy monitorować liczbę płytek krwi i czynność nerek.
W 2018 roku pojawiło się kilka przypadków wodogłowia komunikującego u dzieci i dorosłych leczonych nusinersenem; nie jest jasne, czy było to związane z narkotykami.
Farmakologia
Rdzeniowy zanik mięśni jest spowodowany mutacjami powodującymi utratę funkcji w genie SMN1 , który koduje białko SMN (ang. survival motor neuron) . Ludzie przeżywają dzięki niskim ilościom białka SMN wytwarzanego z SMN2 . Nusinersen moduluje alternatywny splicing genu SMN2 , funkcjonalnie przekształcając go w gen SMN1 , zwiększając w ten sposób poziom białka SMN w OUN.
Lek ulega dystrybucji do OUN i tkanek obwodowych.
okres półtrwania wynosi od 135 do 177 dni w płynie mózgowo-rdzeniowym (CSF) i od 63 do 87 dni w osoczu krwi . Lek jest metabolizowany poprzez egzonukleazy (3′- i 5′) i nie wchodzi w interakcje z enzymami CYP450 . Główną drogą eliminacji nusinersenu i jego metabolitów jest prawdopodobnie wydalanie z moczem.
Chemia
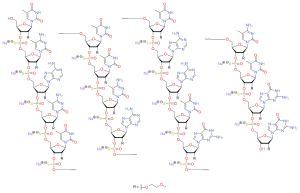
Nusinersen jest antysensownym oligonukleotydem , w którym grupy 2'-hydroksylowe pierścieni rybofuranozylowych są zastąpione grupami 2'- O -2-metoksyetylowymi, a wiązania fosforanowe są zastąpione wiązaniami fosforotionianowymi .
Historia
Nusinersen został opracowany we współpracy między Adrianem Krainerem z Cold Spring Harbor Laboratory i Ionis Pharmaceuticals (dawniej Isis Pharmaceuticals). Wstępne prace nad odkryciem celu nusinersenu wykonał dr Ravindra Singh i współpracownicy z University of Massachusetts Medical School, finansowany przez Cure SMA.
Począwszy od 2012 r. firma Ionis współpracowała z firmą Biogen w zakresie rozwoju, aw 2015 r. firma Biogen nabyła wyłączną licencję na lek za opłatą licencyjną w wysokości 75 mln USD , płatności za kamienie milowe do 150 mln USD , a następnie kolejne poziomy opłat licencyjnych; Biogen pokrył również koszty rozwoju po uzyskaniu licencji. Licencja udzielona firmie Biogen obejmowała licencje na własność intelektualną, którą firma Ionis nabyła od Cold Spring Harbor Laboratory i University of Massachusetts.
W listopadzie 2016 r. wniosek o nowy lek został zaakceptowany w ramach priorytetowego procesu przeglądu FDA na podstawie badania fazy III i niezaspokojonej potrzeby, a także został wówczas przyjęty do przeglądu przez Europejską Agencję Leków (EMA). Został zatwierdzony przez FDA w grudniu 2016 r. i przez EMA w maju 2017 r. jako pierwszy lek do leczenia SMA. Następnie nusinersen został zatwierdzony do leczenia SMA w Kanadzie (lipiec 2017), Japonii (lipiec 2017), Brazylii (sierpień 2017), Szwajcarii (wrzesień 2017) i Chinach (luty 2019).
Społeczeństwo i kultura
Ekonomia
Cena katalogowa Nusinersena w USA wynosi 125 000 USD za wstrzyknięcie, co daje koszt leczenia na poziomie 750 000 USD w pierwszym roku i 375 000 USD rocznie w kolejnych latach. Według The New York Times to stawia nusinersen „wśród najdroższych leków na świecie”.
W październiku 2017 r. władze w Danii zaleciły nusinersen do stosowania tylko u niewielkiej podgrupy osób z SMA typu 1 (małe dzieci) i odmówiły oferowania go jako standardowego leczenia wszystkim innym osobom z SMA, podając „nieracjonalnie wysoką cenę” w porównaniu na korzyść.
Norweskie władze odrzuciły finansowanie w październiku 2017 r., Ponieważ cena leku była „nieetycznie wysoka”. W lutym 2018 roku dofinansowanie zostało zatwierdzone dla osób poniżej 18 roku życia.
W sierpniu 2018 roku National Institute for Health and Care Excellence (NICE), który ocenia opłacalność terapii dla NHS w Anglii i Walii, odradzał oferowanie nusinersenu osobom z SMA. Dzieci z SMA typu 1 były leczone w Wielkiej Brytanii w ramach programu rozszerzonego dostępu finansowanego przez firmę Biogen ; po zapisaniu 80 dzieci program został zamknięty dla nowych osób w listopadzie 2018 r. Jednak w maju 2019 r. NICE zmieniło swoje stanowisko i ogłosiło swoją decyzję o zaleceniu nusinersenu do stosowania w szerokim spektrum SMA przez okres 5 lat.
Irlandzki Zarząd Służby Zdrowia zdecydował w lutym 2019 r., że nusinersen jest zbyt drogi, aby go sfinansować, mówiąc, że koszt wyniósłby około 600 000 EUR na pacjenta w pierwszym roku i około 380 000 EUR rocznie „przy szacowanym wpływie na budżet przekraczającym 20 mln EUR”. w ciągu pięciu lat” dla 25 dzieci z SMA mieszkających w Irlandii. Zarówno producenci, jak i grupy pacjentów zakwestionowały te liczby i zwróciły uwagę, że faktyczne ustalenia cenowe dla Irlandii są zgodne z ceną wynegocjowaną w ramach inicjatywy BeneluxA , której Irlandia jest członkiem od czerwca 2018 r.
Od maja 2019 r. nusinersen był dostępny w publicznej służbie zdrowia w ponad 40 krajach.
W grudniu 2021 r. nusinersen został objęty rozszerzoną ochroną ubezpieczeniową Chin, a cena została obniżona z 697 000 jenów za fiolkę do około 33 000 jenów (~ 5100 USD) za fiolkę.
Dalsza lektura
- Finkel RS, Chiriboga CA, Vajsar J, Day JW, Montes J, De Vivo DC i in. (grudzień 2016). „Leczenie rdzeniowego zaniku mięśni o początku wczesnodziecięcym nusinersenem: otwarte badanie fazy 2 ze zwiększaniem dawki”. Lancet . 388 (10063): 3017–3026. doi : 10.1016/S0140-6736(16)31408-8 . PMID 27939059 . S2CID 40696239 .
Linki zewnętrzne
- „Wytnij i wklej: leczenie rdzeniowego zaniku mięśni za pomocą Nusinersena” . Nauka Youreka . Źródło 2019-05-28 .
- „Dostęp do Spinrazy według kraju” . Leczenie SMA. 18 października 2018 . Źródło 2019-05-28 .