o -Toluidyna

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
2-metyloanilina |
|
| Inne nazwy o -Metyloanilina o -Toluidyna 1-amino-2-metylobenzen 2-aminotoluen, 2-toluamina |
|
| Identyfikatory | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.002.209 |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
| Nieruchomości | |
| C 7 H 9 N | |
| Masa cząsteczkowa | 107,156 g·mol -1 |
| Wygląd | Bezbarwna ciecz |
| Zapach | Zapach aromatyczny, podobny do aniliny |
| Gęstość | 1,004 g/ cm3 |
| Temperatura topnienia | -23,68 ° C (-10,62 ° F; 249,47 K) |
| Temperatura wrzenia | 200 do 202 ° C (392 do 396 ° F; 473 do 475 K) |
| 0,19 g/100 ml w temperaturze 20°C | |
| Ciśnienie pary | 0,307531 mmHg (25 °C) |
|
Współczynnik załamania światła ( n D )
|
1,56987 |
| Lepkość | 4,4335 (20°C) |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
Łatwopalny, średnio toksyczny |
| Oznakowanie GHS : | |
    
|
|
| Niebezpieczeństwo | |
| H301 , H302 , H319 , H331 , H350 , H400 | |
| P201 , P202 , P261 , P264 , P270 , P271 , P273 , P280 , P281 , P301+P310 , P304+P340 , P305+P351+P338 , P308+P313 , P311 , P321 , P330 , P 337 + P313 , P391 , P403 + P233 , P405 , P501 | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | 85 ° C (185 ° F; 358 K) |
| 481,67 ° C (899,01 ° F; 754,82 K) | |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LD 50 ( mediana dawki )
|
900 mg/kg (szczur, doustnie) 323 mg/kg (królik, doustnie) |
| Związki pokrewne | |
|
Związki pokrewne
|
Toluidyna |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
o -toluidyna ( orto -toluidyna ) jest związkiem organicznym o wzorze chemicznym CH 3 C 6 H 4 NH 2 . Jest to najważniejsza z trzech izomerycznych toluidyn . Jest to bezbarwna ciecz, chociaż próbki handlowe są często żółtawe. Jest prekursorem herbicydów metolachlor i acetochlor .
Synteza i reakcje
o -toluidyna jest wytwarzana przemysłowo przez nitrowanie toluenu w celu uzyskania mieszaniny nitrotoluenów , faworyzując izomer orto. Tę mieszaninę oddziela się przez destylację. 2-Nitrotoluen uwodornia się, dając o-toluidynę.
Konwersja o -toluidyny do soli diazoniowej daje dostęp do pochodnych 2-bromo, 2-cyjano- i 2-chlorotoluenu . Wykazano również N-acetylację.
Prilokaina , miejscowy środek znieczulający typu aminoamidu , daje o -toluidynę, gdy jest metabolizowana przez enzymy karboksyloesterazy . Duże dawki prylokainy mogą powodować methemoglobinemię z powodu utleniania hemoglobiny przez o -toluidynę.
Metabolizm
Dystrybucja i wydalanie wchłaniania
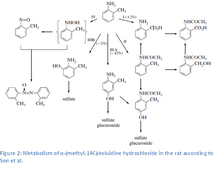
o -Toluidyna jest wchłaniana przez drogi oddechowe i przez skórę. Zaobserwowano intensywne wchłanianie o -toluidyny z przewodu pokarmowego . Główną drogą wydalania jest mocz , w którym do jednej trzeciej podanego związku jest odzyskiwana w postaci niezmienionej. Główne metabolity to 4-amino- m -krezol i w mniejszym stopniu N -acetylo-4-amino- m -krezol, azoksytoluen, o -nitrozotoluen, N -acetylo- o -toluidyna, N -acetylo- o -aminobenzylowy, kwas antranilowy, kwas N -acetylo-antranilowy, 2-amino- m -krezol, p -hydroksy- o -toluidyna. W utworzonych koniugatach przeważały siarczanowe nad koniugatami glukuronidowymi w stosunku 6:1.
Metabolizm o -toluidyny obejmuje wiele konkurencyjnych szlaków aktywujących i dezaktywujących, w tym N - acetylację , N - utlenianie i N - hydroksylację oraz utlenianie pierścienia. 4-hydroksylacja i N -acetylacja toluidyny to główne szlaki metaboliczne u szczurów. Pierwotny metabolizm o -toluidyny zachodzi w retikulum endoplazmatycznym . Ekspozycja na o -toluidyna zwiększa aktywność mikrosomalną hydroksylazy arylowo-węglowodorowej (szczególnie w nerkach), NADPH-cytochromu c reduktazy oraz zawartość cytochromu P-450. W wątrobie zachodzi N -hydroksylacja za pośrednictwem cytochromu P450 do N -hydroksy- o -toluidyny, rakotwórczego metabolitu. N -Hydroksy- o -toluidyna może być metabolizowana do o -nitrozotoluenu lub sprzęgana z kwasem glukuronowym lub siarczanu i transportowane z krwią do pęcherza moczowego. Po dostaniu się do pęcherza moczowego N -hydroksy- o -toluidyna może być uwalniana z koniugatów w kwaśnym środowisku moczu, aby reagować bezpośrednio z DNA lub być aktywowana biologicznie poprzez siarczanowanie lub acetylację przez cytozolowe sulfotransferazy lub N -acetylotransferazy (przypuszczalnie NAT1). Postulowana forma aktywowana (na podstawie porównania z innymi aminami aromatycznymi), N -acetoksy- o -toluidyna, jest reaktywnym estrem , który tworzy elektrofilowe jony arylonitrenowe, które mogą wiązać się z DNA . Inne szlaki aktywacji (szlaki utleniania pierścienia) dla amin aromatycznych obejmują peroksydazę -katalizowane reakcje, które tworzą reaktywne metabolity (chinonoiminy powstające z niesprzężonych metabolitów fenolowych) w pęcherzu moczowym. Te metabolity mogą wytwarzać reaktywne formy tlenu, powodując oksydacyjne uszkodzenie komórek i kompensacyjną proliferację komórek. Wsparcie dla tego mechanizmu pochodzi z badań oksydacyjnego uszkodzenia DNA indukowanego przez metabolity o-toluidyny w hodowlach ludzkich komórek (HL-60), DNA grasicy cielęcej i fragmentach DNA z kluczowych genów, które uważa się za zaangażowane w rakotwórczość (c-Ha-ras onkogen i gen supresorowy guza p53). Wspieraniem tego mechanizmu są również obserwacje o Uszkodzenia DNA wywołane przez -toluidynę (pęknięcia nici) w hodowanych ludzkich komórkach pęcherza moczowego i komórkach pęcherza moczowego szczurów i myszy narażonych in vivo na o -toluidynę.
Wiązanie hemoglobiny
Metabolity o -toluidyny wiążą hemoglobinę u szczurów. Uważa się, że odpowiednim metabolitem jest o -nitrozotoluen. który również powoduje raka pęcherza moczowego u szczurów. Nitrozotoluen przekształca hemoglobinę w methemoglobinę , powodując methemoglobinemię . [ Brak numeru ISBN ] Dowody sugerują, że ta ścieżka jest istotna dla ludzi.
Rakotwórczość
Chociaż mechanizmy rakotwórczości o-toluidyny nie są w pełni poznane, dostępne dowody sugerują, że są one złożone i obejmują kilka kluczowych sposobów działania, w tym aktywację metaboliczną, która powoduje wiązanie reaktywnych metabolitów z DNA i białkami, mutagenność, oksydacyjne uszkodzenie DNA , uszkodzenia chromosomów i cytotoksyczność .
W Stanach Zjednoczonych o -toluidyna została po raz pierwszy wymieniona w trzecim rocznym raporcie na temat czynników rakotwórczych jako „racjonalnie przewidywana jako substancja rakotwórcza dla ludzi” w 1983 r., w oparciu o wystarczające dowody z badań na zwierzętach doświadczalnych. Raport o czynnikach rakotwórczych (RoC) jest Kongres USA , opartym na nauce raporcie dotyczącym zdrowia publicznego, który identyfikuje czynniki, substancje, mieszaniny lub narażenia w środowisku, które stanowią zagrożenie dla mieszkańców Stanów Zjednoczonych. Od tego czasu inne związane z rakiem opublikowano badania i wymieniono o -toluidyna została zmieniona na „znaną jako czynnik rakotwórczy dla ludzi”. o -toluidyna była szczególnie związana z rakiem pęcherza moczowego . Dokonano tego 31 lat później w trzynastym raporcie na temat czynników rakotwórczych (2014). Międzynarodowa Agencja Badań nad Rakiem (IARC) sklasyfikowała o -toluidynę jako „rakotwórczą dla ludzi (grupa 1)”.
Toksykologia
Ujawniono, że główny szlak wydalania przebiega przez mocz, z którego odzyskiwana jest do jednej trzeciej podanego związku w postaci niezmienionej. Wiadomo, że o -toluidyna i jej metabolity wiążą się z hemoglobiną. Udowodniono, że metabolit o -toluidyny, o-nitrozotoluen, powoduje raka pęcherza moczowego u szczurów i uważa się, że wiąże się z hemoglobiną u ludzi. o Ekspozycja na toluidynę była badana na zwierzętach w wielu różnych stopniach.
Pojedyncza ekspozycja
Stwierdzono, że o-toluidyna jest szkodliwa dla szczurów po ostrym narażeniu doustnym przy 900 LD50 wynoszącym i 940 mg/kg masy ciała. Stwierdzono również, że związek ten ma niską toksyczność u królików po ostrym narażeniu skórnym z LD50 wynoszącym 320 mg/kg masy ciała. Toksyczność po inhalacji nie została zidentyfikowana. Objawy po ostrym narażeniu obejmują sinicę (niebieskie lub fioletowe zabarwienie skóry spowodowane niskim nasyceniem tkanek tlenem), podwyższony poziom methemoglobiny oraz umiarkowane podrażnienie skóry i poważne podrażnienie oczu u królików.
Ekspozycja krótkotrwała
Badano jedynie krótkotrwałą ekspozycję doustną o -toluidyny u szczurów. Narażenie przez skórę wpłynęło na cykl jajnikowy , morfostrukturę jajników, zdolność do reprodukcji i potomstwo samic szczurów, gdy podawany był przez cztery miesiące (Malysheva i Zaitseva, 1982). Samce szczurów traktowane podobnie wykazywały stymulowaną spermatogenezę (produkcję plemników) (Malysheva i in., 1983). Narażenie inhalacyjne nie zostało zidentyfikowane. Szczurom podawano związek w dawce 1125 mg/kg masy ciała przez pięć dni (225 mg/kg masy ciała dziennie). Obserwowane objawy obejmowały zwiększone stężenie methemoglobiny, przekrwienie, hemosyderoza (zaburzenie przeciążenia żelazem), hematopoeza (tworzenie składników komórkowych krwi) w śledzionie i 1,5 do 3,0-krotny wzrost masy śledziony.
Przewlekła ekspozycja
Przewlekła doustna ekspozycja na chlorowodorek o -toluidyny spowodowała zwiększoną częstość występowania nowotworów (łagodnych i złośliwych) u szczurów i myszy. W jednym badaniu szczurom podawano dawki około 150 i 300 mg/kg masy ciała (niska dawka i wysoka dawka), obecna była również grupa kontrolna (NCI, 1979; Goodman i in., 1984). Ekspozycja wiązała się z zależnym od dawki zmniejszeniem przyrostu masy ciała, zmniejszeniem przeżywalności oraz zwiększoną częstością występowania wielu typów nowotworów ( mięsaki , naczyniakomięsaki , włókniakomięsaki , kostniakomięsaki , włókniaki) gruczolakowłókniaki i międzybłoniak ) . Zaobserwowano również efekty nienowotworowe. Obejmowały one hiperplazję (nieprawidłowy wzrost objętości tkanki), zwłóknienie (powstawanie nadmiaru włóknistej tkanki łącznej) i martwicę wątroby (przedwczesną śmierć komórek w żywej tkance). Wiele innych badań, w których szczurom lub myszom podawano o -toluidyna przez dłuższy okres czasu dała podobne wyniki, w tym między innymi spadek przeżywalności i zwiększoną częstość występowania różnych typów raka (Hecht i in., 1982; Weisburger i in., 1978; NCI, 1979; Weisburger i in. al., 1978).
Narażenie ludzi
Ostra ekspozycja człowieka na o -toluidynę może powodować bolesny krwiomocz (obecność czerwonych krwinek w moczu) (Goldbarb i Finelli, 1974). Przewlekłą ekspozycję na o -toluidynę u ludzi obserwowano również w wielu retrospektywnych badaniach kohortowych w przemyśle barwników . Wyniki obejmują zwiększoną częstość zgonów i zwiększoną częstość występowania raka pęcherza moczowego . Okazało się jednak, że definitywne powiązanie ich z o -toluidyna w związku z narażeniem na inne spodziewane związki rakotwórcze w przemyśle barwników. W jednym badaniu oceniono zwiększoną częstość występowania śmiertelności i raka pęcherza u 906 pracodawców fabryki barwników w północnych Włoszech w średnim okresie utajonym wynoszącym 25 lat. Śmiertelność z powodu raka pęcherza moczowego była znacznie wyższa u pracodawców niż u osób narażonych tylko na określone chemikalia obecne w fabryce, w trakcie użytkowania lub w sporadycznym kontakcie. o -toluidyna prawie na pewno może powodować raka pęcherza moczowego u mężczyzn.
Inny rejestrator badań spodziewał się i zaobserwował przypadki raka pęcherza moczowego w fabryce gumy w północnej części stanu Nowy Jork (Ward i in., 1991). W badaniu oceniono 1749 pracowników płci męskiej i żeńskiej w okresie 15 lat. Ekspozycja dotyczyła głównie o -toluidyny i aniliny i zaobserwowano znaczny wzrost częstości występowania raka pęcherza moczowego. Jednak rakotwórczości nie można było ostatecznie przypisać o -toluidynie. Inne badania obejmują Vigliani i Barsotti (1961), Chlebnikowa i in. (1970), Zavon i in. (1973), Conso i Pontal (1982) oraz Rubino i in. (1982).
Specyficzne mechanizmy działania rakotwórczego o -toluidyny nie są do końca poznane, ale wiadomo, że są złożone i obejmują aktywację metaboliczną, w wyniku której powstają reaktywne metabolity. Wspomniany wcześniej o -nitrozotoluen, który powoduje raka u szczurów, jest przykładem tych reaktywnych metabolitów. Badania wykazały, że o -toluidyna jest mutagenem i powoduje oksydacyjne uszkodzenia DNA oraz uszkodzenia chromosomów (Skipper et al. 2010). Liczne badania wykazały, że związek ten indukuje oksydacyjne uszkodzenia DNA i pęknięcia nici w hodowlach ludzkich komórek (Watanabe i in. 2010; Ohkuma i in. 1999, Watanabe i in. 2010). Uszkodzenia DNA obserwowano również u szczurów i myszy narażonych in vivo na o -toluidynę (Robbiano i in. 2002, Sekihashi i in. 2002), a nawet uszkodzenia chromosomów na dużą skalę obserwowano w komórkach drożdży i ssaków narażonych na o -toluidyna in vitro. Mówiąc bardziej ogólnie, wiadomo, że niestabilność chromosomalna jest indukowana przez aminy aromatyczne w komórkach pęcherza moczowego. Niestabilność chromosomów może prowadzić zarówno do aneuploidii (obecność nieprawidłowej liczby chromosomów w komórce), którą obserwuje się w komórkach nowotworowych, jak i do utraty heterozygotyczności (utrata całego genu i otaczającego go regionu chromosomalnego), co może skutkować brakiem genu supresorowego guza (Höglund i in. 2001, Sandberg 2002, Phillips i Richardson 2006).
Specyficzne oznaczanie glukozy
o -Toluidyna może być również stosowana do pomiaru stężenia glukozy w surowicy , w postaci kwasu octowego – o -toluidyny. Reakcja o -toluidyny do oznaczania stężenia glukozy w surowicy zyskała ogromną popularność w latach 70. XX wieku. Metoda ta była najczęściej stosowana przez laboratoria kliniczne. Ze względu na potencjalne zagrożenie dla zdrowia laboratoria dysponują obecnie zmodyfikowaną metodą wykorzystującą alternatywne związki.