Patologia stwardnienia rozsianego
Stwardnienie rozsiane (SM) można patologicznie zdefiniować jako obecność rozproszonych blizn glejowych ( stwardnień ) w ośrodkowym układzie nerwowym , które muszą wykazywać rozsiew w czasie (DIT) iw przestrzeni (DIS), aby można je było uznać za zmiany chorobowe związane ze stwardnieniem rozsianym.
Blizny, które nadają nazwę temu schorzeniu, są wytwarzane przez komórki astrocytów próbujące wyleczyć stare zmiany. Te blizny glejowe są pozostałością po wcześniejszych demielinizacyjnych zmianach zapalnych (rozsianego zapalenia mózgu i rdzenia ), które są wytwarzane przez jeden lub więcej nieznanych podstawowych procesów charakterystycznych dla SM.
Oprócz rozsianych zmian, które definiują ten stan, istota biała OUN zwykle wykazuje inne rodzaje uszkodzeń. W tkankach OUN pacjentów ze stwardnieniem rozsianym występuje co najmniej pięć cech: stan zapalny poza klasycznymi uszkodzeniami istoty białej (NAWM, NAGM), dooponowe wytwarzanie Ig z prążkami oligoklonalnymi , środowisko sprzyjające przetrwaniu komórek odpornościowych, skupiska przypominające pęcherzyki w oponach mózgowych (komórki B w większości zakażone EBV ) oraz przerwanie bariery krew-mózg nawet poza aktywnymi zmianami.
Zlewające się zmiany korowe podwzgórzowe są najbardziej specyficznym odkryciem dla stwardnienia rozsianego, występującym wyłącznie u pacjentów z stwardnieniem rozsianym. Chociaż tę cechę można wykryć tylko podczas sekcji zwłok, badane są pewne subrogaty. Uszkodzenia w SM obejmują również obszary z ukrytymi uszkodzeniami (normalnie pojawiające się istoty białe i szare) oraz dwa rodzaje uszkodzeń korowych: utrata neuronów i korowe zmiany demielinizacyjne. Utrata nerwów jest wynikiem zwyrodnienia neuronów ze zmian zlokalizowanych w obszarach istoty białej, a korowe zmiany demielinizacyjne są związane z mózgowo-rdzeniowych .
Wiadomo, że blizny w istocie białej pojawiają się z połączenia mniejszych
Obecnie termin „stwardnienie rozsiane” jest niejednoznaczny i odnosi się nie tylko do obecności blizn, ale także do nieznanego stanu podstawowego, który powoduje te blizny. Poza diagnostyką kliniczną używa się również terminu „stwardnienie rozsiane” w odniesieniu do związanych z nim przebiegów klinicznych. Dlatego, odnosząc się do obecności blizn, lepiej jest użyć równoważnego terminu glejoza włóknista astrocytowa .
Zmiany zgodne ze stwardnieniem rozsianym

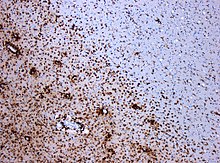
Kombinacja barwienia histologicznego i/lub immunohistochemicznego może być wykorzystana do uwidocznienia pośmiertnych zmian charakterystycznych dla stwardnienia rozsianego i do zdiagnozowania pośmiertnych „zapalnych zmian demielinizacyjnych zgodnych z stwardnieniem rozsianym”:
- hematoksyliną i eozyną (pokazuje morfologię tkanek i komórek)
- mieliny ( Luxol fast blue /kwas nadjodowy-Schiff, Luxol fast blue/hematoksylina/eozyna lub immunohistochemia białek mieliny)
- markery specyficzne dla makrofagów (immunohistochemia dla KiM1P lub CD68 )
- barwienie aksonów ( impregnacja srebrem Bielschowsky'ego lub immunohistochemia białka neurofilamentu )
- barwienie astrocytów (hematoksylina i eozyna lub immunohistochemia kwaśnego białka fibrylarnego gleju ) oraz
- barwienia dla różnych podtypów limfocytów (immunohistochemia dla CD3, CD4, CD8, CD20 i/lub CD138)
Markery te są specyficzne dla różnych procesów, które napędzają tworzenie płytek: zapalenie, rozpad mieliny, astroglioza, uszkodzenie oligodendrocytów, neurodegeneracja, utrata aksonów i remielinizacja. Uszkodzenia SM ewoluują inaczej podczas wczesnej i przewlekłej fazy choroby, aw każdej fazie pojawia się inny rodzaj aktywności.
System klasyfikacji zmian został zaktualizowany w 2017 r. System ten klasyfikuje zmiany SM jako aktywne, mieszane zmiany aktywne/nieaktywne lub nieaktywne w oparciu o obecność i rozmieszczenie makrofagów/mikrogleju. Lokalizują wolno rozszerzające się zmiany wewnątrz podtypu mieszanego i dostarczają opisu różnych typów zmian i wymaganych technik barwienia.
Aby uznać niektóre zmiany chorobowe za przypadek SM, nawet podczas autopsji, muszą one być rozsiane w czasie i przestrzeni. Rozprzestrzenianie się w czasie można wykazać na podstawie etapu ewolucji zmiany. Jeśli obecna jest tylko zmiana, może to być przypadek stwardnienia rozsianego .
Stwardnienie rozsiane jest zwykle definiowane jako obecność rozsianych zmian chorobowych w czasie i przestrzeni bez żadnego innego wyjaśnienia. Dlatego, biorąc pod uwagę niespecyficzność zmian, znaleziono kilka patologicznych stanów leżących u podstaw SM, które są obecnie uważane za odrębne choroby. Istnieją co najmniej trzy rodzaje zmian chorobowych, które historycznie były rozważane w widmie SM, a obecnie są uważane za odrębne jednostki:
Proces demielinizacji
Zmiany chorobowe w SM są heterogenne i istnieją cztery różne wzorce, w których się rozpoczynają, prawdopodobnie z powodu odmiennej podstawowej patogenezy. Niemniej jednak wydaje się, że ostatni etap uszkodzenia jest podobny dla wszystkich. Tradycyjnie uważano, że zmiany stwardnienia rozsianego są wytwarzane przez limfocyty T CD4+, ale po odkryciu anty-MOG i anty-NF zauważono, że większość przypadków CD4+ jest w rzeczywistości anty-MOG, a teraz przypadki CD8+ są uważane za prawdziwe przypadki SM.
W niektórych przypadkach (wzór II), specjalny podzbiór limfocytów , zwany pomocniczymi komórkami T lub „komórkami T CD4+”, odgrywa kluczową rolę w rozwoju zmiany chorobowej w sposób podobny do ataków CD4+, które pojawiają się w anty-MOG zapalenie mózgu i rdzenia .
W standardowych przypadkach czynnikiem wyzwalającym i leżącym u podstaw stwardnienia rozsianego jest rozpuszczalny czynnik wytwarzany przez komórki T CD8+ (lub może komórki B). Również limfocyty B są zaangażowane w patogenezę stwardnienia rozsianego, a niektóre modele teoretyczne wiążą obecność komórek B zakażonych EBV z rozwojem stwardnienia rozsianego. [ potrzebne źródło ]
Uważa się, że pierwszym etapem zmiany SM jest rozwój obszaru zwanego „normalnie wyglądającą istotą białą” (NAWM). W tym obszarze pojawia się aktywowany mikroglej , co pokazuje pozytonowa tomografia emisyjna . Zmiany SM pojawiają się w tych obszarach jako zmiany przedaktywne bez nacieków autoimmunologicznych na tym etapie. Pokazują mikrogleju i degenerację aksonów neuronów bez nacieków komórek T. Oba problemy pojawiają się razem, chociaż nie wiadomo, który z nich jest pierwszy.
Po ataku komórek T następuje przeciek w barierze krew-mózg, gdzie limfocyty T naciekają, powodując znaną demielinizację.
HERV i mikroglej
Ludzkie endogenne retrowirusy (HERV) były zgłaszane w SM od kilku lat. W rzeczywistości, jedna z rodzin, Human Endogenous Retrovirus-W, została po raz pierwszy odkryta podczas badania pacjentów z SM.
Ostatnie badania z 2019 roku wskazują na jeden z wirusów HERV-W (pHEV-W), a konkretnie na jedno z białek kapsydu wirusa, które, jak stwierdzono, „aktywuje mikroglej ” in vitro. Aktywowany mikroglej z kolei powoduje demielinizację. Niektóre interakcje między wirusem Epsteina-Barr a HERV mogą być wyzwalaczem reakcji mikrogleju stwardnienia rozsianego. Wspierając to badanie, przeciwciało monoklonalne przeciwko kapsydowi wirusa (Temelimab) wykazało dobre wyniki w badaniach fazy IIb.
Uszkodzenie ostatniego etapu
Niezależnie od tego, jaki rodzaj wyzwalacza inicjuje uszkodzenie, same aksony i oligodendrocyty. są ostatecznie uszkadzane przez ataki komórek T. Często mózg jest w stanie zrekompensować część tych uszkodzeń dzięki zdolności zwanej neuroplastycznością . Objawy stwardnienia rozsianego rozwijają się jako kumulatywny wynik wielu zmian chorobowych w mózgu i rdzeniu kręgowym . Z tego powodu objawy mogą się znacznie różnić u różnych osób, w zależności od tego, gdzie występują zmiany.
Procesy naprawcze, zwane remielinizacją, również odgrywają ważną rolę w SM. Remielinizacja jest jednym z powodów, dla których, zwłaszcza we wczesnych fazach choroby, objawy mają tendencję do zmniejszania się lub czasowego zanikania. Niemniej jednak uszkodzenie nerwów i nieodwracalna utrata neuronów występują na wczesnym etapie SM.
Oligodendrocyty , które pierwotnie utworzyły osłonkę mielinową, nie mogą całkowicie odbudować zniszczonej osłonki mielinowej. Jednak ośrodkowy układ nerwowy może rekrutować komórki macierzyste oligodendrocytów zdolne do proliferacji, migracji i różnicowania w dojrzałe mielinizujące oligodendrocyty. Nowo utworzone osłonki mielinowe są cieńsze i często nie tak skuteczne jak oryginalne. Powtarzające się ataki prowadzą do coraz mniej skutecznych remielinizacji, aż wokół uszkodzonych aksonów powstanie podobna do blizny blaszka. Te blizny to tak zwane „stwardnienia”, które określają stan. Są nazwane blizny glejowe , ponieważ są one wytwarzane przez komórki glejowe , głównie astrocyty, a ich obecność zapobiega remielinizacji. Dlatego trwają badania mające na celu zapobieganie ich powstawaniu.
W warunkach laboratoryjnych komórki macierzyste są całkiem zdolne do proliferacji i różnicowania się w remielinizujące oligodendrocyty; podejrzewa się zatem, że stany zapalne lub uszkodzenia aksonów w jakiś sposób hamują proliferację i różnicowanie komórek macierzystych w dotkniętych obszarach
Określone obszary uszkodzeń
Nieznany stan podstawowy powoduje zapalenie, demielinizację i atrofię w kilku obszarach. Niektóre z wymienionych tkanek ciała, takie jak siatkówka, nie mają mieliny. W takich przypadkach pojawia się tylko stan zapalny i atrofia.
Dystrybucja uszkodzeń mózgu
- Główny: demielinizacja uszkodzeń OUN

Stwardnienie rozsiane jest uważane za chorobę istoty białej, ponieważ normalnie zmiany chorobowe pojawiają się w tej okolicy, ale niektóre z nich można znaleźć również w istocie szarej.
Używając systemu MRI o wysokim polu, z kilkoma wariantami, kilka obszarów wykazuje zmiany chorobowe i można je przestrzennie sklasyfikować jako obszary podnamiotowe, modzelowate, przykorowe, okołokomorowe i inne obszary istoty białej. Inni autorzy upraszczają to w trzech regionach: wewnątrzkorowym, mieszanym istocie szarej i białej oraz przykorowym. Inni klasyfikują je jako zmiany w hipokampie, kory mózgowej i WM, a jeszcze inni podają siedem obszarów: wewnątrzkorowe, mieszane istoty białej z istotą szarą, przykorowe, głęboko szara, okołokomorowa, głęboka istota biała i uszkodzenia podnamiotowe. Rozmieszczenie zmian można powiązać z ewolucją kliniczną
Sekcja zwłok wykazała, że demielinizacja istoty szarej zachodzi w korze ruchowej , zakręcie obręczy , móżdżku , wzgórzu i rdzeniu kręgowym . Uszkodzenia korowe obserwowano szczególnie u osób z SPMS, ale pojawiają się one również w RRMS i klinicznie izolowanym zespole. Występują częściej u mężczyzn niż u kobiet i mogą częściowo tłumaczyć deficyty poznawcze.
Jeśli chodzi o dwa parametry zmian korowych (CL), ułamkowa anizotropia (FA) jest niższa, a średnia dyfuzyjność (MD) jest wyższa u pacjentów niż u osób kontrolnych. Różnice są większe w SPMS (wtórnie postępujące stwardnienie rozsiane) niż w RRMS (nawracająco-remisyjne stwardnienie rozsiane) i większość z nich pozostaje niezmieniona przez krótkie okresy obserwacji. Nie rozprzestrzeniają się do podkorowej istoty białej i nigdy nie wykazują wzmocnienia gadolinem . W ciągu roku CL mogą zwiększyć swoją liczbę i rozmiar u odpowiedniego odsetka pacjentów z SM, bez rozprzestrzeniania się do podkorowej istoty białej lub wykazywania cech zapalnych podobnych do zmian w istocie białej.
Ze względu na rozmieszczenie zmian, od 1916 roku są one również nazywane palcami Dawsona . Pojawiają się wokół naczyń krwionośnych mózgu.
Uszkodzenie rdzenia kręgowego
Stwierdzono, że stwardnienie rozsiane ma wpływ na rdzeń kręgowy w odcinku szyjnym, nawet bez ataków, a uszkodzenie koreluje z niepełnosprawnością. W RRMS aktywność rdzenia kręgowego w odcinku szyjnym jest zwiększona, aby zrekompensować uszkodzenie innych tkanek. Wykazano, że anizotropia frakcyjna rdzenia kręgowego w odcinku szyjnym jest niższa niż normalnie, co pokazuje, że uszkodzenie jest ukryte przed normalnym MRI.
W rdzeniu szyjnym pacjentów ze stwardnieniem rozsianym występuje postępująca utrata tkanki i uszkodzenie. Te dwa elementy uszkodzenia pępowiny nie są ze sobą powiązane, co sugeruje, że do oszacowania takiego uszkodzenia potrzebne jest wieloparametryczne podejście MRI. Patologia rdzenia stwardnienia rozsianego jest niezależna od zmian w mózgu, rozwija się w różnym tempie w zależności od fenotypu choroby i wiąże się z narastaniem średniookresowej niepełnosprawności.
Rdzeń kręgowy przedstawia zmiany w istocie szarej, które można potwierdzić pośmiertnie i za pomocą obrazowania MR o wysokim polu. Zmiany w istocie szarej rdzenia kręgowego można wykryć na MRI łatwiej niż zmiany GM w mózgu, co czyni rdzeń obiecującym miejscem do badania demielinizacji istoty szarej. Frakcja wody mielinowej (MWF) pokazuje zmiany w MRI
Kilka markerów płynu mózgowo-rdzeniowego ujawnia dokanałowe zapalenie w postępującym SM (SPMS i PPMS)
Móżdżek i wzgórze
Ataksja móżdżkowa występuje głównie w PPMS i jest związana ze zmianami patologicznymi w móżdżku. Niektóre specjalne komórki obecne tylko w móżdżku, komórki Purkinjego , zostały zgłoszone jako część tych problemów. Odnotowano zwiększenie fosforylacji neurofilamentów
Móżdżek jest szczególnie dotknięty w wariantach progresywnych. Uszkodzenie istoty szarej w móżdżku jest związane ze stanem zapalnym w przestrzeni podpajęczynówkowej Chociaż większość uszkodzeń móżdżku występuje w późnych stadiach, można zauważyć, że od wczesnych stadiów choroby występują nieprawidłowości, głównie typu „normalnie wyglądającego”
Zwyrodnienie wzgórza w SM ma kilka cech, takich jak zwyrodnienie transneuronalne lub zwyrodnienie Wallera .
Kora
Około 26% zmian stwardnienia rozsianego pojawia się wewnątrz lub w sąsiedztwie kory mózgowej. Wydaje się, że u pacjentów z RRMS zarówno głęboka, jak i korowa atrofia GM jest związana z patologią w połączonej istocie białej. Zmiany korowe są zapalne (pośredniczone przez układ immunologiczny) i mogą powodować nawroty
Uszkodzenia kory są rozmieszczone wokół głównych żył korowych, a większość wchodzi w obszar istoty białej i zostały podzielone na siedem typów
Niektóre grupy badawcze sugerowały, że zmiany korowe są źródłem obszarów NAWM w istocie białej, a skanery 7 Tesli wydają się potwierdzać tę hipotezę, pokazując, że patologia korowa zaczyna się na powierzchni muszka (zewnętrznej warstwy mózgu), która styka się z płynem mózgowo-rdzeniowym, a później rozciąga się do wewnętrznych warstw mózgu.
Zmiany w korze zostały sklasyfikowane ze względu na obszar, na który wpływają, na cztery grupy: typ I (leukokorowy), typ II (śródkorowy), typ III (podpiórkowy) i typ IV (podpiórkowy rozciągający się na całą szerokość korową, ale nie do podkorowego WM) ). Ta klasyfikacja nie jest związana z klasyfikacją zmian w istocie białej.
Normalnie pojawiająca się kora
Podobnie jak w przypadku istoty białej o prawidłowym wyglądzie (NAWM) i istoty szarej (NAGM), istnieje kora o prawidłowym wyglądzie (NAC), w której nie rozwinęły się żadne zmiany chorobowe, ale ma ona nieprawidłowe właściwości mikroskopowe. NAC wykazuje rozległe utlenianie RNA.
Ostatnio stwierdzono, że normalnie pojawiająca się kora mózgowa wykazuje pierwotne uszkodzenie neurodegeneracyjne w kolcach dendrytycznych neuronów, bez demielinizacji ani nacieków autoimmunologicznych. Dla niektórych autorów stanowi to dowód na to, że stwardnienie rozsiane jest pierwotną chorobą neurodegeneracyjną.
Kora ruchowa
fibrynogen odkłada się w korze ruchowej MS i wiąże się z neurodegeneracją.
Opuszki węchowej
Nerw węchowy, podobnie jak nerw wzrokowy, jest częścią ośrodkowego układu nerwowego. Nerw ten kończy się w opuszce węchowej, która również należy do ośrodkowego układu nerwowego. Obie rozwijają się z zarodka OUN, a niedawno autopsje wykazały, że są one dotknięte tymi samymi chorobami, co reszta OUN. W szczególności ulegają uszkodzeniu podczas przebiegu stwardnienia rozsianego.
W związku z tym płyn mózgowo-rdzeniowy pacjentów z aktywnością choroby wykazuje wysoki poziom „Substancji Ushera w bocznym przewodzie węchowym” (LOTUS)
Uszkodzenie siatkówki i nerwu wzrokowego
Siatkówka oka w SM jest również uszkodzona. Biorąc pod uwagę, że komórki siatkówki nie mają mieliny, uszkodzenie musi różnić się od autoimmunologicznego ataku mózgu. Podstawowy stan siatkówki powoduje czystą neurodegenerację.
Siatkówka i nerw wzrokowy powstają jako wyrostki mózgowe podczas rozwoju embrionalnego, dlatego są uważane za część ośrodkowego układu nerwowego (OUN). Jest to jedyna część OUN, którą można bezinwazyjnie zobrazować w żywym organizmie. Warstwa włókien nerwowych siatkówki (RNFL) jest cieńsza niż normalnie u pacjentów z SM
Procedura, za pomocą której stan leżący u podstaw stwardnienia rozsianego atakuje siatkówkę, jest obecnie nieznana, ale wydaje się, że pośredniczą w niej ludzkie komórki antygenu leukocytów DR-dodatnie z fenotypem mikrogleju .
Pacjenci ze stwardnieniem rozsianym wykazują utratę aksonów w siatkówce i nerwie wzrokowym , co można zmierzyć za pomocą optycznej koherentnej tomografii lub skaningowej polarymetrii laserowej . Miara ta może być wykorzystana do przewidywania aktywności choroby i do ustalenia diagnozy różnicowej z zapaleniem nerwu wzrokowego i szpiku
Jeśli chodzi o przeciwciała w siatkówce, IgG związane z tkanką wykazano na komórkach zwojowych siatkówki w sześciu z siedmiu przypadków stwardnienia rozsianego, ale nie w grupie kontrolnej. Dwa problemy z oczami, Zapalenie błony naczyniowej oka i zapalenie żył siatkówki są objawami stwardnienia rozsianego.
Proponowane procedury neurodegeneracji są wtedy zgłaszane Węższe tętniczki i szersze żyłki. Zauważono również sztywność
Proces zwyrodnieniowy nerwu wzrokowego i siatkówki
Ludzka siatkówka jest pozbawiona mieliny, ale zapalenie jest widoczne w SM nawet w późnych stadiach choroby, wykazując wyraźną gliozę i zapalenie otaczające naczynia wewnętrznej siatkówki.
Niektóre wyniki sugerują obecność zwyrodnienia transsynaptycznego jako czynnika przyczyniającego się do przewlekłego uszkodzenia aksonów w nerwie wzrokowym i siatkówce. Niemniej jednak autorzy pracy nie byli w stanie określić, czy stan zwyrodnieniowy rozprzestrzenia się od przodu, czy od tyłu.
Promieniowanie wzrokowe (OR), które jest zestawem aksonów prowadzących do kory wzrokowej , jest bardziej podobne do reszty mózgu, ponieważ zawiera mielinę. Jest również uszkodzony. Na tym obszarze pojawiają się obszary NAWM (patrz poniżej). Uszkodzenia spowodowane promieniowaniem optycznym składają się z dwóch czynników: zwyrodnienia transsynaptycznego i zwyrodnienia Wallera
Szanując teorię o roli opon mózgowo-rdzeniowych w ewolucji stwardnienia rozsianego, należy zauważyć, że nerw wzrokowy w swojej części wewnątrzoczodołowej ma trzy opony mózgowe i jest ściśle połączony z oponą miękką .
Uszkodzenie neuronów i aksonów
W SM działają dwa różne mechanizmy niszczenia aksonów. Przede wszystkim występuje rozproszona degeneracja aksonów, prawdopodobnie związana z pojawieniem się NAWM. Później pojawia się drugi mechanizm uszkodzenia aksonów, zlokalizowany w starych zmianach demielinizacyjnych, prawdopodobnie wytwarzany przez limfocyty B. To drugie uszkodzenie jest związane ze zmianami T1-Hypointense (czarne dziury MRI), które pojawiają się, gdy zmiana demielinizacyjna nie jest remielinizowana.
Aksony neuronów są prawdopodobnie uszkadzane przez komórki B, chociaż obecnie nie ustalono żadnego związku z nawrotami lub atakami. Wydaje się, że to uszkodzenie jest głównym celem układu odpornościowego, tj. nie wtórnym uszkodzeniem po atakach na mielinę, chociaż zostało to zakwestionowane
magnetycznego rezonansu protonowego wykazała, że nawet na początku stwardnienia rozsianego występuje powszechna utrata neuronów, w dużej mierze niezwiązana ze stanem zapalnym.
Ustalono związek między uszkodzeniem neuronów a stężeniem N-acetylo-asparaginianu , co może prowadzić do nowych metod wczesnej diagnostyki SM za pomocą spektroskopii rezonansu magnetycznego .
Degenerację aksonów w OUN można oszacować na podstawie stosunku N-acetyloasparaginianu do kreatyny (NAA/Cr), oba zmierzone za pomocą spektroskopii protonowego rezonansu magnetycznego.
Opony mózgowe w stwardnieniu rozsianym
Opony to trzy warstwy, które chronią mózg i rdzeń kręgowy. Nazywa się je (od zewnątrz do wewnątrz) oponą twardą , pajęczynówką i oponą miękką . Płyn mózgowo-rdzeniowy przepływa między drugim a trzecim. Niezwykłym odkryciem w przypadku stwardnienia rozsianego jest to, że w oponach mózgowych ( złożonych z komórek B, głównie zakażonych EBV ) pojawiają się skupiska podobne do pęcherzyków. Agregaty te rosną podczas procesu chorobowego i występują głównie u pacjentów z wtórnie postępującą chorobą.
Stwierdzono, że zapalenie opon mózgowo-rdzeniowych jest związane z demielinizacją istoty szarej (kory mózgowej). Poza tym demielinizacja podnabłonkowa sugeruje problem w płynie mózgowo-rdzeniowym lub w oponie miękkiej, który powinien chronić korę mózgową
Niezależnie od przyczyny SM, niektóre uszkodzenia są wywoływane przez nieznany czynnik rozpuszczalny w płynie mózgowo-rdzeniowym, który jest wytwarzany w obszarach opon mózgowo-rdzeniowych i przenika do miąższu kory mózgowej. Niszczy mielinę bezpośrednio lub pośrednio poprzez aktywację mikrogleju.
Naciek do opon mózgowo-rdzeniowych, który określa się jako trzeciorzędowe tkanki limfatyczne (TLT), przygotowuje naciek do miąższu OUN, powodując demielinizację w obszarach podpiąłkowych i korowych. Modele zwierzęce sugerują, że naciekające komórki Th17 przebudowują zrębu opon mózgowych (nieodporne) i inicjują tworzenie TLT podczas EAE. Przebudowane komórki zrębowe zatrzymują i promują produkcję Th17 i akumulację komórek B. Współpraca między LTB na komórkach Th17 i LTBR (receptor Lymfotoksyny beta) na radioodpornych komórkach opon mózgowo-rdzeniowych jest bardzo istotna dla indukcji i progresji stwardnienia rozsianego.
Oponowe trzeciorzędowe struktury przypominające limfoidy
pęcherzykopodobne w oponach mózgowych tworzą się tylko we wtórnie postępującym SM. i korelują ze stopniem demielinizacji kory podwzgórzowej i atrofii mózgu, co sugeruje, że mogą przyczyniać się do patologii korowej w SPMS
Te ektopowe pęcherzyki limfoidalne składają się głównie z komórek B zakażonych EBV .
Zajęcie obwodowego układu nerwowego
Chociaż stwardnienie rozsiane jest definiowane jako stan OUN, niektóre doniesienia łączą problemy w obwodowym układzie nerwowym z obecnością blaszek stwardnienia rozsianego w OUN. Obecnie nową jednostkę chorobową, połączoną demielinizację ośrodkowego i obwodowego, zdefiniowano jako jednoczesną demielinizację obwodowego i ośrodkowego układu nerwowego.
Struktura i ewolucja zmian
Uszkodzenia SM polegają głównie na demielinizacji i bliznowaceniu tłuszczowych osłonek mielinowych wokół aksonów mózgu i rdzenia kręgowego.
Zmiany ewoluują z normalnie wyglądającej istoty białej. W MTR-MRI pozorny współczynnik dyfuzji (ADCav) jest miarą ruchu cząsteczek wody. Można zauważyć, że przed rozpadem BBB współczynnik ten wzrasta, aż w pewnym momencie bariera krew-mózg zostaje przerwana i komórki odpornościowe wnikają do mózgu powodując uszkodzenie.
Według najnowszych (2009) badań, aktywna zmiana składa się z różnych warstw:
- NAWM graniczy ze zmianą : Obszary te zawierały aktywowany mikroglej , przeciwciała wiążące się z astrocytami , aksonami, oligodendrocytami i komórkami dendrytycznymi wzdłuż naczyń krwionośnych. Brak komórek T lub B.
- Warstwa zewnętrzna zmiany: Zmniejsza się liczba ciał komórek oligodendrocytów. Pozostałe oligodendrocyty są czasami spuchnięte lub obumierające. Osłonki mielinowe są nadal nienaruszone, ale spuchnięte. Niewielki wzrost mikrogleju i limfocytów T.
- Warstwa aktywna: fagocytarne obszary demielinizacyjne: szczątki mieliny pobrane przez lokalny mikroglej i fagocyty dostające się z krwioobiegu. Więcej limfocytów T w tych obszarach oraz w przestrzeni sąsiadującej z naczyniami krwionośnymi.
- Niedawno zdemielinizowana tkanka: Tkanki były pełne fagocytów zawierających mielinę. Oznaki wczesnej remielinizacji wraz z niewielką liczbą oligodendrocytów. Duża liczba komórek T, komórek B i innych komórek odpornościowych skupiona wokół naczyń krwionośnych.
- Warstwa nieaktywna: ponownie aktywowany mikroglej i komórki dendrytyczne znaleziono również wokół naczyń krwionośnych.
Niektóre zmiany nazywane „powoli erodującymi zmianami” lub „powoli rozszerzającymi się” charakteryzują się fagocytozą mieliny na krawędzi zmiany i ewoluują, rozszerzając się w istocie białej.
Zmiany pod MRI
Większość uszkodzeń stwardnienia rozsianego jest izointensywna w stosunku do istoty białej (wydają się jasne) na MRI ważonym T1, ale niektóre są „hipointensywne” (niższa intensywność). Nazywa się je „czarnymi dziurami” (BH). Pojawiają się szczególnie w nadnamiotowym obszarze mózgu.
Kiedy pojawiają się BH, około połowa z nich powraca w ciągu miesiąca. Jest to uważane za oznakę remielinizacji. Kiedy pozostają, jest to uważane za oznakę trwałej demielinizacji i utraty aksonów. Zostało to wykazane podczas sekcji zwłok.
Małe zmiany są niewidoczne w MRI. Dlatego klinicznie wspomagane kryteria diagnostyczne są nadal wymagane dla dokładniejszej diagnozy stwardnienia rozsianego niż sam MRI.
Doniesiono, że ewolucja zmiany w badaniu MRI rozpoczyna się jako wzorzec centralnej hiperintensywności . Obserwowano to w większości nowych zmian, zarówno na obrazach z gęstością protonów, jak i obrazach T1-zależnych ze wzmocnieniem kontrastowym. Gdy stosuje się gadolin, ekspansję zmiany można sklasyfikować jako guzowatą lub pierścieniową
Niezależnie od procesu demielinizacji, obecnie możliwe jest wykrycie zmian chorobowych przed demielinizacją, które wykazują skupiska aktywowanego mikrogleju i nacieki leukocytów wraz z nieprawidłowościami oligodendrocytów. Niektóre grupy badawcze uważają niektóre obszary NAWM z skupiskami guzków mikrogleju za „preaktywne zmiany SM”. ale ich znaczenie jest kwestionowane.
Ewolucję zmian można śledzić za pomocą MRI
Uszkodzenia przed zakłóceniem BBB
Specjalne metody MRI
- Główny Rezonans magnetyczny
Klasyczne metody rezonansu magnetycznego noszą nazwy T1-relaksacja i T2-relaksacja . Tworzą obrazy w oparciu o „czas relaksacji”, tj. czas potrzebny cząsteczce na wyrównanie swojego pola magnetycznego z otoczeniem po wytrąceniu jej z równowagi przez impuls elektromagnetyczny.
Trzeci typ MRI opiera się na dyfuzyjności wody. Nazywa się to „MRI dyfuzji” lub „MRI tensora dyfuzji”. a wytworzone obrazy są zwykle nazywane obrazami tensora dyfuzji (DTI). Modyfikacja post-processingu obrazu polega na uwzględnieniu gęstości wody w każdym obszarze. Są to tak zwane „obrazy ważone dyfuzją” (DWI) lub MRI tensora dyfuzji, DT-MRI. Dyfuzja mierzy reakcję wody, a struktura tensorowa uwzględnia orientację włókien tkanki. Jest to ważne, ponieważ NAWM i NAGM wykazują nieprawidłowy wynik DT-MRI
Czwartą ważną techniką MRI jest technika transferu magnetyzacji, MT-MRI. Mierzy różnice we współczynniku przenoszenia magnetyzacji (MTR). Pomysł polega na tym, że jądro dowolnego atomu, który ma wypadkowy spin jądrowy i który jest związany z atomem wodoru, mogłoby potencjalnie zostać zobrazowane za pomocą „MRI z transferem magnetyzacji heterojądrowej”. To zobrazowałoby jądro wodoru o wysokim współczynniku żyromagnetycznym zamiast jądra o niskim współczynniku żyromagnetycznym, które jest związane z atomem wodoru. Zasadniczo rezonans magnetyczny z transferem magnetyzacji heterojądrowej można wykorzystać do wykrywania obecności lub braku określonych wiązań chemicznych. NAWM i rozproszone obszary nieprawidłowe (DAWM) pojawiają się pod MT-MRI.
Wreszcie, piątą ważniejszą techniką MRI jest spektroskopia magnetycznego rezonansu protonowego . W oparciu o różne reakcje na impulsy elektromagnetyczne, które prezentują różne substancje, skaner MRS jest w stanie zidentyfikować substancje chemiczne w mózgu. Jest to ważne, ponieważ N-acetyloasparaginian jest markerem uszkodzenia aksonów, który można teraz zidentyfikować in vivo.
Zmiany chorobowe pod specjalnymi metodami MRI
Zwykle na normalnym MRI pojawiają się dwa różne rodzaje zmian: zmiany nadciśnieniowe T2 i hipotensja T1. Pierwszym z nich są zmiany demielinizacyjne, które w T2-MRI wydają się jaśniejsze od otoczenia.
Hipointensywność T1 to obszary mniej gęste niż otaczające NAW i wydają się czarne na T1-MRI. Są to głównie obszary degeneracji aksonów. Ze względu na swój czarny wygląd są czasami nazywane czarnymi dziurami. Wydają się pojawiać jako kontynuacja po silnym uszkodzeniu demielinizacyjnym.
Zakłócenie BBB jest zwykle pokazywane przy użyciu gadolinu . Jest to kontrast, który nie może przekroczyć BBB, chyba że jest dysfunkcyjny. Dlatego w aktywnych zmianach z implikacją BBB kontrast dostaje się do mózgu i pojawia się w MRI.
Przed przerwaniem BBB, niektóre tkanki mózgowe, które wykazują normalny wygląd w T1 i T2 MRI (normalnie wyglądająca istota biała , NAWM i normalnie pojawiająca się istota szara , NAGM), mogą wykazywać kilka nieprawidłowości w specjalnych technologiach MRI:
Przeniesienie magnetyzacji Relaksacja wieloechowa T(2) . Osoby ze zmianami Long-T(2) miały znacznie dłuższy czas trwania choroby niż osoby bez tego podtypu zmiany. Stwierdzono, że uszkodzenie istoty szarej koreluje z niepełnosprawnością oraz że w zmianach, nawet starych, występuje wysoki stres oksydacyjny.
MRI tensora dyfuzji lub MRI z transferem magnetycznym to dwie opcje poprawy wykrywania nieprawidłowości ukrytych w MRI. Jest to obecnie aktywny obszar badań bez ostatecznych wyników, ale wydaje się, że te dwie technologie są komplementarne.
Inne metody MRI pozwalają na lepszy wgląd w strukturę zmian. Ostatnio MRI MP-RAGE wykazało lepsze wyniki niż PSIR i DIR w przypadku zmian istoty szarej. Obrazowanie ważone podatnością (SWI-MRI) wykazało odkładanie się żelaza ( hemosyderyny ) w zmianach chorobowych i pomaga wykryć zmiany niewidoczne w inny sposób.
Nieprawidłowości w istocie szarej (zmiany tensora dyfuzji MRI) miąższu mózgu są obecne na wczesnym etapie stwardnienia rozsianego
Normalnie pojawiające się tkanki mózgowe
Korzystając z kilku technologii analizy tekstury, można podzielić obszary istoty białej na trzy kategorie: normalne, wyglądające normalnie i zmiany chorobowe. Obecnie możliwe jest wykrycie zmian jeszcze przed wystąpieniem demielinizacji i nazywane są one zmianami przedaktywnymi. Zaproponowano czwarty obszar zwany DAWM (rozproszona nienormalna istota biała), który może pomóc w rozróżnieniu PPMS i SPMS. Znaleziono obfitą mielinę pozakomórkową w oponach mózgowych pacjentów ze stwardnieniem rozsianym
Tkanki mózgowe z problemami ukrytymi w MRI są zwykle nazywane normalnie wyglądającymi. Badanie normalnie wyglądającego ciała modzelowatego wykazało możliwą pierwotną hipoperfuzję , zgodnie z innymi odkryciami w tym samym kierunku. Odnotowano również gromadzenie się żelaza (w złogach hemosyderyny oraz w strukturach podobnych do ferrytyny wewnątrz makrofaga)
Pokazano kilka odkryć w tych obszarach. Badania pośmiertne nad obszarami NAWM i NAGM (normalnie wyglądające białe i szare substancje) wykazują kilka zmian biochemicznych, takich jak zwiększona karbonylacja białek i wysoki poziom kwaśnego białka fibrylarnego gleju (GFAP), które w obszarach NAGM łączy się z wyższym niż normalnie stężeniem karbonylki białkowe , co sugeruje obniżony poziom przeciwutleniaczy i obecność małych uszkodzeń. Ilość interneuronalnej parwalbuminy jest niższy niż normalnie w obszarach kory ruchowej mózgu, a uszkodzenie oksydacyjne oligodendrocytów i neuronów może być związane z aktywną demielinizacją i uszkodzeniem aksonów.
Opisano, że NAWM w SM jest podobny do NAWM w leukoarajozie , chociaż uszkodzenie NAWM w SM ma charakter zapalny, a specjalne techniki mikroskopowe, takie jak mikroskopia CARS, pokazują, że OUN pacjentów z SM może być globalnie zmieniony, a zarówno zmiany chorobowe, jak i NAWM są tylko przejawami innego Zasadniczy problem. NAWM jest szczególnie nieprawidłowy w pobliżu komór, co może wskazywać na mechanizm patogenny, w którym pośredniczy płyn mózgowo-rdzeniowy lub wyściółka.
Nieuszkodzona istota biała
Większość mózgu w SM pozostaje nienaruszona. Chociaż oczywiście normalna istota biała wydaje się normalna w MRI, tak samo jest z istotą białą NAWM opisaną w następnej sekcji. Aby ustalić różnicę, normalną istotę białą nazywa się istotą białą bez zmian chorobowych (NLWM)
Podaje się, że ta normalna istota biała stanowi około 56% całkowitej WM pacjentów.
Normalnie pojawiająca się istota biała
Istota biała z ukrytymi, ale widocznymi w MRI uszkodzeniami jest znana jako „normalnie wyglądająca istota biała” (NAWM) i jest miejscem, w którym pojawiają się zmiany. NAWM jest uważany za niewidoczny rodzaj zmiany, powoduje niepełnosprawność i reaguje na natalizumab
Patologia NAWM różni się od obszarów w pobliżu uszkodzeń lub w pobliżu kory. Zmiany blisko WM, patologia aksonalna i aktywacja mikrogleju mogą wyjaśniać subtelne zmiany MRI. Z dala od zmian, aktywacja mikrogleju związana z bliskością zmian korowych może leżeć u podstaw nieprawidłowości MRI.
NAWM poprzedza zmiany. Wykazano, że pozorny współczynnik dyfuzji (ADC) poprzedza rozwój nowych blaszek. Później wzrasta podczas rozpadu BBB (wzmocnienie gadolinowe) i ostatecznie zanika po wzmocnieniu.
Zakłócenia BBB mają miejsce na obszarach NAWM. Można to odczytywać na różne sposoby. Być może jakieś ukryte zmiany w strukturze Białej Materii powodują zakłócenie BBB, a może ten sam proces, który tworzy obszary NAWM, po pewnym czasie zaburza BBB.
Zmiany przedaktywne to zmiany we wczesnym stadium rozwoju. Czasami ustępują bez dalszych uszkodzeń i nie zawsze przekształcają się w zmiany demielinizacyjne. Przedstawiają skupiska aktywowanego mikrogleju w normalnie wyglądającej istocie białej.
Wydaje się, że kluczowe znaczenie mają nieprawidłowości oligodendrocytów . Najwcześniejszą odnotowaną zmianą w badanych zmianach jest powszechna apoptoza oligodendrocytów, w której limfocyty T, makrofagi, aktywowany mikroglej, reaktywne astrocyty i neurony wydają się normalne. Ta obserwacja wskazuje na pewne zmiany w środowisku lokalnym (NAWM), na które oligodendrocyty są szczególnie podatne i które wyzwala pewną formę apoptozy.
Dyfuzyjność wody jest wyższa we wszystkich regionach NAWM, głębokich obszarach istoty szarej i niektórych korowych obszarach istoty szarej pacjentów z SM niż u normalnych kontroli.
Cytrulinacja pojawia się w SPMS. Wydaje się, że defekt sfingolipidów modyfikuje właściwości istoty białej o prawidłowym wyglądzie. W związku z tym, deiminaza peptydyloargininy 2 jest zwiększona u pacjentów ze stwardnieniem rozsianym i jest związana z deiminacją argininy .
NAWM wykazuje zmniejszoną perfuzję , która nie wydaje się być wtórna do utraty aksonów. Zmniejszona perfuzja NAWM w SM może być spowodowana rozległą astrocytów , prawdopodobnie związaną z niedoborem astrocytarnych receptorów beta(2)-adrenergicznych i zmniejszoną produkcją cAMP , co skutkuje zmniejszonym wychwytem K(+) w węzłach Ranviera i zmniejszonym uwalnianiem K(+) w przestrzeniach okołonaczyniowych. Byłoby to ponownie zgodne z przypadkami przewlekłej mózgowo-rdzeniowej niewydolności żylnej .
Zmiany w istocie białej pojawiają się w obszarach NAWM, a ich zachowanie można przewidzieć za pomocą parametrów MRI jako MTR (współczynnik przenoszenia magnetyzacji). Ten parametr MTR jest związany z gęstością aksonów.
Wydaje się również, że zasadowe białko mieliny (MBP) pacjentów ze stwardnieniem rozsianym (MS) zawiera niższe poziomy fosforylacji w Thr97 niż osoby zdrowe.
NAWM to miejsce, w którym pojawiają się zmiany, a proces ten wydaje się być dokonywany przez mikroglej, przy braku nacieku leukocytów, astrogliozy lub demielinizacji. W końcowej fazie procesu te mikrogleje rozwijają się w aktywną demielinizacyjną zmianę stwardnienia rozsianego
W PPMS istnieją dowody na to, że na NAWM wpływają te same procesy patologiczne, które charakteryzują zmiany WM, a mianowicie zapalenie, demielinizacja, uszkodzenie aksonów, naciek makrofagów i glejoza. Niektóre dowody sugerują, że zmiany WM przewidują kolejne nieprawidłowości GM, a nie odwrotnie. Anomalie w NAWM zamiast uszkodzeń mają większy wpływ na późniejsze uszkodzenia GM.
Uszkodzenie istoty szarej. Normalnie pojawiająca się istota szara
Uszkodzenie tkanki istoty szarej dominuje w procesie patologicznym w miarę postępu stwardnienia rozsianego i leży u podstaw niepełnosprawności neurologicznej. Obrazowe korelaty zaniku istoty szarej wskazują, że mechanizmy różnią się w RRMS i SPMS. Wirus Epstein-Barr może być zaangażowany, ale jest to mało prawdopodobne. Zaangażowanie głębokiej istoty szarej (DGM), sugerowane przez obrazowanie metodą rezonansu magnetycznego, zostało potwierdzone, a większość zmian DGM obejmuje zarówno GM, jak i istotę białą. Zapalenie w zmianach DGM jest pośrednie między destrukcyjnym zapaleniem zmian w istocie białej a minimalnym zapaleniem zmian korowych.
Depozyty żelaza pojawiają się w głębokiej istocie szarej na podstawie korelacji pola magnetycznego MRI W odróżnieniu od NAWM, obszary NAGM nie są związane z rozwojem zmian chorobowych
Rozproszona nieprawidłowa istota biała
Innym aktywnym obszarem badań jest rozproszona nienormalna istota biała (DAWM). Wydaje się, że jest to redukcja fosfolipidów mieliny, która koreluje z redukcją frakcji wodnej mieliny. DAWM składał się z rozległej utraty aksonów, zmniejszonej gęstości mieliny i przewlekłej gliozy włóknistej, z których wszystkie były zasadniczo nieprawidłowe w porównaniu z normalnie wyglądającą WM i znacząco różniły się od ogniskowej patologii uszkodzenia WM. Zmiany w układzie naczyniowym zachodzą nie tylko w zmianach ogniskowych, ale także w DAWM, co wykryto w pośmiertnym rezonansie magnetycznym
Pojawiająca się brudna istota biała
Brudnie wyglądająca istota biała (określana jako DAWM, podobnie jak w poprzednim przypadku) jest zdefiniowana jako region o słabo zdefiniowanych granicach pośredniej intensywności sygnału między istotą białą o wyglądzie normalnym (NAWM) a blaszką miażdżycową na T2-zależnych i protonowych obrazowanie gęstości. Jest prawdopodobnie tworzony przez utratę fosfolipidów mieliny, wykrywaną przez krótką składową T2 i redukcję aksonów.
Guzki mikrogleju
Pierwotnie proponowany jako biomarker, obecność tych guzków ma możliwe znaczenie patogenetyczne. Chociaż ich rola w ewolucji zmian chorobowych jest nadal niejasna, sugeruje się, że ich obecność w normalnie wyglądającej istocie białej jest wczesnym etapem powstawania zmian chorobowych
Heterogeniczność choroby
Donoszono, że stwardnienie rozsiane jest heterogenne w swoim zachowaniu, w swoich podstawowych mechanizmach, w swojej odpowiedzi na leki i, co niezwykłe, również szanuje odpowiedź na specyficzne autoprzeciwciało kanału potasowego Kir4.1 .
Dla niektórych autorów to, co nazywamy stwardnieniem rozsianym, w rzeczywistości jest heterogenną grupą chorób Niektóre niezależne raporty rozróżniają również PPMS Inne wskazują na związek między niektórymi przypadkami SM a neuropatiami obwodowymi
Niektóre doniesienia sugerują istnienie biomarkerów molekularnych, które określają przebieg kliniczny choroby, ale związek z typami patologicznymi nadal nie został ustalony od 2016 r.
Wzory demielinizacji
W tkankach mózgowych pacjentów zidentyfikowano cztery różne wzorce uszkodzeń. Pierwotny raport sugeruje, że może istnieć kilka typów stwardnienia rozsianego o różnych przyczynach immunologicznych i że stwardnienie rozsiane może być rodziną kilku chorób. Chociaż pierwotnie do sklasyfikowania zmian u pacjenta wymagana była biopsja, od 2012 roku można je klasyfikować na podstawie badania krwi w poszukiwaniu przeciwciał przeciwko siedmiu lipidom, z których trzy to pochodne cholesterolu.
Uważa się, że mogą one korelować z różnicami w typie choroby i rokowaniu, a być może z różnymi reakcjami na leczenie. W każdym razie zrozumienie wzorców zmian chorobowych może dostarczyć informacji o różnicach w przebiegu choroby między poszczególnymi osobami i umożliwić lekarzom podejmowanie dokładniejszych decyzji dotyczących leczenia
Wzory I i II przedstawiają klasyczne cechy patologiczne zmian SM z mikroglejem i makrofagami, podczas gdy wzorce III i IV są uważane za nietypowe i mogą być w pewnym momencie oddzielone od widma MS.
Cztery zidentyfikowane wzorce to:
- Wzór I
- Blizna przedstawia komórki T i makrofagi wokół naczyń krwionośnych, z zachowanymi oligodendrocytami , ale bez oznak aktywacji układu dopełniacza .
- Wzór II
- Blizna przedstawia komórki T i makrofagi wokół naczyń krwionośnych, z zachowaniem oligodendrocytów, jak poprzednio, ale można również znaleźć oznaki aktywacji układu dopełniacza . Ten wzorzec został uznany za podobny do uszkodzenia obserwowanego w NMO, chociaż uszkodzenie AQP4 nie pojawia się w zmianach MS typu II. plazmafereza , która wskazuje na coś patogennego w surowicy krwi.
- Naciek układu dopełniacza w tych przypadkach przekształca ten wzorzec w kandydata do badań nad połączeniami autoimmunologicznymi, takimi jak stwardnienie rozsiane za pośrednictwem anty- Kir4.1 , anty- Anoctamina-2 lub anty-MOG . O ostatniej możliwości, badania wykazały przeciwciała antyMOG w pewnym wzorze- Pacjenci ze stwardnieniem rozsianym II.
- Czasami autoimmunizacja przeciwko ludzkiemu ośrodkowemu układowi nerwowemu została wywołana przez przypadek lub błąd medyczny. Reakcje były różne w zależności od źródła choroby, ale wśród nich jest potwierdzone patologicznie stwardnienie rozsiane (uszkodzenie spełnia wszystkie patologiczne kryteria stwardnienia rozsianego) i pokazuje wzór II Wzór II patogenne limfocyty T namnożone klonalnie
- znaleziono w CN, w szczególności CD4+ Limfocyty Th2 (wydzielające IL-4, L-5 i IL-13) zostały niedawno opisane we wzorze II MS, a ich klony zostały wyizolowane jako żywe komórki. Charakterystyka funkcjonalna pokazuje, że limfocyty T uwalniają cytokiny Th2 i pomagają limfocytom B dominować naciek limfocytów T w uszkodzeniach mózgu typu II.
- Wzór III
- Blizny są rozproszone z zapaleniem, dystalną oligodendrogliopatią i aktywacją mikrogleju . Występuje również utrata glikoproteiny związanej z mieliną (MAG). Blizny nie otaczają naczyń krwionośnych, a wokół naczyń pojawia się obwódka zachowanej mieliny. Istnieją dowody na częściową remielinizację i apoptozę oligodendrocytów. Dla niektórych badaczy ten wzorzec jest wczesnym etapem ewolucji innych. Dla innych oznacza uszkodzenie podobne do niedokrwienia z niezwykłą dostępnością określonego biomarkera w płynie mózgowo-rdzeniowym
- Niektórzy autorzy stwierdzili, że dystalna oligodendrogliopatia może pochodzić z procesu metabolicznego.
- Wzór IV
- Blizna ma ostre brzegi i zwyrodnienie oligodendrocytów z brzegiem normalnie wyglądającej istoty białej . W centrum blizny brakuje oligodendrocytów. Nie ma aktywacji dopełniacza ani utraty MAG.
Różnice te są zauważalne tylko we wczesnych zmianach, a heterogeniczność była przez pewien czas kontrowersyjna, ponieważ niektóre grupy badawcze uważały, że te cztery wzorce mogą być konsekwencją wieku zmian. Niemniej jednak, po pewnej debacie wśród grup badawczych, model czterech wzorców został zaakceptowany, a wyjątkowy przypadek znaleziony przez Prineasa został sklasyfikowany jako NMO
Dla niektórych zespołów badawczych oznacza to, że stwardnienie rozsiane jest chorobą heterogenną. Ta ostatnia hipoteza jest dodatkowo potwierdzona przez niedawne badanie, które wykazało znaczące różnice w rutynowych badaniach płynu mózgowo-rdzeniowego między pacjentami ze zmianami typu I a pacjentami ze zmianami innymi niż I, w tym brakiem prążków oligoklonalnych ograniczonych do płynu mózgowo-rdzeniowego, w większości wzorów II i III pacjenci. Wreszcie, u niektórych pacjentów, u których wcześniej zdiagnozowano stwardnienie rozsiane typu II, stwierdzono później zapalenie mózgu i rdzenia związane z MOG-IgG, co sugeruje, że zarówno obecne kliniczno-radiologiczne kryteria diagnostyczne stwardnienia rozsianego, jak i kryteria histopatologiczne stwardnienia rozsianego mogą być niewystarczająco specyficzne. Obecnie przeciwciała do lipidy i peptydy w surowicach, wykrywane za pomocą mikromacierzy , mogą być stosowane jako markery podtypu patologicznego określonego przez biopsję mózgu.
Innym osiągnięciem w tej dziedzinie jest odkrycie, że niektóre zmiany chorobowe wykazują defekty mitochondrialne , które umożliwiają rozróżnienie rodzajów zmian chorobowych.
Fenotypy MRI
Przeprowadzono kilka badań próbujących ustalić związek między wynikami patologicznymi a wynikami MRI.
Na przykład, doniesiono, że obrazowanie z transferem magnetyzacji pulsacyjnej, dyfuzyjny MRI tensorowy i MRI wzmocniony VCAM-1 pokazują patologiczne różnice tych wzorców. Wraz z MRI, spektroskopia rezonansu magnetycznego pozwala zobaczyć skład biochemiczny zmian, który pokazuje co najmniej dwa różne wzory
Obecnie od 2014 r. Badania MRI doprowadziły do propozycji czterech fenotypów MRI, chociaż zarówno klasyfikacja, jak i związek z patologią pozostają kontrowersyjne.
Inne proponowane korelacje
Zbadano kilka korelacji, próbując ustalić patologiczną klasyfikację:
- Z kursami klinicznymi: Do tej pory nie ustalono ostatecznego związku między tymi wzorcami a podtypami klinicznymi, ale ustalono pewne zależności. Wszystkie przypadki z PPMS (pierwotnie postępujący) miały wzór IV (zwyrodnienie oligodendrocytów) w pierwotnym badaniu i nie znaleziono nikogo z RRMS z tym wzorem. w stwardnieniu koncentrycznym Balo zostały sklasyfikowane jako wzór III (dystalna oligodendrogliopatia). Zapalenie nerwu wzrokowego nerwu wzrokowego było związane ze wzorem II (demielinizacja za pośrednictwem dopełniacza), chociaż wykazują one dystrybucję okołonaczyniową, różniącą się od zmian typu II w MS.
- Z optyczną tomografią koherencyjną : OCT warstwy siatkówki daje różne wyniki dla PPMS i RRMS
- Z wynikami CSF: Zespoły z Oksfordu i Niemiec odkryły korelację z CSF i progresją w listopadzie 2001 r. i postawiono hipotezy sugerujące korelację między wynikami CSF a wzorcami patofizjologicznymi. W szczególności obiecujący jest stosunek limfocytów B do monocytów. Przeciwciało anty-MOG zostało zbadane i ostatecznie doprowadziło do opisu nowej choroby, zapalenia mózgu i rdzenia związanego z antyMOG . Wysokie poziomy przeciwciał przeciwjądrowych występują normalnie u pacjentów ze stwardnieniem rozsianym [ potrzebne źródło ] . Ostatnio wykazano, że płyn mózgowo-rdzeniowy pobrany od pacjentów z PPMS może przenosić chorobę. Niektóre przypadki mogą należeć do chorób demielinizacyjnych przeciw neurofascynie .
- Zmiany korowe : Nie u wszystkich pacjentów ze stwardnieniem rozsianym rozwijają się zmiany korowe. Robi to tylko około 40% pacjentów. Kiedy się pojawiają, korelują z zapaleniem opon mózgowych.
-
Z odpowiedziami na terapię: Wiadomo, że 30% pacjentów ze stwardnieniem rozsianym nie reaguje na interferon Beta. Heterogenna odpowiedź na terapię może potwierdzać ideę heterogenicznej etiologii . Wykazano również, że receptory IFN i interleukiny w surowicy krwi przewidują odpowiedź na terapię IFN, zwłaszcza IL-17, a stosunek interleukin IL12/IL10 został zaproponowany jako marker przebiegu klinicznego. Oprócz:
- Pacjenci ze zmianami typu II reagują na plazmaferezę , podczas gdy inni nie.
- Podtyp związany z aktywacją makrofagów, naciekiem komórek T i ekspresją cząsteczek mediatora stanu zapalnego może najprawdopodobniej odpowiadać na immunomodulację za pomocą interferonu-beta lub octanu glatirameru.
- Osoby niereagujące na interferony są najbardziej wrażliwe na Copaxone [6]
- Ogólnie rzecz biorąc, ludzie, którzy nie reagują na leczenie, są bardziej wrażliwi na inne, a zmiana terapii może być skuteczna.
- Istnieją różnice genetyczne między osobami reagującymi i nieodpowiadającymi. Chociaż artykuł wskazuje na heterogeniczne reakcje metaboliczne na interferony zamiast na heterogenność choroby, wykazano, że większość różnic genetycznych nie jest związana z zachowaniem interferonu
- Z odpowiedzią na NMO-IgG: NMO-IgG jest immunoglobuliną, która atakuje akwaporynę-4 w chorobie Devica . Pacjenci ze stwardnieniem rozsianym nie mają go we krwi, ale wykazano, że 13% badanych pacjentów zareagowało na epitop AQPaa252-275. Nie wiadomo, czy te przeciwciała definiują odrębne podgrupy SM, czy też są po prostu markerami uszkodzenia astrocytów
- Ze strukturą zmiany : Zmiany jamiste pojawiają się tylko w podgrupie pacjentów z gorszym przebiegiem klinicznym niż normalnie
- Odpowiedź na dożylną immunoglobinę : Odpowiedź na IVIG jest silnie zależna od profilu genetycznego każdej osoby w przewidywalny sposób
- Współwystępowanie z cukrzycą : Cukrzyca typu 1 (T1D) jest wytwarzana przez specjalne haplotypy antygenu leukocytów, które wydają się być zaangażowane także w niektórych przypadkach SM
Postępujące SM
Pierwotnie postępujące SM
Obecnie dyskutuje się, czy pierwotnie postępujące stwardnienie rozsiane (PPMS) jest inną jednostką patologiczną, czy też innym stopniem tej samej patologii. Nie osiągnięto porozumienia, ale istnieją pewne patologiczne cechy charakterystyczne dla PPMS. Na przykład, zapalenie opon mózgowo-rdzeniowych jest inne pod względem standardowych przypadków nawracającego stwardnienia rozsianego (RRMS), a akumulacja sodu jest wyższa. Rozproszona nieprawidłowa istota biała (DAWM) jest inna niż u pacjentów z RRMS/SPMS i wykazano, że CSF od pacjentów z PPMS może przenosić chorobę
Z patologicznego punktu widzenia, cechy charakterystyczne PPMS to powolna ekspansja wcześniej istniejących zmian w istocie białej, masywna demielinizacja kory mózgowej i rozległe rozproszone uszkodzenie normalnie wyglądającej istoty białej. Podobnie jak w nawracającym SM, również w postępującym SM uszkodzenie aktywnej tkanki jest niezmiennie związane ze stanem zapalnym, ale wydaje się, że stan zapalny jest uwięziony za zamkniętą barierą krew-mózg
Szczególnie godną uwagi różnicą między PPMS i SPMS są pewne podobne do pęcherzyków struktury komórek B w oponach mózgowych pacjentów z SPMS, które nigdy nie były zgłaszane u pacjentów z PPMS. Pęcherzyki te wydają się być związane z demielinizacją korową w SPMS.
Żaden lek modyfikujący przebieg choroby nie jest zatwierdzony do leczenia PPMS. Obecnie badany jest natalizumab
Wtórnie postępujące SM
Wtórnie postępujące stwardnienie rozsiane pokazuje pęcherzykopodobne struktury komórek B (znane również jako ektopowe struktury podobne do pęcherzyków, EFS lub trzeciorzędowe tkanki Lynphoid, TLT) w oponach mózgowych, które wydają się być związane z podstawowym uszkodzeniem kory podwzgórzowej. Pęcherzyki te nie pojawiają się w pierwotnie postępującym (PPMS) ani w remitant-relapsing stwardnienie rozsiane (RRMS).
Patologia wczesnego stwardnienia rozsianego i niemego stwardnienia rozsianego
Kryteria McDonalda opierają się na wykrywaniu zmian chorobowych rozsianych w czasie i przestrzeni, które definiują stwardnienie rozsiane poprzez obserwacje kliniczne. Dlatego zwykle nie pozwalają one na postawienie diagnozy definitywnego stwardnienia rozsianego przed pojawieniem się dwóch ataków klinicznych. Oznacza to, że w przypadku klinicznie określonych przypadków stwardnienie rozsiane jest obecne od dłuższego czasu, co utrudnia badanie początkowych stadiów. Aby zbadać początkowe stadia stwardnienia rozsianego, należy zastosować dodatkowe testy parakliniczne, aby udowodnić obecność i rozsiew zmian.
Czasami pacjenci z pierwszym izolowanym atakiem (zespół izolowany klinicznie lub CIS), ale przed potwierdzającym się drugim atakiem ( przedkliniczne stwardnienie rozsiane ), mogą zostać przyjęci do badania początkowej patologii stwardnienia rozsianego, ale istnieją badania sugerujące, że każdy przypadek stwardnienia rozsianego zaczyna się jako cicha patologia, która może pozostać niezauważona nawet przez pięć lat. Dlatego nawet CIS może pojawić się zbyt późno w ewolucji stwardnienia rozsianego.
Przypadki stwardnienia rozsianego przed CIS są czasami wykrywane podczas innych badań neurologicznych i są określane jako subkliniczne stwardnienie rozsiane lub czasami stwardnienie rozsiane nieme klinicznie . Poprzednie odniesienie stwierdza, że klinicznie nieme blaszki stwardnienia rozsianego były zlokalizowane w obszarach okołokomorowych. To odniesienie również podaje szacunkową częstość występowania niemego stwardnienia rozsianego na poziomie około 25%. Ewolucja oligodendrocytów jest podobna do normalnych kursów klinicznych SM
Czasami pacjenci, którzy przechodzą badanie MRI z niezwiązanej przyczyny, mogą wykazywać zmiany w mózgu. Te przypadki izolowanych wyników MRI zostały niedawno ochrzczone jako RIS (zespół izolowany radiologicznie) i są najczęstszymi kontrolami, w których pojawiły się sugestie cichego stwardnienia rozsianego.
W odniesieniu do patologii przypadków RIS możemy wskazać, że wykazują one uszkodzenia korowe, głównie u pacjentów z prążkami oligoklonalnymi. Makroskopowe uszkodzenie jest podobne do przypadków RRMS, ale łagodniejsze. Uszkodzenia rdzenia szyjnego są ważnym predyktorem progresji, a iloraz N-acetyloasparaginianu do kreatyny sugeruje uszkodzenie aksonów
Zobacz też
Linki zewnętrzne
- Strona projektu zmiany
- MRI i CT stwardnienia rozsianego MedPix Image Database




