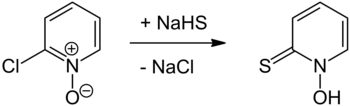pirytion
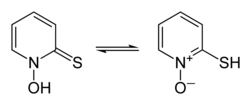 Interkonwersja tautomerów pirytionu, forma tionu po lewej stronie, forma tiolu po prawej stronie |
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
1-hydroksy-2(1H ) -pirydynotion (tion) 1-tlenek 2-pirydynotiolu (tiol) |
|
| Inne nazwy Omadyna tion : 1-hydroksypirydyno-2-tion N -hydroksypirydyno-2-tion tiol : 2-merkaptopirydyny monotlenek N-tlenek 2 -merkaptopirydyny 2 -merkaptopirydyny 1-tlenek |
|
| Identyfikatory | |
|
|
|
Model 3D ( JSmol )
|
|
| 109936 | |
| CHEBI |
|
| CHEMBL |
|
| ChemSpider | |
| Bank Leków | |
| Karta informacyjna ECHA | 100.013.027 |
| Numer WE |
|
| 913415 | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 5 H 5 N O S | |
| Masa cząsteczkowa | 127,16 g·mol -1 |
| Wygląd | Beżowy krystaliczny proszek |
| Temperatura topnienia | 70 do 73 ° C (158 do 163 ° F; 343 do 346 K) |
| 2,5 g L -1 w temperaturze 20°C | |
| Rozpuszczalność |
Rozpuszczalny : benzen , chloroform , dichlorometan , dimetyloformamid , dimetylosulfotlenek , octan etylu Słabo rozpuszczalny : eter dietylowy , etanol , eter metylowo -tert -butylowy , tetrahydrofuran |
| Kwasowość ( p Ka ) | −1,95 (dodatek protonu), 4,6 |
| Zagrożenia | |
| Oznakowanie GHS : | |

|
|
| Niebezpieczeństwo | |
| H301 , H315 , H319 , H335 | |
| P261 , P264 , P270 , P271 , P280 , P301+P310 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P330 , P332 +P313 , P337+P313 , P36 2 , P403 + P233 , P405 , P501 | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Pirytion to nazwa zwyczajowa związku siarkoorganicznego o wzorze cząsteczkowym
występującym w
szalocie C5H5NOS , wybranym jako skrót od pirydynotionu , perskiej . Występuje w postaci pary tautomerów , z których główną postacią jest 1-hydroksy-2(1H ) -pirydynotion tionu , a drugorzędną postacią jest N - 2-merkaptopirydyny tiolu tlenek ; krystalizuje w postaci tionu. Zwykle jest wytwarzany z N -tlenku 2-bromopirydyny , 2-chloropirydyny lub N-tlenku 2-chloropirydyny i jest dostępny w handlu zarówno jako związek obojętny, jak i jego sól sodowa . Służy do przygotowania pirytionianu cynku , który jest stosowany przede wszystkim w leczeniu łupieżu i łojotokowego zapalenia skóry w szamponach leczniczych , ale jest również środkiem przeciwporostowym w farbach.
Przygotowanie
Przygotowanie pirytionu zostało po raz pierwszy opisane w 1950 roku przez Shawa i zostało przygotowane w reakcji N-tlenku 2-chloropirydyny z wodorosiarczkiem sodu , a następnie zakwaszeniem lub ostatnio z siarczkiem sodu . Sam N -tlenek 2-chloropirydyny można wytworzyć z 2-chloropirydyny przy użyciu kwasu nadoctowego . Inne podejście obejmuje potraktowanie tego samego wyjściowego N -tlenku tiomocznikiem z wytworzeniem N -tlenku chlorku pirydylo-2-izotiouroniowego, który ulega hydrolizie zasadowej do pirytionu. 2-Bromopirydynę można utlenić do jej N -tlenku, stosując odpowiedni nadkwas (taki jak 2-chloropirydyna), oba podejścia są analogiczne do opisanego w Organie Syntheses dla utleniania pirydyny do jej N -tlenku. Reakcja podstawienia z użyciem ditionianu sodu ( Na
2 S
2 O
4 ) lub siarczku sodu wodorotlenkiem sodu pozwoli na zastąpienie podstawnika bromowego tiolem grupa funkcjonalna .
Alternatywną strategią jest utworzenie merkaptanu przed wprowadzeniem ugrupowania N -tlenku . 2-Merkaptopirydyna została pierwotnie zsyntetyzowana w 1931 roku przez ogrzewanie 2-chloropirydyny z wodorosiarczkiem wapnia , podejście podobne do tego, które po raz pierwszy zastosowano do przygotowania pirytionu. Analogiczne podejście do tiomocznika za pomocą soli uronowej zostało opisane w 1958 roku i zapewnia wygodniejszą drogę do 2-merkaptopirydyny. Następnie można przeprowadzić utlenianie do N -tlenku.
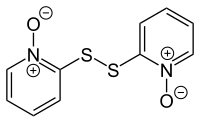
Pirytion występuje jako produkt naturalny w roślinie Allium stipitatum , azjatyckim gatunku cebuli , znanej również jako szalotka perska. Jego obecność wykryto za pomocą spektrometrii mas jonów dodatnich przy użyciu źródła jonów DART, a ditlenek disiarczkowy [ 2,2'-disulfanodiylobis (pirydyno) -1,1'-ditlenek) odnotowano u tego samego gatunku. Dipirytion można wytworzyć w laboratorium przez utlenianie pirytionu chlorem w obecności wodorotlenku sodu :
- 2 C
5 H
4 NOSH + Cl
2 + 2 NaOH → ONC
5 H
4 –S – S – C
5 H
4 NO + 2 NaCl + 2 H
2 O
- 2 C
Dipirytion jest stosowany jako środek grzybobójczy i bakteriobójczy i stwierdzono, że posiada nową aktywność cytotoksyczną poprzez indukowanie apoptozy .
Nieruchomości
Pirytion istnieje jako para prototropów, forma tautomeryzmu , w której szybka interkonwersja izomerów konstytucyjnych obejmuje przesunięcie pojedynczego protonu, w tym przypadku między atomami siarki i tlenu (pokazane w infoboksie powyżej).
Sole sprzężonej zasady pirytionu można również uznać za wykazujące tautomerię poprzez hipotetyczne powiązanie jonu sodu z dowolnym heteroatomem mającym ujemny ładunek anionu (w przeciwieństwie do formalnych ładunków związanych z N -tlenkiem); jednak biorąc pod uwagę sam anion, można to również opisać jako przykład rezonansu .
Pirytion jest słabym kwasem o wartościach p Ka wynoszących -1,95 i +4,6 (proton tiolowy), ale jest znacznie silniejszym kwasem niż którykolwiek z jego związków macierzystych ( N -tlenek pirydyny i pirydyno-2-tiol), z których oba mają p K a > 8. Jest tylko słabo rozpuszczalny w wodzie (2,5 g L -1 ), ale jest rozpuszczalny w wielu rozpuszczalnikach organicznych (w tym benzenie , chloroformie , dichlorometanie , dimetyloformamidzie , dimetylosulfotlenku i octanie etylu ) i niewielką rozpuszczalność w innych ( eterze dietylowym , etanolu , eterze metylowo -tert -butylowym i tetrahydrofuranie ).
Pirytion może być wykorzystany jako źródło rodnika hydroksylowego w syntezie organicznej, ponieważ rozkłada się fotochemicznie do HO • i rodnika (pirydyn-2-ylo)sulfanylowego.
Aplikacje
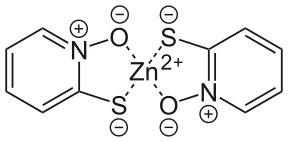
Struktury kompleksów 1:2 cynku i sprzężonej zasady pirytionu U góry : Wzór strukturalny monomeru U dołu : Model dimeru typu kulka i kij
Sprzężona zasada pirytionianu (jon pirytionianowy) jest anionem zawierającym dwa atomy donorowe , atom siarki i atom tlenu, z których każdy ma ujemny ładunek formalny ; atom azotu pozostaje formalnie naładowany dodatnio. Anion tiolanowy może powstać w reakcji z węglanem sodu, a pirytion cynku powstaje po dodaniu chlorku cynku . Anion może działać jako ligand jednokleszczowy lub dwukleszczowy i tworzy kompleks 1:2 z metalowym środkiem cynku (II). Pirytion cynku był używany od lat trzydziestych XX wieku, chociaż jego wytwarzanie zostało ujawnione dopiero w brytyjskim patencie z 1955 r., W którym pirytion poddano bezpośredniej reakcji z uwodnionym siarczanem cynku w etanolu. W swojej monomerycznej postaci pirytionian cynku ma dwa aniony chelatowane do centrum cynku o geometrii czworościennej . W stanie stałym tworzy dimer , w którym każde centrum cynku przyjmuje trygonalną geometrię bipiramidalną z dwoma anionami działającymi jako ligandy mostkowe koordynowane przez atomy tlenu w pozycjach osiowych. W roztworze dimery dysocjują poprzez rozerwanie wiązań cynk-tlen z każdym ligandem mostkującym. Może wystąpić dalsza dysocjacja monomeru na jego składniki, co jest niepożądane, ponieważ kompleks jest silniejszy w zastosowaniach medycznych; z tego powodu do preparatów można dodawać węglan cynku , ponieważ hamuje on dysocjację monomeru.
Pirytionian cynku ma długą historię stosowania w szamponach leczniczych do leczenia łupieżu i łojotokowego zapalenia skóry (łupież można uznać za łagodną postać łojotokowego zapalenia skóry). Wykazuje zarówno przeciwgrzybicze , jak i przeciwdrobnoustrojowe , hamując drożdżaki Malassezia , które sprzyjają tym chorobom skóry głowy. Mechanizmy, dzięki którym ta praca jest przedmiotem ciągłych badań. Może być stosowany jako przeciwbakteryjny przeciwko Staphylococcus i Streptococcus infekcje w stanach takich jak grzybica stóp, egzema, łuszczyca i grzybica. Wiadomo, że jest cytotoksyczny wobec Pityrosporum ovale , zwłaszcza w połączeniu z ketokonazolem , który jest preparatem preferowanym w leczeniu łojotokowego zapalenia skóry. Sam pirytion hamuje procesy transportu błonowego u grzybów.
Farby stosowane w środowiskach zewnętrznych czasami zawierają pirytionian cynku jako środek zapobiegający glonom i pleśni.