tetratiafulwalen
|
|

|
|

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
2,2′-Bi(1,3-ditioliden) |
|
| Inne nazwy Δ2,2-Bi-1,3-ditiol
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 1282106 | |
| CHEBI | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.045.979 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 6 H 4 S 4 | |
| Masa cząsteczkowa | 204,34 g·mol -1 |
| Wygląd | Żółte ciało stałe |
| Temperatura topnienia | 116 do 119 ° C (241 do 246 ° F; 389 do 392 K) |
| Temperatura wrzenia | Rozkłada się |
| Nierozpuszczalny | |
| Rozpuszczalność w rozpuszczalnikach organicznych | Rozpuszczalny [ niejasny ] |
| Struktura | |
| 0 D | |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
palny |
| Oznakowanie GHS : | |

|
|
| Ostrzeżenie | |
| H317 | |
| P261 , P280 , P302+P352 , P333+P313 , P363 , P501 | |
| Związki pokrewne | |
|
Związki pokrewne
|
TCNQ , tiofen |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
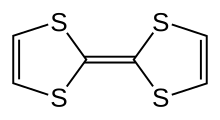
Tetratiafulwalen ( TTF ) jest organicznym związkiem siarki o wzorze ( H 2 C 2 S 2 C) 2 . Badania nad tym heterocyklicznym przyczyniły się do rozwoju elektroniki molekularnej . TTF jest spokrewniony z węglowodorowym fulwalenem , (C 5 H 4 ) 2 , przez zastąpienie czterech grup CH z atomami siarki. Ponad 10 000 publikacji naukowych omawia TTF i jego pochodne.
Przygotowanie
Wysoki poziom zainteresowania TTF zaowocował rozwojem wielu syntez TTF i jego analogów. Większość preparatów obejmuje sprzęganie cyklicznych C3S2 1,3 ony . , takich jak -ditiolo -2-tion lub pokrewne 1,3-ditiole-2- W przypadku samego TTF synteza rozpoczyna się od tritiowęglanu H 2 C 2 S 2 CS , który jest S-metylowany , a następnie redukowany do H 2 C 2 S 2 CH(SCH 3 ) , który jest traktowany w następujący sposób:
Właściwości redoks
Sam luzem TTF ma niezwykłe właściwości elektryczne. Charakterystyczne właściwości mają jednak sole jego utlenionych pochodnych, takie jak sole pochodzące od TTF + .
Wysokie przewodnictwo elektryczne soli TTF można przypisać następującym cechom TTF: (i) jego płaskości, która umożliwia układanie w stosy π-π jego utlenionych pochodnych, (ii) wysokiej symetrii, która sprzyja delokalizacji ładunku , minimalizując w ten sposób odpychanie kulombowskie oraz (iii) jego zdolność do ulegania utlenianiu przy łagodnych potencjałach w celu uzyskania stabilnego rodnikowego kationu . Pomiary elektrochemiczne pokazują, że TTF można utleniać dwukrotnie odwracalnie:
Każdy pierścień ditiolidenowy w TTF ma 7 elektronów π: 2 na każdy atom siarki, 1 na każdy atom węgla sp2 . W ten sposób utlenianie przekształca każdy pierścień w aromatyczną konfigurację 6-elektronową, w konsekwencji pozostawiając centralne wiązanie podwójne zasadniczo jako wiązanie pojedyncze, ponieważ wszystkie elektrony π zajmują orbitale pierścienia.
Historia
sól [TTF +
]Cl -
jest półprzewodnikiem. Następnie wykazano, że sól przenosząca ładunek [TTF] TCNQ jest półprzewodnikiem o wąskim paśmie wzbronionym . Badania dyfrakcji rentgenowskiej [TTF][TCNQ] ujawniły stosy częściowo utlenionych cząsteczek TTF przylegające do anionowych stosów cząsteczek TCNQ. Ten motyw „segregowanego stosu” był nieoczekiwany i odpowiada za charakterystyczne właściwości elektryczne, tj. wysokie i anizotropowe przewodnictwo elektryczne . Od tych wczesnych odkryć przygotowano liczne analogi TTF. Dobrze zbadane analogi obejmują tetrametylotetratiafulwalen (Me 4 TTF), tetrametyloselenafulwalen (TMTSF) i bis(etylenoditio)tetratiafulwalen (BEDT-TTF, CAS [66946-48-3]). Kilka soli tetrametylotetratiafulwalenu (zwanych solami Fabre'a ) ma pewne znaczenie jako nadprzewodniki organiczne .
Zobacz też
Dalsza lektura
- Rovira, C. (2004). „Bis (etylenotio) tetratiafulwalen (BET-TTF) i powiązane niesymetryczne donory elektronów: od cząsteczki do funkcjonalnych materiałów i urządzeń molekularnych (OFET)”. Recenzje chemiczne . 104 (11): 5289–5317. doi : 10.1021/cr030663+ . PMID 15535651 .
- Iyoda, M; Hasegawa, M; Miyake, Y. (2004). „Bi-TTF, Bis-TTF i pokrewne oligomery TTF”. Recenzje chemiczne . 104 (11): 5085–5113. doi : 10.1021/cr030651o . PMID 15535643 .
- Frere, P.; Skabara, PJ (2005). „Sole rozszerzonych analogów tetratiafulwalenu: związki między strukturą cząsteczkową, właściwościami elektrochemicznymi i organizacją ciała stałego”. Recenzje Towarzystwa Chemicznego . 34 (1): 69–98. doi : 10.1039/b316392j . PMID 15643491 .
- Gorgues, Alain; Hudhomme, Pietrick; Salle, Marc. (2004). „Wysoce funkcjonalizowane tetratiafulwaleny: jazda syntetycznym szlakiem z elektrofilowych alkinów”. Recenzje chemiczne . 104 (11): 5151–5184. doi : 10.1021/cr0306485 . PMID 15535646 .
- Właściwości fizyczne tetratiafulwalenu z literatury.
![{\displaystyle {\ce {H2C2S2CH(SCH3) + HBF4 -> [H2C2S2CH+]BF4- + HSCH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/00431ff870a019343fc6dc0f52a071cc115e50c0)
![{\displaystyle {\ce {2 [H2C2S2CH+]BF4- + 2 Et3N -> (H2C2S2C)2 + 2 Et3NHBF4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2c531245c41dd4fe308b5a448f1cc7a8d518fb4c)




