trimetylofosfina
|
|
|
|
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
trimetylofosfan |
|
|
Systematyczna nazwa IUPAC
Trimetylofosfan (substytut) Trimetylofosfor (dodatek) |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 969138 | |
| CHEBI | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.008.932 |
| Numer WE |
|
| Siatka | trimetylo+fosfina |
|
Identyfikator klienta PubChem
|
|
| UNII | |
| Numer ONZ | 1993 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 3 H 9 P | |
| Masa cząsteczkowa | 76,079 g · mol -1 |
| Wygląd | Bezbarwna ciecz |
| Gęstość | 735 mg cm -3 |
| Temperatura topnienia | -86 ° C (-123 ° F; 187 K) |
| Temperatura wrzenia | 38 do 39 ° C (100 do 102 ° F; 311 do 312 K) |
| Ciśnienie pary | 49,9 kPa (przy 20 ° C) |
| Struktura | |
| Piramida trygonalna | |
| 1.19 Debye | |
| Zagrożenia | |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| H225 , H315 , H319 , H335 | |
| P210 , P261 , P305+P351+P338 | |
| Punkt zapłonu | -19 ° C (-2 ° F; 254 K) |
| Związki pokrewne | |
|
Związki pokrewne
|
PEt 3 NMe 3 PH 3 PPh 3 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
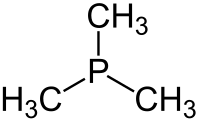
Trimetylofosfina jest obojętnym związkiem fosforoorganicznym o wzorze P(CH 3 ) 3 , powszechnie określanym skrótem PMe 3 . Ta bezbarwna ciecz ma bardzo nieprzyjemny zapach, charakterystyczny dla alkilofosfin. Związek ten jest powszechnym ligandem w chemii koordynacyjnej .
Struktura i wiązanie
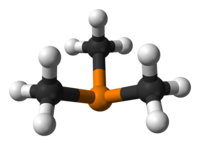
Jest to cząsteczka piramidalna symetrii o przybliżonej C3v . Kąty wiązań C – P – C wynoszą około 98,6 °.
Kąty wiązań C – P – C są zgodne z poglądem, że fosfor wykorzystuje głównie orbitale 3p do tworzenia wiązań i że hybrydyzacja sp atomu fosforu jest niewielka. Ta ostatnia jest wspólną cechą chemii fosforu. W rezultacie samotna para trimetylofosfiny ma głównie charakter s, jak ma to miejsce w przypadku fosfiny, PH3 .
PMe 3 można otrzymać przez traktowanie fosforynu trifenylu chlorkiem metylomagnezu :
- 3 CH 3 MgCl + P(OC 6 H 5 ) 3 → P(CH 3 ) 3 + 3 C 6 H 5 OMgCl
Syntezę prowadzi się w eterze dibutylowym , z którego można oddestylować bardziej lotny PMe3 .
Reakcje
Przy pKa równym 8,65 PMe 3 reaguje z mocnymi kwasami dając sole [HPMe 3 ]X. Ta reakcja jest odwracalna. W przypadku silnych zasad, takich jak związki alkilolitu , grupa metylowa ulega deprotonowaniu, dając PMe 2 CH 2 Li.
PMe 3 łatwo utlenia się tlenkiem fosfiny. Reaguje z bromkiem metylu dając bromek tetrametylofosfoniowy .
Chemia koordynacyjna
Trimetylofosfina jest wysoce zasadowym ligandem , który tworzy kompleksy z większością metali. Jako ligand, kąt stożka Tolmana trimetylofosfiny wynosi 118 °. Kąt ten wskazuje stopień ochrony sterycznej, jaką ten ligand zapewnia metalowi, z którym jest związany.
Będąc stosunkowo zwartą fosfiną, kilka z nich może wiązać się z pojedynczym metalem przejściowym, co ilustruje istnienie Pt( PEt3 ) 4 . Jego kompleks z jodkiem srebra, AgI(PMe 3 ), jest stabilną w powietrzu substancją stałą, która po podgrzaniu uwalnia PMe 3 .
Bezpieczeństwo
PMe 3 jest toksyczny i samozapalny . Po potraktowaniu podchlorynem sodu lub nadtlenkiem wodoru przekształca się w znacznie bezpieczniejszy tlenek fosfiny .
