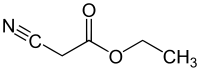
Cyjanooctan etylu
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Cyjanooctan etylu |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.003.009 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
| Numer ONZ | 3276 2666 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 5 H 7 N O 2 | |
| Masa cząsteczkowa | 113,116 g·mol -1 |
| -67,3· 10-6 cm3 / mol | |
| Zagrożenia | |
| Oznakowanie GHS : | |

|
|
| Ostrzeżenie | |
| H302 , H312 , H319 , H332 | |
| P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P304+P312 , P304 +P340 , P305+P351+P338 , P312 , P322 , P330 , P337+P313 , P36 3 , P501 | |
| NFPA 704 (ognisty diament) | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Cyjanooctan etylu jest związkiem organicznym zawierającym ester karboksylanowy i nitryl . Jest to bezbarwna ciecz o przyjemnym zapachu. Materiał ten jest przydatny jako materiał wyjściowy do syntez ze względu na różnorodność grup funkcyjnych i reaktywność chemiczną.
Produkcja
Cyjanooctan etylu można przygotować na różne sposoby:
- Synteza nitrylu Kolbego z użyciem chlorooctanu etylu i cyjanku sodu .
- Estryfikacja Fischera kwasu cyjanooctowego etanolem w obecności mocnych kwasów mineralnych (np . stężonego kwasu siarkowego ). Kwas cyjanooctowy można wytworzyć za pomocą syntezy nitrylu Kolbe przy użyciu chlorooctanu sodu i cyjanku sodu.
- Reakcja cyjanooctanu sodu z bromkiem etylu w układzie dwufazowym wodno-organicznym w obecności katalizatora przeniesienia fazowego .
- Utlenianie eteru 3-etoksypropionitrylu tlenem pod ciśnieniem w obecności tetrahydratu octanu kobaltu(II) jako katalizatora i N -hydroksyftalimidu jako generatora rodników.
Nieruchomości
Właściwości fizyczne
Prężność pary jest zgodna z równaniem Antoine log 10 (P) = A-(B/(T+C)) (P w barach, T w K) przy A = 7,46724, B = 3693,663 i C = 16,138 w zakresie temperatur od 341 do 479 K Występują dwie formy polimorficzne . [ potrzebne pełne cytowanie ] Poniżej -111 °C dominuje forma krystaliczna II. Powyżej tej temperatury tworzy się postać krystaliczna I, która topi się w temperaturze -22°C. Pojemność cieplna w temperaturze 25°C wynosi 220,22 JK -1 mol -1 .
Właściwości chemiczne
Dzięki trzem różnym centrom reaktywnym — nitrylowi, estrowi, kwaśnemu miejscu metylenowemu — cyjanooctan etylu jest wszechstronnym syntetycznym budulcem dla różnorodnych substancji funkcjonalnych i farmakologicznie czynnych. Zawiera kwaśną grupę metylenową, otoczoną zarówno nitrylem, jak i karbonylem , dzięki czemu może być stosowana w reakcjach kondensacji, takich jak kondensacja Knoevenagela lub addycja Michaela . Ta reaktywność jest podobna do reaktywności estrów kwasu malonowego . Jako przykład reaktywności nitrylu, malonian dietylu otrzymuje się z estru etylowego kwasu cyjanooctowego w reakcji z etanolem w obecności mocnych kwasów . Ogrzewanie w obecności etanolanu sodu tworzy dimeryczny ester dietylowy 3-amino-2-cyjano-2-pentendiaku.
Używać
Ze względu na swoją funkcjonalność cyjanooctan reaguje:
- W grupie nitrylowej na różne sposoby:
- Uwodornienie prowadzi do β-aminokwasu β-alaniny
- Atak nukleofilowy na węgiel jako etap syntezy wielu heterocykli (patrz poniżej) i innych produktów
- Jako bezpieczny odczynnik będący donorem cyjanku
- Atak nukleofilowy na grupę estrową jako część podstawienia acylowego: reakcja z amoniakiem prowadzi do cyjanoacetamidu, który można przekształcić przez odwodnienie PCl 5 lub POCl 3 do malononitrylu.
- Poprzez kwaśną grupę metylenową jako nukleofil
Cyjanooctan etylu jest budulcem do syntezy związków heterocyklicznych , które są wykorzystywane m.in. jako leki:
- Allopurynol , stosowany w leczeniu przewlekłej dny moczanowej, można zsyntetyzować wychodząc z kondensacji Knoevenagela z ortomrówczanem trietylu ; produkt kondensacji poddaje się cyklizacji hydrazyną z wytworzeniem podstawionego pirazolu, a następnie formamidem z wytworzeniem allopurynolu, podstawionej pirazolo-pirymidyny.
- Pochodne purynowe teofilina , kofeina i kwas moczowy są syntetycznie dostępne z cyjanooctanu etylu i N,N'- dimetylomocznika .
- Kwas foliowy będący pochodną pterydyny jest przypisany do kompleksu witaminy B ; cyjanooctan etylu i guanidyna mogą być stosowane jako materiał wyjściowy w wieloetapowej syntezie konwergentnej .
- Etosuksymid pirolu jest stosowany w leczeniu padaczki , można go otrzymać z cyjanooctanu etylu i butanonu w wieloetapowej syntezie.
- Pochodna pirymidyny trimetoprim jest stosowana jako ko-trimoksazol w stałej kombinacji z sulfametoksazolem stosowanym jako środek bakteriostatyczny i jest syntetyzowana z cyjanooctanu etylu i 3,4,5-trimetoksybenzaldehydu lub jego chlorku benzylu.
Również wiele innych funkcjonalnych heterocykli jest dostępnych z dobrą wydajnością z cyjanooctanu etylu, takich jak 3-podstawione pochodne kumaryny.
Produkty niecykliczne z tego materiału wyjściowego obejmują:
- Przeciwdrgawkowy kwas walproinowy
- Cyjanoakrylan etylu , stosowany jako super klej, w reakcji z formaldehydem
Cyjanooctan etylu jest również używany do przygotowania 3,3-difenylopropano-1-aminy, która jest prekursorem stosowanym w syntezie Prenyloaminy i Droprenilaminy.
Bezpieczeństwo
Cyjanooctan etylu ma LD50 2820 mg/kg (doustnie, szczur).

