Heksachlorofosfazen
|
|

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
2,2,4,4,6,6-heksachloro-1,3,5,2λ 5 ,4λ 5 ,6λ 5 -triazatrifosfinina
|
|
Inne nazwy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.012.160 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| ( NPCI2 ) 3 | |
| Masa cząsteczkowa | 347,64 g·mol -1 |
| Wygląd | bezbarwne ciało stałe |
| Gęstość | 1,98 g/ml w temperaturze 25°C |
| Temperatura topnienia | 112 do 114 ° C (234 do 237 ° F; 385 do 387 K) |
| Temperatura wrzenia | rozkłada się (powyżej 167 °C) |
| 60°C przy 0,05 tora | |
| rozkłada się | |
| Rozpuszczalność w CCl4 |
24,5% wag. (20°C) 35,6% wag. (40°C) 39,2% wag. (60°C) |
| Rozpuszczalność w cykloheksanie |
22,3% wag. (20°C) 36,8% wag. (40°C) 53,7% wag. (60°C) |
| Rozpuszczalność w ksylenie |
27,7% wag. (20°C) 38,9% wag. (40°C) 50,7% wag. (60°C) |
| −149×10 −6 cm3 / mol | |
|
Współczynnik załamania światła ( n D )
|
1,62 (589 nm) |
| Struktura | |
| rombowy | |
| 62 (Pnma, D 16 2h ) |
|
| D 3 godz | |
|
a = 13,87 Å, b = 12,83 Å, c = 6,09 Å
|
|
|
Jednostki wzoru ( Z )
|
4 |
| krzesło (lekko potargane) | |
| 0 D | |
| Termochemia | |
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
−812,4 kJ/mol |
|
Entalpia parowania (Δ f H vap )
|
55,2 kJ/mol |
|
Entalpia sublimacji (Δ f H sublim )
|
76,2 kJ/mol |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
lekko drażniący |
| Oznakowanie GHS : | |

|
|
| Niebezpieczeństwo | |
| H314 | |
| P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+ P338 , P310 , P321 , P363 , P405 , P501 | |
| Punkt zapłonu | Nie palne |
| Związki pokrewne | |
|
Związki pokrewne
|
heksafluorofosfazen |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Heksachlorofosfazen jest związkiem nieorganicznym o wzorze (NPCl 2 ) 3 . Cząsteczka ma cykliczny, nienasycony szkielet składający się z naprzemiennych fosforu i azotu i może być postrzegana jako trimer hipotetycznego związku N≡PCl 2 . Jego klasyfikacja jako fosfazen podkreśla jego związek z benzenem . Istnieje duże zainteresowanie akademickie związkiem związanym z wiązaniem fosfor-azot i reaktywnością fosforu.
Czasami donoszono również o komercyjnych lub sugerowanych praktycznych zastosowaniach wykorzystujących heksachlorofosfazen jako prekursor chemiczny. Interesujące pochodne obejmują heksalkoksyfosfazenowe środki poślizgowe otrzymane z nukleofilowego podstawienia heksachlorofosfazenu alkoholanami lub chemicznie odporne polimery nieorganiczne o pożądanych właściwościach termicznych i mechanicznych, znane jako polifosfazeny wytwarzane z polimeryzacji heksachlorofosfazenu.
Struktura i charakterystyka
Długości i konformacja wiązań
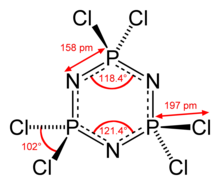
Heksachlorofosfazen ma rdzeń P 3 N 3 z sześcioma równoważnymi wiązaniami P – N, dla których sąsiednie odległości P – N wynoszą 157 pm. Jest to charakterystycznie krótsze niż ok . 177 pm Wiązania P – N w nasyconych walencyjnie fosfazanowych .
Cząsteczka ma symetrię D 3h , a każde centrum fosforu jest czworościenne z kątem Cl – P – Cl równym 101 °.
Pierścień P 3 N 3 w heksachlorofosfazenie odbiega od płaskości i jest lekko pofałdowany (patrz konformacja krzesła ). Natomiast P3N3 jest płaski . w pokrewnych formach heksafluorofosfazenu całkowicie
Metody charakteryzacji
31 P-NMR jest zwykłą metodą oznaczania heksachlorofosfazyny i jej reakcji. Heksachlorofosfazyna wykazuje pojedynczy rezonans przy 20,6 ppm, ponieważ wszystkie środowiska P są chemicznie równoważne.
W jego widmie IR pasma oscylacyjne 1370 i 1218 cm -1 są przypisane do rozciągnięć ν P–N . Inne pasma znajdują się przy 860 i 500–600 cm -1 , odpowiednio przypisane do pierścienia i ν P–Cl .
Heksachlorofosfazyna i wiele jej pochodnych scharakteryzowano za pomocą krystalografii rentgenowskiej monokryształu .
Klejenie

Wczesne analizy
Cyklofosfazeny, takie jak heksachlorofosfazen, wyróżniają się znaczną stabilnością i równymi długościami wiązań P – N, co w wielu takich cyklicznych cząsteczkach oznaczałoby delokalizację, a nawet aromatyczność. Aby uwzględnić te cechy, wczesne modele wiązania, począwszy od połowy lat pięćdziesiątych, odwoływały się do zdelokalizowanego systemu π, wynikającego z nakładania się orbitali N 2 p i P 3 d .
Nowoczesne modele klejenia
Począwszy od późnych lat 80. XX wieku, bardziej nowoczesne obliczenia i brak dowodów spektroskopowych ujawniają, że udział P 3 d jest znikomy, co unieważnia wcześniejszą hipotezę. Zamiast tego ogólnie akceptowany jest model z separacją opłat.
Zgodnie z tym opisem, wiązanie P – N jest postrzegane jako bardzo spolaryzowane (pomiędzy hipotetycznym P + a N - ), o charakterze jonowym wystarczającym do uwzględnienia większości siły wiązania.
Resztę (~ 15%) siły wiązania można przypisać negatywnemu oddziaływaniu hiperkoniugacji: samotne pary N mogą przekazać pewną gęstość elektronów na akceptujące π orbitale molekularne σ * na P.
Synteza
Synteza heksachlorofosfazenu została po raz pierwszy opisana przez von Liebiga w 1834 r. W raporcie tym opisuje on eksperymenty przeprowadzone z Wöhlerem . Odkryli, że pentachlorek fosforu i amoniak reagują egzotermicznie, dając nową substancję, którą można przemyć zimną wodą w celu usunięcia współproduktu chlorku amonu . Nowy związek zawierał P, N i Cl, na podstawie analizy elementarnej . Był wrażliwy na hydrolizę gorącą wodą.
Współczesne syntezy opierają się na opracowaniu Schenka i Römera, którzy zamiast amoniaku i obojętnych chlorowanych rozpuszczalników zastosowali chlorek amonu . Zastąpienie amoniaku chlorkiem amonu umożliwia przebieg reakcji bez silnej egzotermii związanej z reakcją NH 3 / PCl 5 . Typowymi rozpuszczalnikami chlorowęglowymi są 1,1,2,2-tetrachloroetan lub chlorobenzen , które tolerują produkt uboczny chlorowodoru. Ponieważ chlorek amonu jest nierozpuszczalny w chlorowanych rozpuszczalnikach, obróbka jest ułatwiona. W przypadku reakcji w takich warunkach obowiązuje następująca stechiometria:
- n [NH 4 ]Cl + n PCl 5 → (NPCl 2 ) n + n HCl
gdzie n może zwykle przyjmować wartości 2 (dimer tetrachlorodifosfazen), 3 (trimer heksachlorotrifosfazen) i 4 (tetramer oktachlorotetrafosfazen).
Oczyszczanie przez sublimację daje głównie trimer i tetramer . Powolna sublimacja próżniowa w około 60 ° C daje czysty trimer wolny od tetrameru. Warunki reakcji, takie jak temperatura, można również dostosować, aby zmaksymalizować wydajność trimeru kosztem innych możliwych produktów; niemniej jednak handlowe próbki heksachlorofosfazenu zwykle zawierają znaczne ilości oktachlorotetrafosfazenu, nawet do 40%.
Mechanizm formacji
Mechanizm powyższej reakcji nie został wyjaśniony, ale zasugerowano, że PCl 5 występuje w postaci jonowej [PCl 4 ] + [PCl 6 ] − a reakcja przebiega poprzez atak nukleofilowy [PCl 4 ] + przez NH 3 (z dysocjacji [NH4 ] Cl ). Eliminacja HCl (głównego produktu ubocznego) tworzy reaktywny nukleofilowy związek pośredni
- NH 3 + [PCl 4 ] + → HN = PCl 3 + HCl + H +
który poprzez dalszy atak [PCl 4 ] + i późniejszą eliminację HCl tworzy rosnący acykliczny związek pośredni
- HN=PCl 3 + [PCl 4 ] + → [Cl 3 P−N=PCl 3 ] + + HCl
- NH 3 + [Cl 3 P−N=PCl 3 ] + → HN=PCl 2 −N=PCl 3 + HCl + H + itd .
aż do ostatecznego ataku wewnątrzcząsteczkowego, który doprowadzi do powstania jednego z cyklicznych oligomerów.
Reakcje
Zastępstwo w P
Heksachlorofosfazen łatwo reaguje z alkoholanami i amidami metali alkalicznych .
Nucelofilowa polisubstytucja chlorku alkoholanem przebiega poprzez przemieszczenie chlorku w oddzielnych centrach fosforu :
- (NPCl 2 ) 3 + 3 NaOR → (NPCl(OR)) 3 + 3 NaCl
- (NPCl(OR)) 3 + 3 NaOR → (NP(OR) 2 ) 3 + 3 NaCl
Obserwowana regioselektywność jest spowodowana połączonymi efektami sterycznymi i π-backdonation samotnej pary tlenu (która dezaktywuje już podstawione atomy P).
Polimeryzacja z otwarciem pierścienia
Ogrzanie heksachlorofosfazenu do ok . 250 °C indukuje polimeryzację. Tetramer również polimeryzuje w ten sposób, chociaż wolniej. Konwersja jest rodzajem polimeryzacji z otwarciem pierścienia (ROP). Stwierdzono, że mechanizm ROP jest katalizowany przez kwasy Lewisa , ale ogólnie nie jest dobrze poznany. Długotrwałe ogrzewanie polimeru w wyższych temperaturach ( ok . 350°C) spowoduje depolimeryzację .
Struktura nieorganicznego produktu chloropolimerowego ( polidichlorofosfazenu ) obejmuje liniowy łańcuch – (N=P(−Cl) 2 −) n , gdzie n ~ 15000. Po raz pierwszy zaobserwowano go pod koniec XIX wieku, a jego postać po usieciowaniu łańcucha został nazwany „kauczukiem nieorganicznym” ze względu na swoje właściwości elastomerowe .
Ten produkt polidichlorofosfazenowy jest materiałem wyjściowym dla szerokiej klasy związków polimerowych, zwanych łącznie polifosfazenami . Zastąpienie grup chlorkowych innymi grupami nukleofilowymi, zwłaszcza alkoholanami , jak przedstawiono powyżej, daje liczne scharakteryzowane pochodne.
Zasadowość Lewisa
Centra azotowe heksachlorofosfazenu są słabo zasadowe i sugeruje się, że to zachowanie zasady Lewisa odgrywa rolę w mechanizmie polimeryzacji. W szczególności doniesiono, że heksachlorofosfazen tworzy addukty o różnej stechiometrii z kwasami , , Lewisa AICI3 AlBr3 , , GaCl3 SO3 , TaCl5 VOCl3 , wydziela ale nie z produktu BCl3 .
Wśród nich najlepiej scharakteryzowane strukturalnie są addukty 1:1 z trichlorkiem glinu lub z trichlorkiem galu; znajdują się z atomem Al / Ga związanym z N i przyjmują bardziej wyraźnie zniekształconą konformację krzesła w porównaniu z wolnym heksachlorofosfazenem. Addukty wykazują również fluktuacyjne w roztworze w temperaturach do -60 ° C, co można monitorować za pomocą 15 N i 31 P-NMR .
Odczynnik sprzęgający
Heksachlorofosfazen znalazł również zastosowanie w badaniach, umożliwiając aromatyczne reakcje sprzęgania między pirydyną a N , N -dialkiloanilinami lub indolem , w wyniku czego powstają pochodne fenylopirydyny podstawione w pozycji 4,4 ', co do których postuluje się, że przechodzą przez pośrednią sól cyklofosfazenowo-pirydyniową.
Związek może być również stosowany jako odczynnik sprzęgający peptydy do syntezy oligopeptydów w chloroformie, chociaż w tym zastosowaniu zwykle bardziej skuteczny okazuje się tetramer oktachlorotetrafosfazen.
Degradacja fotochemiczna
Zarówno trimer, jak i tetramer w roztworach węglowodorów reagują fotochemicznie , tworząc klarowne ciecze identyfikowane jako pochodne podstawione alkilem (NPCl 2- x R x ) n , gdzie n = 3, 4. Takie reakcje zachodzą przy przedłużonym oświetleniu UVC ( łuk rtęciowy ) bez wpływu na P n N n pierścieni. Stałe warstwy trimeru i tetrameru nie ulegną żadnym zmianom chemicznym w takich warunkach napromieniowania.
Aplikacje
Pochodne heksalkoksyfosfazenu
Heksalkoksyfosfazeny (zwłaszcza gatunki aryloksy ), powstałe w wyniku nukleofilowego podstawienia heksachlorofosfazenowego atomów P, są cenione ze względu na ich wysoką stabilność termiczną i chemiczną oraz niską temperaturę zeszklenia . Niektóre heksalkoksyfosfazeny (takie jak pochodna heksa-fenoksy) zostały wprowadzone do użytku komercyjnego jako materiały ognioodporne i smary wysokotemperaturowe.
Pochodne polifosfazenu
Polifosfazeny otrzymywane ze spolimeryzowanego heksachlorofosfazenu ( polidichlorofosfazenu ) wzbudziły zainteresowanie w dziedzinie polimerów nieorganicznych i badań sondujących właściwości pochodnych elastomerowych i termoplastycznych . Niektóre z nich wydają się obiecujące do przyszłych zastosowań jako wysokowydajne materiały tworzące włókna lub membrany, ponieważ łączą przezroczystość, szkieletu , regulowaną hydrofilowość lub hydrofobowość oraz różne inne pożądane właściwości .
Obecne komercyjne zastosowania elementów z kauczuku polifosfazenowego to pierścienie o-ring , przewody paliwowe i amortyzatory , gdzie polifosfazeny nadają ognioodporność, nieprzepuszczalność dla olejów i elastyczność nawet w bardzo niskich temperaturach.
Dalsza lektura
- Odkrycie cyklofosfazenów: Liebig-Wöhler, Briefwechsel tom. 1, 63; Ann. chemia (Liebig), tom. 11 (1834), 146.
- Pierwsze doniesienia o ich polimeryzacji: HN Stokes (1895), O chloroazotkach fosforu . American Chemical Journal, tom. 17, str. 275.HN Stokes (1896), O kwasie trimetafosfimowym i produktach jego rozkładu. American Chemical Journal, tom. 18 zeszyt 8, s. 629.
- Przykład syntezy heksalkoksyfosfazenu z heksachlorofosfazenu i opis struktury: Allcock, Harry R.; Ngo, Dennis C.; Parwez, Masud; Whittle, Robert R.; Birdsall, William J. (1991-03-01). „Syntezy i struktury cyklicznych i krótkołańcuchowych liniowych fosfazenów zawierających grupy boczne 4-fenylofenoksy” . Dziennik Amerykańskiego Towarzystwa Chemicznego . 113 (7): 2628–2634. doi : 10.1021/ja00007a041 . ISSN 0002-7863 .
- Nowa synteza heksalkoksyfosfazenu nie wychodząca z heksachlorofosfazenu: Ye, Chengfeng; Zhang, Zefu; Liu, Weimin (2002-01-01). „Nowa synteza heksapodstawionych cyklotrifosfazenów” . Komunikaty syntetyczne . 32 (2): 203–209. doi : 10.1081/SCC-120002003 . ISSN 0039-7911 . S2CID 97319633 .


