wigabatryna
 | |
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Sabril, Vigadrone |
| Inne nazwy | γ-winylo-GABA |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a610016 |
| Kategoria ciąży |
|
Drogi podania |
Ustami |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Biodostępność | 80–90% |
| Wiązanie białek | 0% |
| Metabolizm | nie metabolizowany |
| Okres półtrwania w fazie eliminacji | 5-8 godzin u młodych dorosłych, 12-13 godzin u osób starszych. |
| Wydalanie | Nerkowy |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| Bank Leków | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA | 100.165.122 |
| Dane chemiczne i fizyczne | |
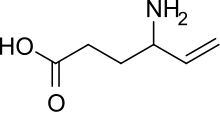
| Formuła | C6H11NO2 _ _ _ _ _ _ |
| Masa cząsteczkowa | 129,159 g·mol -1 |
| Model 3D ( JSmol ) | |
| Temperatura topnienia | 171 do 177 ° C (340 do 351 ° F) |
| |
| |
Wigabatryna , marka Sabril , to lek stosowany w leczeniu padaczki . Stał się dostępny jako lek generyczny w 2019 roku.
Działa poprzez hamowanie rozkładu kwasu γ-aminomasłowego (GABA). Jest również znany jako γ-winylo-GABA i jest strukturalnym analogiem GABA, ale nie wiąże się z receptorami GABA .
Zastosowania medyczne
Padaczka
W Kanadzie wigabatryna jest dopuszczona do stosowania jako leczenie wspomagające (z innymi lekami) w leczeniu padaczki opornej na leczenie , złożonych napadów częściowych , napadów wtórnie uogólnionych oraz do stosowania w monoterapii napadów drgawkowych u dzieci w zespole Westa .
Od 2003 r. wigabatryna jest zatwierdzona w Meksyku do leczenia padaczki, której nie można w zadowalający sposób kontrolować za pomocą terapii konwencjonalnej (terapia wspomagająca lub monoterapia) lub u pacjentów niedawno zdiagnozowanych, którzy nie próbowali innych leków (monoterapia).
Wigabatryna jest również wskazana do stosowania w monoterapii we wtórnie uogólnionych napadach toniczno-klonicznych , napadach częściowych oraz w napadach drgawkowych u dzieci w przebiegu zespołu Westa.
W dniu 21 sierpnia 2009 r. Firma Lundbeck ogłosiła, że amerykańska Agencja ds. Żywności i Leków wydała dwa zezwolenia na nowy wniosek o lek dla wigabatryny. Lek jest wskazany w monoterapii u dzieci i młodzieży w wieku od 1 miesiąca do 2 lat z napadami drgawkowymi wieku dziecięcego , u których potencjalne korzyści przewyższają potencjalne ryzyko utraty wzroku, oraz jako terapia wspomagająca u dorosłych pacjentów z opornymi na leczenie złożonymi napadami częściowymi ( CPS), którzy niewłaściwie zareagowali na kilka alternatywnych metod leczenia i dla których potencjalne korzyści przewyższają ryzyko utraty wzroku.
W 1994 roku Feucht i Brantner-Inthaler donieśli, że wigabatryna zmniejszała napady padaczkowe o 50-100% u 85% dzieci z zespołem Lennoxa-Gastauta , u których wyniki leczenia walproinianem sodu były słabe .
Inni
Wigabatryna zmniejszała objawy lęku napadowego wywołane tetrapeptydem cholecystokininy , oprócz podwyższonego poziomu kortyzolu i ACTH u zdrowych ochotników.
Wigabatryna jest również stosowana w leczeniu napadów w niedoborze dehydrogenazy semialdehydu bursztynowego (SSADHD), który jest wrodzonym defektem metabolizmu GABA, który powoduje niepełnosprawność intelektualną , hipotonię , drgawki , zaburzenia mowy i ataksję poprzez nagromadzenie kwasu γ-hydroksymasłowego ( GHB ). Wigabatryna pomaga obniżyć poziom GHB poprzez hamowanie transaminazy GABA. Jednak dzieje się to tylko w mózgu; nie ma wpływu na obwodową transaminazę GABA, więc GHB wciąż się gromadzi i ostatecznie dociera do mózgu.
Niekorzystne skutki
Ośrodkowy układ nerwowy
Senność (12,5%), ból głowy (3,8%), zawroty głowy (3,8%), nerwowość (2,7%), depresja (2,5%), zaburzenia pamięci (2,3%), podwójne widzenie (2,2%), agresja (2,0%), ataksja (1,9%), zawroty głowy (1,9%), nadpobudliwość (1,8%), utrata wzroku (1,6%) (patrz poniżej), dezorientacja (1,4%), bezsenność (1,3%), zaburzenia koncentracji (1,2%), problemy z osobowością ( 1,1%). Spośród 299 dzieci 33 (11%) stało się nadpobudliwe.
U niektórych pacjentów w trakcie leczenia wigabatryną rozwija się psychoza , która występuje częściej u dorosłych niż u dzieci. Może się to zdarzyć nawet u pacjentów bez wcześniejszej historii psychozy. Inne rzadkie działania niepożądane ze strony ośrodkowego układu nerwowego obejmują niepokój, chwiejność emocjonalną , drażliwość, drżenie, nieprawidłowy chód i zaburzenia mowy .
żołądkowo-jelitowy
Ból brzucha (1,6%), zaparcia (1,4%), wymioty (1,4%) i nudności (1,4%). W badaniach klinicznych niestrawność i zwiększony apetyt wystąpiły u mniej niż 1% pacjentów.
Ciało jako całość
Zmęczenie (9,2%), zwiększenie masy ciała (5,0%), astenia (1,1%).
Teratogenność
Badanie teratologiczne przeprowadzone na królikach wykazało, że dawka 150 mg/kg/dobę spowodowała rozszczep podniebienia u 2% szczeniąt, a dawka 200 mg/kg/dobę u 9%. Może to być spowodowane spadkiem metioniny , zgodnie z badaniem opublikowanym w marcu 2001 r. W 2005 r. opublikowano badanie przeprowadzone na Uniwersytecie w Katanii, w którym stwierdzono, że szczury, których matki spożywały 250–1000 mg/kg mc./dzień, miały uboższe wydajności w labiryncie wodnym i zadaniach na otwartym polu, szczury w grupie 750 mg miały niedowagę po urodzeniu i nie dogoniły grupy kontrolnej, a szczury w grupie 1000 mg nie przeżyły ciąży.
Do tej pory nie ma kontrolowanych danych dotyczących teratologii u ludzi.
Sensoryczny
W 2003 roku Frisén i Malmgren wykazali, że wigabatryna powoduje nieodwracalny rozlany zanik warstwy włókien nerwowych siatkówki w retrospektywnym badaniu 25 pacjentów. Ma to największy wpływ na obszar zewnętrzny (w przeciwieństwie do plamki żółtej lub obszaru centralnego) siatkówki. Wady pola widzenia zostały zgłoszone już w 1997 roku przez Toma Eke i innych w Wielkiej Brytanii. Niektórzy autorzy, w tym Comaish i in. uważają, że utrata pola widzenia i zmiany elektrofizjologiczne mogą być widoczne nawet u 50% użytkowników Vigabatryny.
Toksyczne działanie wigabatryny na siatkówkę można przypisać niedoborowi tauryny .
Ze względów bezpieczeństwa program Vigabatrin REMS jest wymagany przez FDA w celu zapewnienia świadomych decyzji przed rozpoczęciem i zapewnienia właściwego stosowania tego leku.
Interakcje
Badanie opublikowane w 2002 roku wykazało, że wigabatryna powoduje statystycznie istotny wzrost klirensu osoczowego karbamazepiny .
W 1984 roku dr Rimmer i Richens z University of Wales donieśli, że podawanie wigabatryny z fenytoiną obniżyło stężenie fenytoiny w surowicy u pacjentów z padaczką oporną na leczenie. Pięć lat później tych samych dwóch naukowców zgłosiło spadek stężenia fenytoiny o 23% w ciągu pięciu tygodni w artykule opisującym nieudaną próbę wyjaśnienia mechanizmu tej interakcji.
Farmakologia
Wigabatryna jest nieodwracalnym inhibitorem aminotransferazy kwasu gamma-aminomasłowego (GABA-AT), enzymu odpowiedzialnego za katabolizm GABA . Hamowanie GABA-AT powoduje zwiększenie poziomu GABA w mózgu. Wigabatryna jest racemicznym , a jej enancjomer [S] jest aktywny farmakologicznie. ,
Farmakokinetyka
W przypadku większości leków okres półtrwania w fazie eliminacji jest użytecznym wskaźnikiem schematów dawkowania i czasu potrzebnego do osiągnięcia stężenia w stanie stacjonarnym . W przypadku wigabatryny stwierdzono jednak, że okres półtrwania aktywności biologicznej jest znacznie dłuższy niż okres półtrwania w fazie eliminacji.
W przypadku wigabatryny nie ma zakresu stężeń docelowych, ponieważ badacze nie stwierdzili różnic między poziomami stężenia w surowicy osób reagujących i niereagujących. Zamiast tego uważa się, że czas działania jest bardziej funkcją szybkości resyntezy GABA-T; poziomy GABA-T zwykle nie wracają do normalnego stanu aż do sześciu dni po odstawieniu leku.
Historia
Wigabatryna została opracowana w latach 80. XX wieku w celu zwiększenia stężenia GABA w mózgu w celu zatrzymania napadu padaczkowego. Aby to zrobić, lek został zaprojektowany tak, aby nieodwracalnie hamował transaminazę GABA, która rozkłada substrat GABA. Chociaż lek został dopuszczony do leczenia w Wielkiej Brytanii w 1989 r., autoryzowane stosowanie wigabatryny przez Amerykańską Agencję ds. efekty nie były widoczne w badaniach na ludziach, więc projekt leku był kontynuowany. W 1997 roku próby zostały tymczasowo zawieszone, ponieważ wiązały się z wadami obwodowego pola widzenia u ludzi.
Społeczeństwo i kultura
Nazwy marek
Wigabatryna jest sprzedawana jako Sabril w Kanadzie, Meksyku i Wielkiej Brytanii. Marka w Danii to Sabrilex. Sabril został zatwierdzony w Stanach Zjednoczonych 21 sierpnia 2009 r. I jest sprzedawany w USA przez firmę Lundbeck Inc., która w marcu 2009 r. Przejęła firmę Ovation Pharmaceuticals, sponsora w USA.
Ogólne odpowiedniki
16 stycznia 2019 r. Food and Drug Administration zatwierdziła pierwszą generyczną wersję Sabril (wigabatryna) w Stanach Zjednoczonych.
Linki zewnętrzne
- „Wigabatryna” . Portal informacyjny o lekach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.
