Borowodorek amoniaku
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
Ammoniotrihydroboran [ potrzebne źródło ]
|
|
| Inne nazwy Borazan [ potrzebne źródło ]
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.170.890 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
|
BNH 6 |
|
| Masa cząsteczkowa | 30,865 g mol -1 |
| Wygląd | Bezbarwne kryształy |
| Gęstość | 780 mg ml -1 |
| Temperatura topnienia | 104 ° C (219 ° F; 377 K) |
| Struktura | |
| I4mm, czworokątny | |
| Czworokąt w B i N | |
| Tetrahydral w B i N | |
| 5,2 D | |
| Zagrożenia | |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| Związki pokrewne | |
|
Związki pokrewne
|
|
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
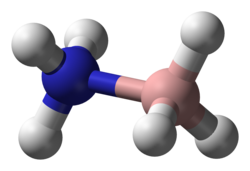
Amoniak boran (również systematycznie nazywany amminetrihydridoboronem ), zwany także borazanem , jest związkiem chemicznym o wzorze H 3 NBH 3 . Bezbarwne lub białe ciało stałe jest najprostszym molekularnym związkiem boru - azotu - wodorku . Przyciągnął uwagę jako źródło paliwa wodorowego , ale poza tym ma głównie znaczenie akademickie.
Synteza
Reakcja diboranu z amoniakiem daje głównie sól diamonianową [H 2 B(NH 3 ) 2 ] + (BH 4 ) − . Amoniak boran jest głównym produktem, gdy addukt boranu jest stosowany zamiast diboranu:
- BH 3 ( THF ) + NH 3 → BH 3 NH 3 + THF
Właściwości i struktura
Cząsteczka przyjmuje strukturę podobną do etanu , z którym jest izoelektroniczna . Odległość B-N wynosi 1,58(2) Å. Odległości B-H i N-H wynoszą odpowiednio 1,15 i 0,96 Å. Jego podobieństwo do etanu jest wątpliwe, ponieważ boran amoniaku jest ciałem stałym, a etan jest gazem: ich temperatury topnienia różnią się o 284 ° C. Ta różnica jest zgodna z wysoce polarną naturą boranu amoniaku. Atomy H przyłączone do boru są wodorkowe, a atomy azotu są nieco kwaśne.
Struktura bryły wskazuje na ścisłe powiązanie centrów NH i BH . Najbliższa odległość H-H wynosi 1,990 Å, co można porównać z odległością wiązania H-H wynoszącą 0,74 Å. To oddziaływanie nazywa się wiązaniem diwodorowym . Oryginalna analiza krystalograficzna tego związku odwróciła przypisania B i N. Zaktualizowana struktura została uzyskana z ulepszonymi danymi przy użyciu techniki dyfrakcji neutronów , która umożliwiła zlokalizowanie atomów wodoru z większą precyzją.
| Cząsteczka | Borowodorek amoniaku | aminoboran | iminoboran |
|---|---|---|---|
| Formuła | BNH 6 | BNH 4 | BNH 2 |
| Klasa | amina-boran | aminoboran | iminoboran |
| Analogiczny węglowodór | etan | etylen | acetylen |
| Analogiczna klasa węglowodorów | alkan | alken | alkin |
| Struktura |
|
|

|
| Model typu kula i kij |

|

|
|
| Hybrydyzacja boru i azotu | sp 3 | sp 2 | sp |
| Długość wiązania BN | 1,658 Å | 1,391 Ł | 1,238 Å |
| Udział pojedynczego wiązania BN | 100% | 84% | 75% |
| Metoda wyznaczania struktury | spektroskopia mikrofalowa | spektroskopia mikrofalowa | spektroskopia w podczerwieni |
Używa
Sugerowano, że boran amoniaku jest środkiem magazynującym wodór , np. gdy gaz jest używany do napędzania pojazdów silnikowych. Można go zmusić do uwalniania wodoru podczas ogrzewania, polimeryzując najpierw do (NH 2 BH 2 ) n , a następnie do (NHBH) n , który ostatecznie rozkłada się do azotku boru (BN) w temperaturach powyżej 1000 °C. Ma większą gęstość wodoru niż ciekły wodór, a także może istnieć w normalnych temperaturach i ciśnieniach.
Boran amoniaku znajduje pewne zastosowanie w syntezie organicznej jako stabilna w powietrzu pochodna diboranu.
Analogiczne aminy-borowodory
Wiele analogów zostało przygotowanych z amin pierwszorzędowych, drugorzędowych, a nawet trzeciorzędowych :
- Boran tert-butyloamina ( t BuNH 2 →BH 3 )
- Trimetyloamina boranu (Me 3 N→BH 3 )
- Izopropyloamina boranu ( i PrNH2→BH 3 )
Pierwszy aminowy addukt boranu pochodził z trimetyloaminy . Kompleks tert-butyloaminy boranu wytwarza się w reakcji borowodorku sodu z chlorkiem t-butyloamonu. Generalnie addukty są bardziej wytrzymałe z bardziej zasadowymi aminami. Możliwe są również odmiany składnika boru, chociaż pierwotne i wtórne borany są mniej powszechne.
Zobacz też
- Fosforowo-boran (R 3 P→BH 3 )
- siarczek dimetylu boranu (Me 2 S→BH 3 )
- boran–tetrahydrofuran (THF→BH 3 )

![Part of the crystal structure of ammonia borane[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/93/Ammonia-borane-xtal-3D-balls.png/300px-Ammonia-borane-xtal-3D-balls.png)