Torowirus

|
|
| Torowirus | |
|---|---|
| Mikrografia elektronowa wirionu i struktura końskiego torowirusa | |
| Klasyfikacja wirusów | |
| (nierankingowe): | Wirus |
| królestwo : | Rybowiria |
| Królestwo: | Orthornawirusy |
| Gromada: | Pisuviricota |
| Klasa: | Pisoniviricetes |
| Zamówienie: | Nidowirusy |
| Rodzina: | Tobaniviridae |
| Podrodzina: | Torovirinae |
| Rodzaj: | Torowirus |
| Gatunek | |
|
|
Torovirus to rodzaj otoczkowych wirusów RNA o dodatniej nici z rzędu Nidovirales i rodziny Tobaniviridae . Zakażają głównie kręgowce , zwłaszcza bydło, świnie i konie. Choroby związane z tym rodzajem obejmują zapalenie żołądka i jelit , które często występuje u ssaków. Torovirus jest jedynym rodzajem w monotypowej podrodzinie Torovirinae . Torowirus jest również taksonem monotypowym, zawierającym tylko jeden podrodzaj, renitowirus .
Odkrycie pierwszego torowirusa datuje się na lata 70. XX wieku. Koński torowirus (EToV) został przypadkowo wykryty w próbce z odbytu konia, który cierpiał na ostrą biegunkę . Torowirus bydlęcy „Breda” został później wykryty w 1979 roku podczas śledztwa na farmie mlecznej w Bredzie. Mieli kilka cieląt cierpiących na ciężką biegunkę przez wiele miesięcy. W 1984 roku wykryto cząstki podobne do torowirusa za pomocą mikroskopu elektronowego (EM) u ludzi z zapaleniem żołądka i jelit.
Wirusologia
Struktura
Torowirusy (ToV) to jednoniciowe wirusy RNA, które mają otoczkę zawierającą peplomer, często skorelowaną z infekcjami jelitowymi u bydła i prawdopodobnie u ludzi. Wydaje się, że wirusy te występują na całym świecie, zgłaszano występowanie Świadczeń z krajów na różnych kontynentach, takich jak Europa, Ameryka, Nowa Zelandia i Afryka Południowa. Cząsteczki torowirusa zazwyczaj posiadają helikalny i symetryczny nukleokapsyd który jest zwinięty w wydrążony cylindryczny kształt. Średnica wynosi około 23 nm przy średniej długości 104 nm, gdzie każdy cykl obrotu odbywa się w odstępach co 4,5 nm. ToV są pleomorficzne, o wielkości w zakresie od 100 nm do 150 nm z maczugowatymi wyrostkami rozciągającymi się od kapsydu. torowirusów odkryto również nukleokapsyd w kształcie pączka o spiralnej symetrii . Wśród różnych gatunków torowirusów , tylko koński torowirus (EToV) może być hodowany w pożywce do hodowli komórkowej, dzięki czemu EToV zostały najszerzej zbadane. Informacje z badań immunofluorescencyjnych i morfologii komórek jelitowych bydlęcych torowirusów (BToV) wykazały podobieństwa między EToV i BToV. Torowirusy mają pewne wspólne cechy z członkami pokrewnej rodziny Coronaviridae, ponieważ są okrągłymi, pleomorficznymi wirusami otoczkowymi o średnicy około 120 do 140 nm .
Genom
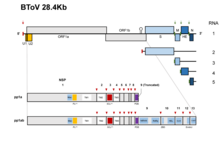
Torowirusy mają pojedynczy fragment jednoniciowego RNA o dodatniej polaryzacji . Ich całkowita długość wynosi około 25-30 kb i posiadają złożone mechanizmy replikacji, które obejmują wykorzystanie subgenomowego mRNA , rybosomalnego przesunięcia ramki odczytu i jąkania polimerazy . Długość genomowa bydlęcego torowirusa wynosi około 28,5 kb i składa się głównie z jednego genu, genu replikazy (20,2 kb). Ten gen zawiera dwie otwarte ramki odczytu , ORF1a i ORF1b, który koduje białka pp1a i pp1b. Pierwszą sekwencję genomową PToV (torowirusa świńskiego) wykonano w Szanghaju w Chinach w 2014 roku. Stwierdzono, że długość genomu torowirusa świńskiego wynosi 28301 pz i wykazuje 79% identyczności sekwencji z genomem bydlęcego torowirusa.
Koło życia
Bydło, świnie i konie są naturalnymi żywicielami torowirusów i uważa się, że infekcja odbywa się drogą fekalno-oralną .
Genom Torowirusa koduje różne białka strukturalne, takie jak kolce (S), białka błonowe (M), esterazę hemaglutyniny (HE) i nukleokapsyd (N), co zapewnia im charakterystykę strukturalną niezbędną do infekcji i zakończenia ich cyklu życiowego. Pierwsze trzy regiony kodujące białka są usunięte w gatunkach BEV, co umożliwia im wzrost w hodowli komórkowej, podczas gdy inne gatunki nie są w stanie rosnąć w hodowli komórkowej. Początkowe dwie trzecie genomu torowirusa ma dwie otwarte ramki odczytu , ORF1a i ORF1b. ORFb1 zawiera domenę kodującą enzymy, takie jak polimeraza RNA zależna od RNA (RdRp) i helikazy (Hel), które są niezbędne do transkrypcji i translacji wirusa.
Cykl życiowy torowirusów obejmuje replikację w zakażonej komórce gospodarza. Wirusy te pączkują głównie do światła cysterny Golgiego w cytoplazmie . EToV można zobaczyć w różnych częściach aparatu Golgiego , a także w obszarach zewnątrzkomórkowych. Nukleokapsydy tych wirusów w obszarze zewnątrzkomórkowym mają charakterystyczny kształt torusa, podczas gdy te nukleokapsydy mają kształt pręta przed pączkowaniem do komórki gospodarza, co wskazuje na pewne zmiany morfologiczne zachodzące w fazie dojrzewania wirusa. Ponadto stwierdzono, że nukleokapsydy BToV i EToV również gromadzą się w jądrze zakażonej komórki.
Objawy kliniczne i diagnoza
U bydła choroba powoduje biegunkę i objawy ogólnoustrojowe, takie jak gorączka , letarg i jadłowstręt. U cieląt może powodować objawy neurologiczne, aw niektórych przypadkach prowadzić do śmierci. Obecnie dostępnych jest wiele technik diagnostycznych zakażenia torowirusem w próbkach klinicznych, takich jak hemaglutynacja (HA), test immunoenzymatyczny ( ELISA ), elektronowa mikroskopia immunologiczna, testy hamowania hemaglutynacji (HA/HI) i hybrydyzacja kwasów nukleinowych. Przeważnie torowirusy infekujące ludzi są prawdopodobnie blisko spokrewnione z BRV lub BEV i odnoszą się do jakiejkolwiek wcześniejszej historii niektórych jelit lub infekcja. Jest to również powód, dla którego techniki molekularne są uważane za bardziej obiecujące niż testy serologiczne. Świnie mogą zostać zarażone, nie wykazując żadnych oznak i objawów, które są fizycznie widoczne. [ potrzebne źródło ]
Diagnoza infekcji wirusowej obejmuje mikroskopię elektronową , test ELISA lub hamowanie hemaglutynacji . [ potrzebne źródło ]
Leczenie i kontrola
Można zastosować leczenie wspomagające, aby zapobiec odwodnieniu i wtórnym infekcjom. Kontrola opiera się na dobrych bezpieczeństwa biologicznego , w tym na szybkiej izolacji i dezynfekcji lokali. Ponieważ infekcje torowirusowe zwykle wiążą się z ciężką biegunką, często prowadziło to do odwodnienia. Najczęstsze leczenie obejmuje podawanie płynnych terapii młodszym pacjentom, ponieważ infekcja występuje najczęściej u młodszej populacji ludzkiej, a także u bydła. Nie ma jako takich konkretnych środków zapobiegawczych dla kontroli infekcji Torovirus. Dobre praktyki higieny i bezpieczeństwa biologicznego są skuteczne w zapobieganiu zakażeniu torowirusem. Co więcej, siara zawierająca przeciwciała może być podawana pacjentom w szacunkowej dawce 500ml/dzień. Najczęściej badany naturalny przebieg infekcji występuje u bydła, ponieważ pochodzenie wirusa jest związane z chorobą jelitową u bydła. W eksperymencie związanym z infekcją bydła dały wyniki, że wirus powszechnie przenosi się w konwencjonalnych warunkach. Początkowe objawy u cieląt wskazywały na rozwój biegunki w pierwszych 2-3 dniach zakażenia. Większość cieląt miała łagodną postać odwodnienia , a u kilku rozwinęła się łagodna gorączka. Jednak żaden z przypadków nie wymagał interwencji terapeutycznej i był leczony zwykle zmianą diety zakażonych cieląt. Badania przeprowadzone przez (Vanopdenbosch i in., 1992a) opublikowały badanie, że infekcje dróg oddechowych torowirusem pojawiają się głównie w pierwszym miesiącu życia i od 4 do 6 miesiąca życia w szczycie sezonu jesiennego. We wszystkich tych infekcjach około 25% infekcji prowadzi do nagłej śmierci. Oprócz innych przyczyn, takich jak biegunka, zapalenie płuc i problemy z oddychaniem, centralny układ nerwowy podobne objawy zgłaszano również w niektórych przypadkowych przypadkach. Badania ujawniają również, że młode cielęta zakażone torowirusem wymagają płynoterapii, ponieważ ich zimne ciało jest narażone na poważne odwodnienie podczas infekcji. Jednak dorosłe osobniki wracają do zdrowia dzięki odpowiedzi immunologicznej bez żadnego zewnętrznego leczenia, jeśli nie występują żadne dodatkowe infekcje. Wielu badaczy sugeruje również, że dezynfekcja i sterylizacja termiczna mogą z łatwością zniszczyć wirusa, ale jak dotąd nie są dostępne żadne dane naukowe ani doniesienia o takich wynikach. [ potrzebne źródło ]
Ludzki torowirus
W 1984 roku u ludzi z zapaleniem żołądka i jelit lub ciężką biegunką zaobserwowano cząsteczki podobne do torowirusa. Następnie zaczęło pojawiać się wiele studiów przypadku z różnych części świata. Cząsteczki podobne do torowirusów (ToVL) odnotowano w badaniach naukowych z USA, Francji, Holandii, Kanady, Wielkiej Brytanii, Indii i Brazylii. Obecność ToVL zgłaszano głównie u dzieci i dorosłych z ciężką biegunką. Termin ludzki torowirus (HuTV) jest często używany do opisania cząstek ToVL. [ potrzebne źródło ]
Ponieważ istnieje wiele podobieństw w HuTV i BoTV, istnieją pewne kryteria, których przestrzega się przy wykrywaniu i różnicowaniu obu szczepów. W przeszłości przeprowadzono liczne badania mające na celu powiązanie torowirusów i ich patogeniczności. Torowirusy wykryto w różnych chorobach jelitowych zarówno u dzieci, jak iu dorosłych. Badanie wydalania torowirusa z kałem wykazało, że spośród 206 zbadanych przypadków, w około 72 (35%) przypadkach wykryto torowirusa. W porównaniu z infekcjami rotawirusami czy torowirusami torowirusy częściej stwierdzano u osób z obniżoną odpornością. Infekcje torowirusowe charakteryzowały się zmniejszonymi wymiotami i zwiększoną krwawą biegunką. Odpowiedź immunologiczna układu odpornościowego rozwijała się głównie u dorosłych dzieci, które nie miały upośledzonej odporności.
Oprócz zapalenia żołądka i jelit torowirusy wykryto również u niemowląt z martwiczym zapaleniem jelit . Jednak w tym samym badaniu ciężkość choroby i śmiertelność nie miały większego wpływu u pacjentów z torowirusem w porównaniu z pacjentami, u których wynik testu na obecność torowirusa był ujemny. [ potrzebne źródło ]
Właściwości antygenowe i patogeniczność
Proponuje się, aby bydlęce torowirusy miały głównie dwa różne serotypy: bydlęcy torowirus serotyp 1 (BoTV-1) i bydlęcy torowirus serotyp 2 (BoTV-2). Oba serotypy BoTV posiadają hemaglutyninę , która reaguje z erytrocytami myszy i szczurów, ale nie z ludzkimi erytrocytami . BoTV nie eluuje z erytrocytów szczura po 90 minutach w temperaturze 36°C. Oba serotypy bydlęcego torowirusa posiadają hemaglutyninę, która zwykle reaguje z krwinkami czerwonymi u gryzoni. Jak dotąd żadne dowody nie sugerują takiej reakcji z ludzkimi erytrocytami. Chociaż wiele ostatnich badań wykazało obecność torowirusa u ludzi w związku z wieloma innymi infekcjami jelitowymi, biegunką i stanami takimi jak zapalenie żołądka i jelit. [ potrzebne źródło ]
Dokładny mechanizm, za pomocą którego wirus wywołuje biegunkę, jest obecnie nieznany, ale badania ujawniają, że może to być spowodowane infekcją i obumieraniem komórek jelita cienkiego i krypt kosmków, a także enterocytów krypt powierzchniowych w jelicie grubym. Mówi się również, że wodnista biegunka może być spowodowana zmianami w okrężnicy, które prowadzą do zmniejszenia wchłaniania wody przez komórki jelita grubego. Patogeniczność obecności torowirusa była szeroko badana i badana u bydła, zwłaszcza cieląt w początkowej fazie życia w wieku około 4 do 6 miesięcy. Gdy BoTV zostanie zaszczepiony przez zwierzę doustnie lub donosowo, zaraża nabłonkowych kosmków, a następnie rozciąga się na elementy układu pokarmowego, takie jak jelito grube w kryptach jelita czczego , jelita krętego i okrężnicy. Ostatecznie prowadzi to do biegunki w ciągu 24–72 godzin od zakażenia. Antygeny BToV odnotowano również w komórkach nabłonka kopuły i komórkach Microfold , obecnych w tkance limfatycznej związanej z jelitami kępki Peyera w jelicie cienkim. Niektórzy badacze sugerują, że BToV infekuje tylko enterocyty chłonne. Jednak są badacze, którzy również sugerują, że replikacja wirusa może rozpocząć się w niedojrzałych komórkach nabłonkowych krypt i może dalej rozprzestrzeniać się do kosmków.
Historia
Odkrycie pierwszego torowirusa datuje się na lata 70. XX wieku. Koński torowirus (EToV) został przypadkowo wykryty w próbce z odbytu konia, który miał ostrą biegunkę . Torowirus bydlęcy „Breda” został później wykryty w 1979 roku podczas śledztwa na farmie mlecznej w Bredzie. Mieli kilka cieląt, które od miesięcy miały ostrą biegunkę. mikroskopu elektronowego wykryto cząsteczki podobne do torowirusów (EM) u ludzkich pacjentów z zapaleniem żołądka i jelit. W 1972 roku w Bernie w Szwajcarii wyizolowano wirusa z konia. Wirus nie reagował z antysurowicami przeciwko znanym wirusom końskim i wykazano, że ma unikalną morfologię i podstrukturę. W 1982 roku podobny, niesklasyfikowany wirus został wyizolowany z cieląt w Bredzie w stanie Iowa. W 1984 roku w kale człowieka odkryto cząsteczki przypominające te wirusy. Nowa rodzina wirusów — Toroviridae — została zaproponowana na VI Międzynarodowym Kongresie Taksonomii Wirusów w 1984 r. w Sendai w Japonii. Jednak rodzina jest obecnie przypisywana jako rodzina Tobaniviridae z podrodziną Torovirinae , zamów Nidovirales.
Taksonomia
Do niedawna torowirusom nie przypisywano żadnej rodziny. Niedawna analiza molekularna wirusa ujawniła jego podobieństwa do Arteriwirusa i koronawirusów, co doprowadziło do włączenia Torowirusa wraz z Arteriwirusem do wcześniej monogenicznych Coronaviridae. Obecnie torowirusy należą do rzędu Nidovirales , podrodziny Torovirinae , rodziny Tobaniviridae . Podobieństwa, podobieństwa molekularne i genetyczne, wirionów , powiązania behawioralne oraz inne charakterystyczne podobieństwa i różnice są obserwowane przez naukowców w celu klasyfikacji taksonomicznej wirusa. W przypadku torowirusów wirus berneński był szeroko badany na poziomie molekularnym w porównaniu z innymi członkami. w 1992 r Międzynarodowy Komitet Taksonomii Wirusów ICTV uzyskał wystarczająco dużo danych, aby rozważyć torowirusa w rodzinie koronawirusów ze względu na podobieństwa w strukturze, zachowaniu replikacji i sekwencjonowaniu genetycznym. [ potrzebne źródło ]
Ewolucja
Torowirusy, koronawirusy i arteriwirusy są w kolejności Nidovirales , grupa niesegmentowanych, jednoniciowych wirusów zwierzęcych o pozytywnym sensie. Pomimo różnic w wielkości ich genomu, różnym zakresie żywicieli i ich strategiach replikacji, podobieństwa w identyczności sekwencji replikazy między różnymi gatunkami rzędu Nidovirales zapewniają ich wspólne pochodzenie. Analiza sekwencji i porównanie polimerazy i helikazy domeny koronawirusów i torowirusów ujawniły 40-45% identycznych aminokwasów w obu rodzinach, dostarczając dowodów na duży dystans ewolucyjny między dwiema rodzinami.
- ^ „Historia taksonomii ICTV: torowirus ” . Międzynarodowy Komitet Taksonomii Wirusów (ICTV) . ICTV . Źródło 7 września 2020 r .
- ^ a b c d „Strefa wirusowa” . ExPASy . Źródło 15 czerwca 2015 r .
- ^ Encyklopedia biurowa ogólnej wirusologii . Boston: prasa akademicka. 2009. s. 507. ISBN 978-0-12-375146-1 .
- ^ Taksonomia wirusów: wydanie z 2018 r. , International Committee on Taxonomy of Viruses , pobrane 7 grudnia 2018 r .
- ^ Taksonomia wirusów: wydanie z 2018 r., International Committee on Taxonomy of Viruses, pobrane 7 grudnia 2018 r.
- ^ a b c Cho, KO i Hoet, AE (2014). Torowirusy (Coronaviridae). Moduł referencyjny w naukach biomedycznych, B978-0-12-801238-3.02674-X. https://doi.org/10.1016/B978-0-12-801238-3.02674-X
- Bibliografia _ _ _ _ _ org/10.1016/B978-012374410-4.00516-1 .
- ^ Weiss M, Horzinek M. Proponowana rodzina Toroviridae: czynniki infekcji jelitowych Arch Virol, 92 (1987), s. 1
- ^ Koopmans M, Horzinek M. Torowirusy zwierząt i ludzi (przegląd) Adv Virus Res, 43 (1994), s. 233
- ^ ab Zarządzanie ICTVdB (2006). 03.019.0.02. Torowirus. W: ICTVdB – The Universal Virus Database, wersja 4. Büchen-Osmond, C. (red.), Columbia University, Nowy Jork, USA
- ^ Hoet, AE i Horzinek, MC (2008). Torowirus. Encyklopedia wirusologii, 151–157. https://doi.org/10.1016/B978-012374410-4.00516-1
- ^ „Strefa wirusowa” . ExPASy. Źródło 15 czerwca 2015 r.
- ^ Snijder EJ, Horzinek MC (listopad 1993). „Torowirusy: replikacja, ewolucja i porównanie z innymi członkami nadrodziny koronawirusów” (PDF) . J. Gen. Wirol . 74 (11): 2305-16. doi : 10.1099/0022-1317-74-11-2305 . PMID 8245847 . Źródło 11 lipca 2020 r .
- ^ Draker R, Roper RL, Petric M, Tellier R. Kompletna sekwencja genomu bydlęcego torowirusa. Odp. wirusów Styczeń 2006;115(1):56-68. doi: 10.1016/j.virusres.2005.07.005. Epub 2005 30 sierpnia. PMID 16137782; PMCID: PMC7114287.
- ^ Sun H, Lan D, Lu L, Chen M, Wang C, Hua X. Charakterystyka molekularna i analiza filogenetyczna genomu świńskiego torowirusa. Arch Wirol. (2014) 159: 773–8. doi: 10.1007/s00705-013-1861-x
- ^ Snijder, EJ i Horzinek, MC (1993) Torowirusy: replikacja, ewolucja i porównanie z innymi członkami nadrodziny podobnej do koronawirusa . J Gen Virol 74: 2305–2316.
- ^ Snijder, EJ, den Boon, JA, Horzinek, MC i Spaan, WJ (1991) Porównanie organizacji genomu toro- i koronawirusów: dowody na dwa niehomologiczne zdarzenia rekombinacji RNA podczas ewolucji wirusa Berne. Wirusologia 180: 448–452.
- ^ Gorbalenya, AE, Enjuanes, L., Ziebuhr, J. i Snijder, EJ (2006) Nidovirales: ewolucja największego genomu wirusa RNA. Wirus Res 117: 17–37.
- ^ Horzinek MC (1999). TOROWIRUSY (CORONAVIRIDAE). Encyklopedia wirusologii, 1798–1803. https://doi.org/10.1006/rwvi.1999.0285
- ^ Eric J. Snijder i Marian C. Horzinek. 1993. Torowirusy: replikacja, ewolucja i porównanie z innymi członkami nadrodziny koronawirusów. Journal of General Virology.74, 2305-2316.
- ^ Koopmans, M., Herrewegh, A. i Horzinek, MC (1991). Diagnostyka zakażenia torowirusem. Lancet, 337(8745), 859. https://doi.org/10.1016/0140-6736(91)92573-k
- ^ Woode GN (1990). Wirus Bredy. W: Dinter Z i Morein B, wyd. Infekcje wirusowe przeżuwaczy. 3. wydanie. Szwecja: Elsevier Science, s. 311–316
- ^ Bosch, A., Rosa M. Pintó i Abad, Xavier. Czerwiec 2013. Przeżywalność i transport wirusów jelitowych w środowisku. http://www.ub.edu/virusenterics/wp-content/uploads/2013/06/GOY6.pdf
- ^ Vanopdenbosch, E., Wellemans, G., Oudewater, J., nd Petroff, k. (1992a). Vlaams Di-ergennesk. Tijdschr. 61, 1-7.
- ^ a b Beards GM, Hall C, Green J, Flewett TH, Lamouliatte F, Du Pasquier P (maj 1984). „Wirus otoczkowy w kale dzieci i dorosłych z zapaleniem żołądka i jelit, który przypomina wirusa Breda cieląt” . Lancet . 1 (8385): 1050–2. doi : 10.1016/S0140-6736(84)91454-5 . PMC 7173266 . PMID 6143978 .
- ^ Beards GM, brązowy DW, zielony J, Flewett TH (wrzesień 1986). „Wstępna charakterystyka ludzkich cząstek podobnych do torowirusa: porównanie z wirusem berneńskim koni i wirusem Breda cieląt” . Journal of Medical Virology . 20 (1): 67–78. doi : 10.1002/jmv.1890200109 . PMC 7166937 . PMID 3093635 .
- ^ Hoet, A. i Saif, L. (2004). Ponowna analiza torowirusa bydlęcego (wirus Breda). Recenzje badań nad zdrowiem zwierząt, 5(2), 157-171. doi:10.1079/AHR200498
- Bibliografia Linki zewnętrzne , https://doi.org/10.1086/314434
- ^ Lodha, A., de Silva, N., Petric, M. i Moore, AM (2005), Ludzki torowirus: nowy wirus związany z martwiczym zapaleniem jelit u noworodków. Acta Pædiatrica, 94: 1085-1088. doi:10.1111/j.1651-2227.2005.tb02049.x
- ^ Woode GN, Mohammed KA, Saif LJ, Winand NJ, Quesada M, Kelso NE i Pohlenz JF (1983). Metody diagnostyczne dla nowo odkrytej grupy wirusów wywołujących zapalenie jelit cieląt z grupy Breda. W: Proceedings of the III International Symposium of Veterinary Laboratory Diagnostics, tom 2, s. 533–538. Ames, Stany Zjednoczone.
- ^ a b Woode GN, Reed DE, Runnels PL, Herrig MA i Hill HT (1982). Badania z niesklasyfikowanym wirusem wyizolowanym z cieląt z biegunką. Mikrobiologia weterynaryjna 7: 221–240.
- ^ Pohlenz JFL, Cheville NF, Woode GN i Mokresh AH (1984). Zmiany komórkowe w błonie śluzowej jelit gnotobiotycznych cieląt eksperymentalnie zakażonych nowym niesklasyfikowanym wirusem bydlęcym (wirus Breda). Patologia weterynaryjna 21: 407–417
- ^ Sala GA (1987). Porównawcza patologia infekcji przez nowe wirusy biegunki. W: Brock G i Whelan J, redaktorzy. Nowe wirusy biegunki. Sympozjum Fundacji Ciba, nr 128. Chichester: John Wiley & Sons, s. 192–217
- ^ Pohlenz JFL, Cheville NF, Woode GN i Mokresh AH (1984). Zmiany komórkowe w błonie śluzowej jelit gnotobiotycznych cieląt eksperymentalnie zakażonych nowym niesklasyfikowanym wirusem bydlęcym (wirus Breda). Patologia weterynaryjna 21: 407–417.
- ^ Koopmans M i Horzinek MC (1995). Patogeneza zakażeń torowirusami u zwierząt i ludzi. W: Siddell SG, redaktor. Koronawirusy. Nowy Jork: Plenum Press, s. 403–413
- ^ Weiss M, Steck F, Horzinek MC (wrzesień 1983). „Oczyszczanie i częściowa charakterystyka nowego otoczkowego wirusa RNA (wirus Berne)” (PDF) . J. Gen. Wirol . 64 (9): 1849–58. doi : 10.1099/0022-1317-64-9-1849 . PMID 6886677 . Źródło 11 lipca 2020 r .
- ^ Woode GN, Reed DE, Runnels PL, Herrig MA, Hill HT (lipiec 1982). „Badania z niesklasyfikowanym wirusem wyizolowanym z cieląt z biegunką” . Weterynarz. Mikrobiol . 7 (3): 221–40. doi : 10.1016/0378-1135(82)90036-0 . PMC 7117454 . PMID 7051518 .
- ^ Horzinek MC, Weiss M (październik 1984). „Toroviridae: propozycja taksonomiczna”. Zentralblatt für Veterinärmedizin. Reihe B. 31 (9): 649–59. doi:10.1111/j.1439-0450.1984.tb01348.x. hdl:1874/3490. PMID 6393658
- ^ „Historia taksonomii ICTV: torowirus” . Międzynarodowy Komitet Taksonomii Wirusów (ICTV). ICTV. Źródło 7 września 2020 r.
- ^ Cavanagh D. Brien DA Brinton M. Enjuanes L. Holmes KV Horzinek MC Lai M. Laude H. Plagemann P. Siddell S. Spaan W., Taguchi, F. i Talbot, PJ (1994). Rewizja taksonomii rodzajów koronawirusów, torowirusów i arteriwirusów. Archiwa wirusologii, 135 (1-2), 227–237. https://doi.org/10.1007/BF01309782
- ^ Ivanov KA, Hertzig T., Rozanov M., Bayer S., Thiel V., Gorbalenya AE, Ziebuhr J. Główny marker genetyczny nidowirusów koduje replikacyjną endoribonukleazę. proc. Natl. Acad. nauka Stany Zjednoczone 2004;101:12694–12699
- Referencje _ ; DOI: 10.1128/JVI.77.17.9567-9577.2003
- ^ Snijder, EJ i MC Horzinek. 1993. Torowirusy: replikacja, ewolucja i porównanie z innymi członkami nadrodziny koronawirusów. J. Gen. Virol.74:2305-2316
Linki zewnętrzne
- Torowirusy sprawdzone i opublikowane przez Wikivet, dostęp 08.10.2011
- Strefa wirusowa : torowirus
- Baza danych i zasoby do analizy patogenów wirusów (ViPR): Coronaviridae
- ICTV