Adenoviridae

|
|
| Adenowirusy | |
|---|---|
| Transmisyjna mikrografia elektronowa dwóch cząstek adenowirusa | |
| Klasyfikacja wirusów | |
| (nierankingowe): | Wirus |
| królestwo : | Varidnaviria |
| Królestwo: | Bamfordvirae |
| Gromada: | Preplasmiviricota |
| Klasa: | Tectiliviricetes |
| Zamówienie: | Rowawirusy |
| Rodzina: | Adenoviridae |
| Rodzaje | |
|
|
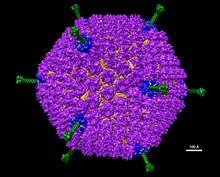
Adenowirusy (członkowie rodziny Adenoviridae ) to średniej wielkości (90–100 nm ), bezotoczkowe (bez zewnętrznej dwuwarstwy lipidowej) wirusy z dwudziestościennym nukleokapsydem zawierającym dwuniciowy genom DNA. Ich nazwa wywodzi się od ich początkowej izolacji z ludzkich migdałków w 1953 roku.
Mają szeroką gamę żywicieli kręgowców ; Stwierdzono , że u ludzi ponad 50 różnych serotypów adenowirusów powoduje szeroki zakres chorób , od łagodnych infekcji dróg oddechowych u małych dzieci (znanych jako przeziębienie ) po zagrażające życiu choroby wielonarządowe u osób z osłabionym układem odpornościowym .
Wirusologia
Klasyfikacja
Ta rodzina obejmuje następujące rodzaje :
- Atadenowirus
- Aviadenowirus
- Ichtadenowirus
- Mastadenowirus (w tym wszystkie ludzkie adenowirusy)
- siadenowirus
- Testadenowirus
Różnorodność
U ludzi obecnie istnieje 88 ludzkich adenowirusów (HAdV) w siedmiu gatunkach (ludzki adenowirus od A do G):
- O: 12, 18, 31
- B: 3, 7, 11, 14 , 16, 21, 34, 35, 50, 55
- C: 1, 2, 5, 6, 57
- D: 8, 9, 10, 13, 15, 17, 19, 20, 22, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 36 , 37, 38, 39, 42 , 43, 44, 45, 46, 47, 48, 49, 51, 53, 54, 56, 58, 59, 60, 62, 63, 64, 65, 67, 69, 70, 71, 72, 73, 74, 75
- E 4
- P: 40, 41
- G: 52
Różne typy/serotypy są związane z różnymi stanami:
- choroby układu oddechowego (głównie gatunki HAdV-B i C)
- zapalenie spojówek (HAdV-B i D)
- zapalenie żołądka i jelit (HAdV-F typ 40, 41, HAdV-G typ 52)
- otyłość lub adipogeneza (HAdV-A typ 31, HAdV-C typ 5, HAdV-D typy 9, 36, 37)
Wszystkie te typy są nazywane przez ICTV Human mastadenovirus A – G , ponieważ wszystkie należą do rodzaju Mastadenovirus .
Struktura

Adenowirusy są średniej wielkości (90–100 nm). Wiriony składają się z jednego liniowego fragmentu dwuniciowego DNA wewnątrz dwudziestościennego kapsydu . Większość kapsydu stanowi 240 białek heksonu , podczas gdy dwanaście zasad pentonu pokrywa rogi dwudziestościanu. Podstawy pentonu są związane z wystającymi włóknami, które pomagają w przyczepianiu się do komórki gospodarza poprzez receptor na jej powierzchni.
W 2010 roku struktura ludzkiego adenowirusa została rozwiązana na poziomie atomowym, co czyni go największym jak dotąd modelem o wysokiej rozdzielczości. Wirus składa się z około 1 miliona aminokwasowych i waży około 150 MDa .
Genom
Genom adenowirusa jest liniowym, niesegmentowanym dwuniciowym (ds) DNA o wielkości pomiędzy 26 a 48 Kbp . Dzięki temu wirus może teoretycznie przenosić od 22 do 40 genów . Chociaż jest znacznie większy niż inne wirusy z grupy Baltimore , nadal jest to bardzo prosty wirus, którego przetrwanie i replikacja są w dużym stopniu zależne od komórki gospodarza. Interesującą cechą tego wirusowego genomu jest to, że ma końcowe białko 55 kDa związane z każdym z 5'-końców liniowego dsDNA. Są one używane jako startery w replikacji wirusa i zapewniają odpowiednią replikację końców liniowego genomu wirusa. [ potrzebne źródło ]
Replikacja
Adenowirusy posiadają liniowy genom dsDNA i są zdolne do replikacji w jądrze komórek kręgowców przy użyciu maszynerii replikacyjnej gospodarza. Wejście adenowirusów do komórki gospodarza obejmuje dwa zestawy interakcji między wirusem a komórką gospodarza. Większość akcji odbywa się w wierzchołkach. Wejście do komórki gospodarza jest inicjowane przez domenę gałki białka włókna wiążącą się z receptorem komórkowym. Dwa obecnie ustalone receptory to: CD46 dla serotypów ludzkiego adenowirusa grupy B i receptor wirusa/adenowirusa Coxsackie (CAR) dla wszystkich innych serotypów. Istnieją doniesienia sugerujące, że cząsteczki MHC i reszty kwasu sialowego również działają w tym charakterze. Po tym następuje wtórna interakcja, w której motyw w podstawowym białku pentonu (patrz kapsomer ) oddziałuje z cząsteczką integryny . To interakcja koreceptorowa stymuluje wejście adenowirusa. Tą cząsteczką współreceptorową jest integryna αV . Wiązanie z integryną αv powoduje endocytozę cząsteczki wirusa poprzez wgłębienia pokryte klatryną . Przyłączenie do integryny αV stymuluje sygnalizację komórkową, a tym samym indukuje polimeryzację aktyny , co ułatwia endocytozę za pośrednictwem klatryny i powoduje wejście wirionu do komórki gospodarza w endosomie .
Gdy wirus pomyślnie dostanie się do komórki gospodarza, endosom zakwasza się, co zmienia topologię wirusa, powodując rozpad składników kapsydu. Kapsyd ulega destabilizacji i uwalnia się z niego białko VI, które jest jednym ze składników kapsydu (patrz genom adenowirusa ). Zmiany te, jak również toksyczny charakter pentonów, niszczą endosom, powodując ruch wirionu do cytoplazmy. Za pomocą mikrotubul komórkowych wirus jest transportowany do kompleksu porów jądrowych, gdzie cząsteczka adenowirusa rozkłada się. Następnie uwalniane jest wirusowe DNA, które może dostać się do jądra przez pory jądrowe . Następnie DNA wiąże się z histonów już obecnymi w jądrze, co umożliwia mu interakcję z maszynerią transkrypcyjną komórki gospodarza [ potrzebne źródło ] . Następnie może wystąpić ekspresja genów wirusa bez integracji genomu wirusa z chromosomami komórki gospodarza i mogą zostać wygenerowane nowe cząsteczki wirusa.
Cykl życiowy adenowirusa jest podzielony przez proces replikacji DNA na dwie fazy: fazę wczesną i późną. W obu fazach pierwotny transkrypt , który jest alternatywnie składany w celu wytworzenia monocistronowego mRNA kompatybilnego z rybosomem gospodarza , co pozwala na translację produktów . [ potrzebne źródło ]
Wczesne geny są odpowiedzialne za ekspresję głównie niestrukturalnych białek regulatorowych . Cel tych białek jest trojaki: zmiana ekspresji białek gospodarza, które są niezbędne do syntezy DNA ; do aktywacji innych genów wirusa (takich jak kodowana przez wirusa polimeraza DNA ); oraz aby uniknąć przedwczesnej śmierci zakażonej komórki przez mechanizmy obronne gospodarza (blokada apoptozy , blokada aktywności interferonu i blokada translokacji i ekspresji MHC klasy I ).
Niektóre adenowirusy w wyspecjalizowanych warunkach mogą transformować komórki przy użyciu produktów ich wczesnych genów. Stwierdzono, że E1A (wiąże białko supresorowe nowotworu siatkówczaka ) unieśmiertelnia komórki pierwotne in vitro, umożliwiając E1B (wiąże supresor guza p53 ) wspomaganie i stabilną transformację komórek. Niemniej jednak polegają na sobie nawzajem, aby skutecznie transformować komórkę gospodarza i tworzyć guzy . E1A jest głównie wewnętrznie nieuporządkowanym białkiem i zawiera domenę CR3, która ma kluczowe znaczenie dla aktywacji transkrypcji.
Replikacja DNA oddziela wczesną i późną fazę. Gdy wczesne geny uwolnią odpowiednie białka wirusa, maszynerię replikacji i substraty replikacji, może nastąpić replikacja genomu adenowirusa. Białko końcowe, które jest kowalencyjnie związane z końcem 5' genomu adenowirusa, działa jako starter do replikacji. Wirusowa polimeraza DNA wykorzystuje następnie mechanizm przemieszczania nici, w przeciwieństwie do konwencjonalnych fragmentów Okazaki stosowanych w replikacji DNA ssaków, do replikacji genomu.
Późna faza cyklu życiowego adenowirusa koncentruje się na wytwarzaniu wystarczających ilości białka strukturalnego do upakowania całego materiału genetycznego wytwarzanego przez replikację DNA. Po udanej replikacji składników wirusowych wirus jest składany w swoje białkowe otoczki i uwalniany z komórki w wyniku lizy komórkowej indukowanej przez wirusy .
Reaktywacja wielości
Adenowirus jest zdolny do wielokrotnej reaktywacji (MR) (Yamamoto i Shimojo, 1971). MR to proces, w którym dwa lub więcej genomów wirusa zawierających śmiertelne uszkodzenia oddziałuje w zainfekowanej komórce, tworząc żywotny genom wirusa. Taki MR wykazano dla adenowirusa 12 po napromieniowaniu wirionów światłem UV i pozostawieniu do wielokrotnej infekcji komórek gospodarza. W przeglądzie opisano liczne przykłady MR w różnych wirusach i zasugerowano, że MR jest powszechną formą interakcji seksualnych, która zapewnia przewagę w zakresie przeżycia dzięki rekombinacyjnej naprawie uszkodzeń genomu.
Epidemiologia
Przenoszenie
Adenowirusy są niezwykle odporne na czynniki chemiczne lub fizyczne oraz niekorzystne warunki pH , co pozwala na przedłużone przeżycie poza organizmem i wodą. Adenowirusy rozprzestrzeniają się głównie drogą kropelkową, ale mogą być również przenoszone przez kał i aerozole (transmisja powietrzna). Badania mechanizmów molekularnych leżących u podstaw przenoszenia adenowirusów dostarczają dowodów empirycznych na poparcie hipotezy, że receptory wirusa Coxsackie/adenowirusa (CAR) są potrzebne do transportu adenowirusów do pewnych typów komórek naiwnych/progenitorowych.
ludzie
Ludzie zakażeni adenowirusami wykazują szeroki zakres odpowiedzi, od braku jakichkolwiek objawów do ciężkich infekcji typowych dla serotypu 14 adenowirusa .
Zwierząt
Adenowirus nietoperza TJM (Bt-AdV-TJM) to nowy gatunek z rodzaju Mastadenovirus wyizolowany z Myotis i Scotophilus kuhlii w Chinach. Jest najbliżej spokrewniony z ryjówką drzewną i psimi AdVs.
dwa rodzaje psich adenowirusów, typ 1 i 2. Typ 1 (CAdV-1) powoduje zakaźne zapalenie wątroby u psów , potencjalnie śmiertelną chorobę obejmującą zapalenie naczyń i zapalenie wątroby . Infekcja typu 1 może również powodować infekcje dróg oddechowych i oczu. CAdV-1 atakuje również lisy ( Vulpes vulpes i Vulpes lagopus ) i może powodować zapalenie wątroby i zapalenie mózgu. Adenowirus psów 2 (CAdV-2) jest jedną z potencjalnych przyczyn kaszlu kenelowego . Podstawowe szczepionki dla psów obejmują atenuowane żywe CAdV-2, które wytwarzają odporność na CAdV-1 i CAdV-2. CAdV-1 był początkowo stosowany w szczepionce dla psów, ale częstym powikłaniem był obrzęk rogówki .
Doniesiono, że adenowirus wiewiórki (SqAdV) powoduje zapalenie jelit u wiewiórek rudych w Europie, podczas gdy wiewiórki szare wydają się być odporne. SqAdV jest najbliżej spokrewniony z adenowirusem świnek morskich (GpAdV).
Adenowirus u gadów jest słabo poznany, ale badania są obecnie w toku.
Wiadomo również, że adenowirusy powodują infekcje dróg oddechowych u koni , bydła , świń , owiec i kóz . Koński adenowirus 1 może również powodować śmiertelną chorobę u źrebiąt arabskich z obniżoną odpornością , obejmującą zapalenie płuc i zniszczenie tkanki trzustki i gruczołów ślinowych . Adenowirus Tupaia (TAV) (adenowirus ryjówki 1) został wyizolowany z ryjówki.
Adenowirus otaryny 1 został wyizolowany z lwów morskich ( Zalophus californianus ).
Adenowirusy ptactwa są związane z wieloma stanami chorobowymi u ptactwa domowego, takimi jak zapalenie wątroby z ciałkami wtrętowymi , zespół hydropericardium , zespół opadania jaja , przepiórcze zapalenie oskrzeli , nadżerki żołądka i wiele chorób układu oddechowego. Zostały również wyizolowane z dzikiej kani czarnej (Milvus migrans).
małpy Titi został wyizolowany z kolonii małp.
Zapobieganie
Obecnie dostępna jest szczepionka przeciwko adenowirusom typu 4 i 7 przeznaczona wyłącznie dla personelu wojskowego USA. Personel wojskowy USA jest odbiorcą tej szczepionki, ponieważ może być bardziej narażony na infekcję. [ potrzebne źródło ] Szczepionka zawiera żywego wirusa, który może być wydalany z kałem i prowadzić do przeniesienia. Szczepionka nie jest dopuszczona do użytku poza wojskiem, ponieważ nie została przebadana w populacji ogólnej ani na osobach z osłabionym układem odpornościowym.
W przeszłości amerykańscy rekruci wojskowi byli szczepioni przeciwko dwóm serotypom adenowirusa, z odpowiednim spadkiem chorób powodowanych przez te serotypy. Ta szczepionka nie jest już produkowana. US Army Medical Research and Materiel Command ogłosiło 31 października 2011 r., że nowa szczepionka adenowirusowa, która zastępuje starszą wersję, która nie była produkowana od ponad dziesięciu lat, została wysłana do podstawowych ośrodków szkoleniowych w dniu 18 października 2011 r. Więcej informacji jest dostępnych Tutaj.
Zapobieganie adenowirusom, jak również innym chorobom układu oddechowego, obejmuje częste mycie rąk przez ponad 20 sekund, unikanie dotykania oczu, twarzy i nosa nieumytymi rękami oraz unikanie bliskiego kontaktu z osobami z objawami zakażenia adenowirusem. Osobom z objawową infekcją adenowirusem zaleca się dodatkowo kaszel lub kichanie w ramię lub łokieć zamiast w dłoń, unikanie dzielenia się kubkami i sztućcami oraz powstrzymanie się od całowania innych. Chlorowanie basenów może zapobiegać wybuchom zapalenia spojówek wywołanym przez adenowirusa.
Diagnoza
Diagnoza opiera się na objawach i historii. Testy są konieczne tylko w bardzo poważnych przypadkach. Testy obejmują badania krwi, oczy, wymazy z nosa lub gardła, testy próbek kału i prześwietlenia klatki piersiowej. W laboratorium adenowirus można zidentyfikować za pomocą wykrywania antygenu, reakcji łańcuchowej polimerazy (PCR), izolacji wirusa i serologii. Nawet jeśli okaże się, że adenowirus jest obecny, może nie być przyczyną żadnych objawów. Niektóre osoby z obniżoną odpornością mogą rozsiewać wirusa przez tygodnie i nie wykazywać żadnych objawów.
Infekcje
Większość infekcji adenowirusem skutkuje infekcjami górnych dróg oddechowych. Infekcje adenowirusowe często objawiają się zapaleniem spojówek , zapaleniem migdałków (które może wyglądać dokładnie jak paciorkowiec i nie można go odróżnić od paciorkowca poza badaniem posiewu gardła), zapaleniem ucha lub zadem . Adenowirusy typu 40 i 41 mogą również powodować zapalenie żołądka i jelit . Połączenie zapalenia spojówek i migdałków jest szczególnie częste w przypadku infekcji adenowirusami.
U niektórych dzieci (zwłaszcza najmłodszych) może rozwinąć się adenowirusowe zapalenie oskrzelików lub zapalenie płuc , które mogą być ciężkie. U niemowląt adenowirusy mogą również powodować napady kaszlu, które wyglądają prawie dokładnie jak krztusiec . Adenowirusy mogą również powodować wirusowe zapalenie opon mózgowych lub zapalenie mózgu . Rzadko adenowirus może powodować krwotoczne zapalenie pęcherza moczowego (zapalenie pęcherza moczowego – forma zakażenia dróg moczowych – z krwią w moczu).
Większość ludzi samodzielnie dochodzi do siebie po infekcjach adenowirusami, ale osoby z niedoborem odporności czasami umierają z powodu infekcji adenowirusami i — rzadko — nawet wcześniej zdrowi ludzie mogą umrzeć z powodu tych infekcji. Może to wynikać z faktu, że czasami infekcja adenowirusowa może prowadzić do zaburzeń pracy serca. Na przykład w jednym badaniu niektóre próbki serca pacjentów z kardiomiopatią rozstrzeniową dały wynik pozytywny na obecność adenowirusa typu 8.
Adenowirusy są często przenoszone przez odkrztuszanie (np. aerozole), ale mogą być również przenoszone przez kontakt z zarażoną osobą lub cząsteczki wirusa pozostawione na przedmiotach, takich jak ręczniki i uchwyty kranów. Niektóre osoby z adenowirusowym zapaleniem żołądka i jelit mogą wydalać wirusa ze stolca przez wiele miesięcy po ustąpieniu objawów. Wirus może przenosić się przez wodę w basenach, które nie są wystarczająco chlorowane.
Podobnie jak w przypadku wielu innych chorób, dobra praktyka mycia rąk jest jednym ze sposobów hamowania przenoszenia adenowirusów z człowieka na człowieka. Ciepło i wybielacz zabiją adenowirusy na przedmiotach. [ potrzebne źródło ]
Leczenie
Nie ma sprawdzonych leków przeciwwirusowych do leczenia infekcji adenowirusowych, więc leczenie jest w dużej mierze ukierunkowane na objawy (takie jak paracetamol na gorączkę). Lek przeciwwirusowy cidofovir pomógł niektórym pacjentom z ciężkimi przypadkami choroby; w źródle nie podano liczby iw jakim stopniu pomogło, a także konkretnych komplikacji lub objawów, w których pomogło, oraz kiedy i gdzie to się stało. Lekarz może podać antybiotykowe krople do oczu na zapalenie spojówek, w oczekiwaniu na wyniki posiewów bakteryjnych oraz w celu zapobiegania wtórnym infekcjom bakteryjnym. Obecnie nie ma szczepionki adenowirusowej dostępnej dla ogółu społeczeństwa, ale dla armii Stanów Zjednoczonych dostępna jest szczepionka dla typów 4 i 7.
Zastosowanie w terapii genowej i szczepieniach
Terapia genowa
Adenowirusy od dawna są popularnym wektorem wirusowym w terapii genowej ze względu na ich zdolność do wpływania zarówno na replikujące się, jak i niereplikujące komórki, przyjmowanie dużych transgenów i kodowanie białek bez integracji materiału genetycznego z genomem komórki gospodarza. Dokładniej, są one stosowane jako nośnik do podawania terapii celowanej , w postaci rekombinowanego DNA lub białka. Ta terapia okazała się szczególnie użyteczna w leczeniu jednogenowych (np. mukowiscydozy , SCID sprzężonego z chromosomem X , niedobór alfa1-antytrypsyny ) i raka. W Chinach adenowirus onkolityczny jest zatwierdzonym lekiem na raka. Specyficzne modyfikacje białek błonnika są wykorzystywane do kierowania adenowirusa do określonych typów komórek; podejmuje się znaczne wysiłki w celu ograniczenia hepatotoksyczności i zapobiegania niewydolności wielonarządowej. Dwunastościan adenowirusa można zakwalifikować jako silną platformę dostarczania obcych antygenów do ludzkich szpikowych komórek dendrytycznych (MDC) i że jest skutecznie prezentowany przez MDC limfocytom T CD8 + specyficznym dla M1.
Problemem związanym z bezpieczeństwem adenowirusów jest to, że mogą one wywoływać odpowiedź immunologiczną z powiązaną reakcją zapalną, jak miało to miejsce w przypadku śmierci Jessego Gelsingera w 1999 r. Aby zaradzić temu zagrożeniu, genom genów wirusowych został zmodyfikowany w celu usunięcia niektórych genów wirusowych, takich jak. Jedną z takich modyfikacji jest wektor typu gutless , który usuwa prawie cały genom wirusa.
Adenowirus był używany do dostarczania systemów edycji genów CRISPR/Cas9 , ale wysoka reaktywność immunologiczna na infekcję wirusową stanowiła wyzwanie dla pacjentów.
Szczepionki
Zmodyfikowane ( rekombinowane ) wektory adenowirusowe, w tym typy niekompetentne pod względem replikacji, mogą dostarczać DNA kodujące określone antygeny .
Adenowirusy zostały wykorzystane do produkcji wirusowych szczepionek wektorowych COVID-19 . „W czterech kandydujących szczepionkach przeciwko COVID-19… Ad5… służy jako„ wektor ”do transportu genu białka powierzchniowego SARS-CoV-2”. Celem jest genetyczna ekspresja glikoproteiny szczytowej koronawirusa zespołu ostrej niewydolności oddechowej 2 ( SARS-CoV-2 ). Wektor szczepionki adenowirusa szympansa z niedoborem replikacji (ChAdOx1) jest używany w zatwierdzonej do użytku szczepionce Oxford – AstraZeneca COVID-19 . Szczepionka Janssen COVID-19 wykorzystuje zmodyfikowany rekombinowany adenowirus typu 26 (Ad26). Rekombinowany adenowirus typu 5 (Ad5) jest używany przez Ad5-nCoV , ImmunityBio i UQ-CSL V451 . Produkt Gam -COVID-Vac (aka Sputnik-V) jest innowacyjny, ponieważ szczepionka oparta na Ad26 jest stosowana pierwszego dnia, a szczepionka Ad5 jest stosowana w dniu 21. Kolejnym jest ChAd-SARS-CoV-2-S ; podobno szczepionka zapobiegła zakażeniu SARS-CoV-2 myszom, które zostały genetycznie zmodyfikowane tak, aby miały ludzkie ACE2 (hACE2), przypuszczalnie receptory umożliwiające wirusowi wnikanie do komórek.
Możliwe problemy związane ze stosowaniem adenowirusa jako wektora szczepionki obejmują: organizm ludzki rozwija odporność na samego wektora, co utrudnia lub uniemożliwia wykonanie kolejnych szczepień przypominających. W niektórych przypadkach ludzie mają wcześniej istniejącą odporność na adenowirusy, przez co dostarczanie wektorów jest nieskuteczne.
Obawy związane z zakażeniem wirusem HIV
Stosowanie szczepionek Ad5 przeciwko COVID-19 zaniepokoiło badaczy, którzy mieli doświadczenie z dwoma nieudanymi próbami szczepionki Ad5, Phambili i STEP, ze względu na zwiększone ryzyko zarażenia się wirusem HIV-1 przez nieobrzezanych pacjentów płci męskiej podczas seksu analnego bez zabezpieczenia . Stwierdzono wówczas, że podwyższone ryzyko zakażenia wirusem HIV można zaobserwować w przypadku każdej szczepionki wektorowej opartej na Ad5. W październiku 2020 r. badacze ci napisali w The Lancet : „Na podstawie tych ustaleń obawiamy się, że użycie wektora Ad5 do immunizacji przeciwko SARS-CoV-2 może podobnie zwiększyć ryzyko nabycia HIV-1 wśród mężczyzn otrzymujących szczepionka”. Szczepionki wykorzystujące inne technologie nie zostałyby naruszone, ale Sputnik V , Convidecia i hAd5 firmy ImmunityBio już tak. Dwa badania wykazały, że limfocyty T CD4 specyficzne dla Ad5 są bardziej podatne na zakażenie wirusem HIV niż limfocyty T CD4 specyficzne dla niektórych innych wektorów, takich jak wirus cytomegalii i ospa kanarków .
Dla porównania, artykuł Science donosił, że Chiny zatwierdziły szczepionkę CanSino Ebola opartą na wektorze Ad5. Został przetestowany w Sierra Leone , gdzie częstość występowania wirusa HIV jest wysoka , co zwiększa prawdopodobieństwo wykrycia takich problemów. Dyrektor generalny CanSino powiedział, że „nie widzieliśmy nic ze szczepionką Ebola” i spekulował, że podatność na HIV może być ograniczona do szczepionek Ad5, które produkują białka HIV. W badaniu opublikowanym w The Lancet w maju badacze firmy uznali tę możliwość, nazwali ją „kontrowersyjną” i powiedzieli, że będą jej szukać w testach kandydata na szczepionkę COVID-19 firmy . Nie wiadomo, w jakim stopniu dyskryminacja LGBT w Sierra Leone mogła przyczynić się do zamaskowania możliwego związku przyczynowego w próbie szczepionki Ebola; podczas gdy badanie Step obejmowało głównie homoseksualnych i biseksualnych mężczyzn, badanie Phambili obejmowało głównie heteroseksualnych mężczyzn i kobiety i nadal znajdowało pozorny związek. [ potrzebne źródło ]
Zobacz też
Linki zewnętrzne
- Centra Kontroli i Prewencji Chorób – Krajowe Centrum Chorób – Oddział Chorób Wirusowych i Riketsjowych , Oddział Wirusów Układu Oddechowego i Jelitowego
- MicrobiologyBytes: Adenowirusy
- Uniwersytet Stanforda — adenowirusy
- Ogólne pojęcia dotyczące adenowirusów
- Ogólne informacje o adenowirusie
- Strategie replikacji wirusów DNA
- Sekwencjonowane adenowirusy
- Zdrowie dzieci — adenowirusy
- Strefa wirusowa: Adenoviridae
- Grupa dyskusyjna ds. Badań nad adenowirusami
- USAMRMC chroni żołnierzy przed niewidzialnym wrogiem
- Struktury makromolekularne 3D adenowirusów zarchiwizowane w EM Data Bank (EMDB)
- Cząsteczka miesiąca: adenowirus
- ICTV