Angelicyna

|
|
| Nazwy | |
|---|---|
| Wymowa | ˈeɪn.dʒəlaɪ.sɪn |
|
Preferowana nazwa IUPAC
2H - Furo[2,3- h ][1]benzopiran-2-on |
|
| Inne nazwy Isopsoralen, 2H - furo[2,3- h ]chromen-2-on, furo[2,3- h ]chromen-2-on
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.164.795 |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C11H6O3 _ _ _ _ _ | |
| Masa cząsteczkowa | 186,166 g·mol -1 |
| Wygląd | jasnożółte kryształy |
| Temperatura topnienia | 134°C |
| Temperatura wrzenia | 362,6°C |
| 10 mM w DMSO | |
| dziennik P | 1,97 |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
fotouczulacz, środek pęcherzykowy, rakotwórczy |
| Punkt zapłonu | 173,1°C |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Angelicyna jest związkiem macierzystym z rodziny naturalnie występujących związków organicznych znanych jako kątowe furanokumaryny . Strukturalnie można go uznać za benzapira-2-on skondensowany z ugrupowaniem furanowym w pozycji 7,8. Angelicyna jest powszechnie spotykana w niektórych Apiaceae i Fabaceae , takich jak Bituminaria bituminosa . Ma współczynnik przenikania przez skórę (Log Kp ) wynoszący -2,46. Maksymalną absorpcję obserwuje się przy 300 nm. Widmo 1HNMR jest dostępne; w tej bazie danych można znaleźć widma w podczerwieni i masowe angelicyny . Sublimacja angelicyny zachodzi w temperaturze 120°C i pod ciśnieniem 0,13 Pa. Angelicyna jest kumaryną .
Historia i etymologia
Ludzie od wieków używali roślin bogatych w angelicynę. Najwcześniejsza znana wzmianka pochodzi z 3000 rpne, kiedy starożytni Egipcjanie stosowali olej i sok z lokalnych Apiaceae , wystawiając ich skórę na działanie promieni słonecznych, aby wyleczyć bielactwo . W międzyczasie plemiona w Indiach używały Psoralea corylifolia , która zawierała psoralen , izomer angelicyny. Ludzie próbowali również zbierać rośliny jako alternatywne źródło pożywienia. Jednak większość z nich okazała się niesmaczna i toksyczna jak Angelica archangelica ze względu na zdolność podrażniania skóry i uszkadzania narządów wewnętrznych.
Nazwa „angelicyna” pochodzi od wspomnianej wcześniej rośliny Angelica . Ta łacińska nazwa wywodzi się ze średniowiecznej Europy, gdzie roślina ta była również stosowana jako uniwersalne lekarstwo na wiele rodzajów chorób, nie wspominając o dżumie dymieniczej . W tym czasie ludzie wierzyli, że roślina może zapobiec przejęciu duszy przez czary, przekleństwa i złego ducha (dodaj odniesienie). Angelica pojawiłaby się we śnie z aniołem wyjaśniającym jej zastosowanie, stąd nazwa. Jak na ironię, później odkryto, że olej roślinny jest toksyczny, gdy jest stosowany w dużych ilościach, zwłaszcza gdy roślina była świeża.
Gatunki roślin, w których występuje angelicyna, zostały wprowadzone w Wielkiej Brytanii w XIX wieku. Obecnie można go spotkać w Kanadzie oraz niektórych częściach Stanów Zjednoczonych i Europy . Ze względu na toksyczność niektórych części roślin oraz zdolność do rozmnażania się roślin, znajduje się na liście gatunków inwazyjnych .
Do ekstrakcji związku używa się liści Angelica archangelica, które są bogate w angelicynę. Przeprowadzono wiele badań nad toksycznością angelicyny, z których jedno wykazało, że związek ten wywołuje uszkodzenia chromosomów w komórkach chomika wystawionych na działanie światła UV o długości fali 320-380 nm. Wykazano, że aberracje chromosomowe są również indukowane u ludzi.
Obecnie toczy się dyskusja, czy arcydzięgiel należy uznać za toksyczny. Pewne jest jednak, że toksyczność zależy od podanej dawki angelicyny i jej stosowanie jest wyłącznie kwestią ekspertów.
Synteza biologiczna
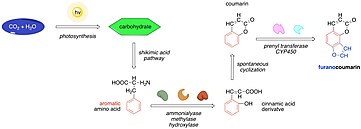
Biosyntezę angelicyny można opisać jako odmianę biologicznej syntezy furanokumaryn. Zaczyna się od wychwytywania węgla organicznego w procesie fotosyntezy i tworzenia węglowodanów. Następnie węglowodany stają się substratami szlaku kwasu szikimowego , gdzie są przekształcane do fenyloalaniny i tyrozyny. Enzymy, takie jak amonialiazy, metylazy i hydroksylazy, następnie przekształcają te aminokwasy w pochodne kwasu cynamonowego, które ulegają o -hydroksylacji, dając kumaryny. Kumaryny mogą podlegać dalszym reakcjom, takim jak prenylacja i utlenianie, dając wiele furanokumaryn, z których jedną jest angelicyna.
Tutaj biosynteza angelicyny jest opisana bardziej szczegółowo, zaczynając od L-fenyloalaniny jako prekursora. Fenyloalanina ulega nieutleniającej deaminacji przez amoniakoliazę fenyloalaniny (PAL) do kwasu trans - cynamonowego . Następnie trans -cynamonowy jest hydroksylowany w pozycji para przez 4-monooksygenazę trans -cynamonianową (C4H), która wykorzystuje NADPH, H + i O 2 . Produkt, kwas p -kumarowy , jest następnie przekształcany w umbeliferon , ważny związek pośredni szlaku biosyntezy.
2-hydroksylaza kwasu 4-kumarowego (C2'H) hydroksyluje kwas p -kumarowy w pozycji orto . Warto zauważyć, że ta reakcja wykorzystuje alfa-ketoglutaran, który jest redukowany do bursztynianu, z których oba są zaangażowane w cykl Krebsa . Nowo utworzony trans -dihydrocynamonowy ulega fotochemicznej izomeryzacji do izomeru cis , który spontanicznie laktonizuje dając umbelferon.
Następnie umbeliferon 6- prenylotransferaza (PT) łączy umbeliferon z difosforanem prenylu, dając ostenol i pirofosforan. Ostenol jest utleniany do (+)-kolumbianetyny przez syntazę (+)-kolumbianetyny (CS), przypuszczalny roślinny cytochrom P450 , chociaż szczegóły tej reakcji nie są jasne. Biosynteza kończy się utlenieniem (+)-kolumbianetyny z wytworzeniem angelicyny przez syntazę angelicyny (AS), która jest również uważana za enzym z rodziny cytochromów P450.
Warto zauważyć, że biosynteza angelicyny różni się w przypadku umbeliferonu, ponieważ jest on również przekształcany w psoralen, izomer angelicyny. W rzeczywistości psoralen, z którego wywodzi się rodzina furanokumaryn liniowych, występuje w roślinach znacznie częściej niż angelicyna. W rezultacie większość owadów roślinożernych jest odporna na psoralen. Obecnie coraz częściej uznaje się, że rośliny opracowały ścieżkę prowadzącą do angelicyny jako alternatywnego mechanizmu obronnego. Na przykład angelicyna zwiększa toksyczność psoralenu, działając jako inhibitor odtruwającego cytochromu P450 u owadów. Ponadto porównanie sekwencji białkowych syntazy psoralenu i syntazy angelicyny wykazuje całkowitą identyczność 70% i identyczność 40% w miejscach rozpoznawania substratu. Oznacza to, że biosynteza angelicyny jest cechą stosunkowo niedawno wyewoluowaną.
Synteza chemiczna
Jodowanie dostępnego w handlu umbeliferonu (7-hydroksykumaryny) daje 7-hydroksy-8-jodokumarynę. Grupę acetoksy można wprowadzić do grupy hydroksylowej 7-hydroksy-8-jodokumaryny, z której tworzy się waginol lub waginidiol za pomocą izopropylowego odczynnika Grignarda i dostępnych w handlu aldehydów epoksydowych. Późniejsza katalizowana kwasem fragmentacja pochwynolu za pomocą dichlorometanu w kwasie trifluorooctowym daje angelicynę.
Związek można wyizolować ze źródeł naturalnych, chociaż daje to niską wydajność ze względu na występowanie innych furanokumaryn. Popularną techniką jest suszenie na powietrzu części nadziemnych i zmielonych korzeni roślin, a następnie n -heksanem i chromatografia kolumnowa na żelu krzemionkowym.
Zastosowanie medyczne
Pochodne angelicyny są stosowane w leczeniu łuszczycy i raka . Jednym ze sposobów leczenia tych chorób jest fotochemioterapia ( PUVA ), która łączy promieniowanie UV z substancją fotouczulającą . W większości przypadków 4,5'-dimetyloangelicyna jest stosowana ze względu na jej silne wiązanie i specyficzność do DNA. Wykazano również, że aktywnie hamuje syntezę kwasów nukleinowych w komórkach nowotworowych, zmniejszając tym samym ich wzrost.
W PUVA angelicyna jest mniej popularna niż psoralen, chociaż obie furanokumaryny są fotouczulające i stosowane w połączeniu z długofalowym promieniowaniem UV. Angelicin i psoralen są stosowane w innych chorobach skóry, takich jak bielactwo i grzybica . Fotowiązanie DNA jest najlepiej zbadanym aspektem fotobiologii i fotochemii angelicyny. Zgodnie z mechanizmem, światło UV o dużym zasięgu wyzwala angelcynę, która wiąże się z zasadami pirymidynowymi DNA w taki sam sposób jak psoralen. może dojść do zahamowania replikacji DNA poprzez tworzenie fotoadduktów . Może to być podstawą pożądanego efektu terapeutycznego, podobnie jak w przypadku pochodnych psoralenu.
Należy jednak zachować szczególną ostrożność podczas stosowania PUVA ze względu na skutki uboczne, jakie może przynieść. Dlatego ten rodzaj leczenia jest czasami stosowany w ostateczności i często zamiast tego stosuje się kortykosteroidy. Jednym z głównych działań niepożądanych PUVA jest fototoksyczność , którą można zwalczać za pomocą heteroanalogów angelicyny. Na przykład niedawno naukowcy wykazali, że jeśli pierścień furanu zostanie zastąpiony pierścieniem 1-podstawionego pirazolu lub tiofenu , nowe heteroanalogi angelicyny praktycznie nie wykazują fototoksyczności.
Interakcja z biomolekułami
Wykazano, że angelicyna wykazuje wielopłaszczyznowe działanie na różne biocząsteczki, co wynika z budowy i fotoreaktywności związku . Na przykład płaska struktura pozwala angelicynie na interkalację między zasadami DNA. Pod wpływem światła ultrafioletowego ulega reakcji C4 - fotocykloaddycji z tyminą i cytozyną tworząc monoaddukt. Podwójne wiązania angelicyny zaangażowane w tę reakcję to 3,4 i 4',5'. Jednak reszta układu aromatycznego angelicyny nie może reagować z pirymidyną komplementarnej nici ze względu na niekorzystne ustawienie reaktywnych wiązań podwójnych. Lipidy są również podatne na fotoindukowane reakcje z angelicyną, które mogą być tlenowe lub beztlenowe. Reakcje tlenowe powodują peroksydację lipidów, podczas gdy szlak beztlenowy prowadzi do sprzęgania angelicyny z łańcuchami nienasyconych kwasów tłuszczowych, takich jak kwas linolenowy , w sposób podobny do tworzenia adduktów pirymidynowych.
Wykazano, że białka oddziałują z angelicyną w sposób niekowalencyjny. Na przykład istnieje mierzalne powinowactwo angelicyny do albuminy surowicy ludzkiej (19,10 x 104 mol -1 L -1 ), która ma jedno niekowalencyjne miejsce wiązania na cząsteczkę angelicyny. Światło ultrafioletowe (365 nm) ułatwia jego kowalencyjne wiązanie z białkami, które jest wzmocnione w obecności tlenu. Przy tej długości fali angelicyna może również modyfikować niektóre aminokwasy.
Toksyczność
Zgodnie z MSDS firmy Sigma-Aldrich, LD50 . angelicyny wynosi 322 mg/kg, co wskazuje na ostrą toksyczność po podaniu doustnym szczurom Możliwe następstwa to zmiana rytmu okołodobowego i odruchu prostującego , ataksja i analgezja .
w kontakcie ze skórą wykazuje działanie fototoksyczne i fotomutagenne . Zwiększa wrażliwość skóry na promieniowanie UV, prowadząc do poważnych uszkodzeń skóry, takich jak rumień i pęcherze . Po napromieniowaniu światłem UV o większej długości fali angelicyna tworzy monoaddukty DNA, które mogą powodować raka skóry. W przeciwieństwie do tego izomer angelicyny, psoralen, był pięć do dziesięciu razy bardziej aktywny niż angelicyna i usieciowany DNA . Utrudnia to bardziej replikację DNA ze względu na niezdolność do rozdzielenia dwóch nici helisy DNA. Zarówno psoralen, jak i angelicyna mogą być stosowane w leczeniu raka w celu hamowania replikacji DNA w komórkach nowotworowych i indukowania apoptozy – jak wspomniano w zastosowaniach medycznych – ale należy obchodzić się z nimi ostrożnie, ponieważ jako efekt uboczny mogą powodować fotodermit w zdrowych komórkach.
W hodowlach komórek ssaków angelicyna wykazywała działanie mutagenne i cytotoksyczne , pełniąc rolę silnego inhibitora metabolizmu leków. Hamowanie wynika z faktu, że angelicyna zmniejsza aktywność i ekspresję CYP1A1 , który jest regulowany przez receptory węglowodorów arylowych (AhR). Zaproponowano trzy hipotezy wyjaśniające to zjawisko:
- Angelicyna osłabia aktywność katalityczną wykonywaną przez CYP1A1 niezależnie od obecności światła UV.
- Angelicyna wyzwala ekspresję genu CYP1A1 poprzez aktywację AhR, gdy światło UV nie jest dostępne.
- Angelicyna prowadzi do ekspresji genu CYP1A1 bez udziału AhR.
Fototoksyczne właściwości angelicyny zostały wykorzystane przez jej zastosowanie jako naturalnego pestycydu i środka dezynfekującego. Należy zauważyć, że trudno jest jednoznacznie określić, czy tylko angelicyna stwarza największe ryzyko fototoksyczności i fotomutagenności, ponieważ w roślinach angelicyna zawsze występuje w mieszaninie z pochodnymi angelicyny, psoralenem i innymi furanokumarynami. Ponadto skład furanokumaryn większości gatunków roślin nie jest do końca poznany, podobnie jak toksyczne właściwości niektórych furanokumaryn.
- ; ^ abc Dehghan , Hossein Sarrafi, Yaghoub; Salehi, Peyman; Ebrahimi, Samad Nejad (2017-04-01). „Hamowanie α-glukozydazy i aktywność przeciwutleniająca furanokumaryn z Heracleum persicum”. Badania chemii medycznej . 26 (4): 849–855. doi : 10.1007/s00044-017-1796-y . ISSN 1054-2523 . S2CID 31293666 .
- Bibliografia _ _ _ _ www.biobyte.com . Źródło 2018-03-15 .
- Bibliografia _ Dall'Acqua, F.; Guiotto, A. (grudzień 1991). „Angelicyny, kątowe analogi psoralenów: właściwości chemiczne, fotochemiczne, fotobiologiczne i fototerapeutyczne”. Farmakologia i terapia . 52 (3): 331–363. doi : 10.1016/0163-7258(91)90031-G . ISSN 0163-7258 . PMID 1820581 .
- ^ Böhme, Horst; Seweryn, Teodor (1957). "Optische Untersuchungen an Cumarinen Mitteilung: Die Ultraviolettabsorption einiger Cumarine pflanzlicher Herkunft". Archiv der Pharmazie . 290 (10): 486–494. doi : 10.1002/ardp.19572901010 . ISSN 1521-4184 . PMID 13471015 . S2CID 84020911 .
- ^ Lenković, Maja; Cabrijan, Leo; Gruber Franjo; Saftić, Marina; Stanić Zgombić, Zrinka; Stasić, Wojciech; Peharda, Vesna (październik 2008). „Fitofotodermatozy w regionie Rijeka, Chorwacja”. Collegium Antropologicum . 32 Suppl 2: 203–205. ISSN 0350-6134 . PMID 19138025 .
- ^ „Zastosowania ziół arcydzięgla, korzyści zdrowotne i skutki uboczne” . Zasoby ziołowe . Źródło 2018-03-16 .
- ^ „Barszcz olbrzymi: nowy wkład w zrozumienie tej rośliny w Wielkiej Brytanii” . Dr M szaleje . 2014-01-09 . Źródło 2018-03-16 .
- Bibliografia _ Bailey, BK (1969). „Kumaryny z liści Angelicaarchangelica” . Kanadyjski Dziennik Chemii . 47 (13): 2425–2430. doi : 10.1139/v69-396 .
- ^ Ashwood-Smith, MJ; Grant, El; Heddle, JA; Friedman, Wielka Brytania (1977-06-01). „Uszkodzenie chromosomów w komórkach chomika chińskiego uczulonych na światło bliskie ultrafioletowi przez psoralen i angelicynę”. Badania mutacji / podstawowe i molekularne mechanizmy mutagenezy . 43 (3): 377–385. doi : 10.1016/0027-5107(77)90059-8 . ISSN 0027-5107 . PMID 561302 .
- ^ a b Bonner, James; Varner, JE (29.07.2016). Biochemia Roślin . Elsevier. ISBN 9781483267807 .
- ^ a b Jakub, Mikołaj; Kirsch, Gilbert; Slusarenko, Alan; Winyard, Paul G.; Burkholz, Torsten (2014-11-25). Najnowsze postępy w produktach roślinnych i mikrobiologicznych o działaniu redoks: od podstawowej chemii do powszechnych zastosowań w medycynie i rolnictwie . Skoczek. ISBN 9789401789530 .
- ^ a b Arnold, JWE (1976). Biologia roślin fenolowych . Tom. 4. Edukacja biochemiczna.
- ^ a b c Larbat, Romain; Hehn, Alain; Hans, Joachim; Schneider, Sarah; Jugdé, Hélène; Schneider, Bernd; Matern, Ulrich; Bourgaud, Frédéric (2009-02-20). „Izolacja i charakterystyka funkcjonalna CYP71AJ4 kodującego pierwszą monooksygenazę P450 kątowej biosyntezy furanokumaryny” (PDF) . Journal of Biological Chemistry . 284 (8): 4776–4785. doi : 10.1074/jbc.M807351200 . ISSN 0021-9258 . PMID 19098286 . S2CID 33058404 .
- ^ Stanjek, Volker; Boland, Wilhelm (1998-09-09). „Biosynteza kątowych furanokumaryn: mechanizm i stereochemia oksydacyjnej dealkilacji kolumbianetyny do angelicyny w Heracleum mantegazzianum (Apiaceae)”. Helvetica Chimica Acta . 81 (9): 1596-1607. doi : 10.1002/(SICI)1522-2675(19980909)81:9<1596::AID-HLCA1596>3.0.CO;2-F .
- ^ a b c d Zou, Yefen; Lobera, Mercedes; Snider, Barry B. (2005-03-04). „Synteza 2,3-dihydro-3-hydroksy-2-hydroksyloalkilobenzofuranów z aldehydów epoksy. Jednoetapowe syntezy brosimakutyny G, vaginidiolu, vaginolu, smyrindiolu, ksantoarnolu i Avicenolu. Biomimetyczne syntezy angelicyny i psoralenu”. Journal of Chemii Organicznej . 70 (5): 1761–1770. doi : 10.1021/jo047974k . ISSN 0022-3263 . PMID 15730299 .
- ^ Shults, EE; Ganbaatar, Zh; Petrova, Tennessee; Shakirov, MM; Bagryanskaya, I. Yu; Taraskin, VV; Radnajewa, LD; Otgonsuren, D.; Pokrowski, AG (2012-05-01). „Kumaryny roślinne. IX.* Związki fenolowe Ferulopsis hystrix rosnące w Mongolii. Cytotoksyczne działanie 8,9-dihydrofurokumaryn”. Chemia związków naturalnych . 48 (2): 211–217. doi : 10.1007/s10600-012-0207-3 . ISSN 0009-3130 . S2CID 46726721 .
- ^ a b Young, AR (czerwiec 1990). „Fotokarcynogenność psoralenów stosowanych w leczeniu PUVA: stan obecny u myszy i człowieka”. Journal of Photochemistry and Photobiology B: Biologia . 6 (1–2): 237–247. doi : 10.1016/1011-1344(90)85093-C . ISSN 1011-1344 . PMID 2121937 .
- ^ a b Matz, Hagit (styczeń 2010). „Fototerapia łuszczycy: co wybrać i jak stosować: fakty i kontrowersje”. Kliniki Dermatologii . 28 (1): 73–80. doi : 10.1016/j.clindermatol.2009.04.003 . ISSN 1879-1131 . PMID 20082955 .
- Bibliografia _ Carlassare, F.; Baccichetti, F.; Guiotto, A.; Rodighiero, P.; Vedaldi, D.; Dall'Acqua, F. (1979-06-01). „4,5'-dimetyloangelicyna: nowy jednofunkcyjny środek wiążący fotogeny DNA *”. Fotochemia i fotobiologia . 29 (6): 1063–1070. doi : 10.1111/j.1751-1097.1979.tb07821.x . ISSN 1751-1097 . PMID 388472 . S2CID 40307307 .
- ^ Dall'Acqua, F.; Terbojewicz, M.; Marciani S.; Vedaldi, D.; Recher, M. (1978-04-01). „Badanie ciemnej interakcji między furokumarynami a DNA”. Interakcje chemiczno-biologiczne . 21 (1): 103–115. doi : 10.1016/0009-2797(78)90071-6 . ISSN 0009-2797 . PMID 566637 .
- Bibliografia _ Lo Presti, E.; Menozzi, G.; Marzano, C.; Baccichetti, F.; Falcone, G.; Filippelli W.; Piucci, B. (sierpień 1998). „Synteza heteroanalogów angelicyny: wstępne badania fotobiologiczne i farmakologiczne”. Farmaco (Societa Chimica Italiana: 1989) . 53 (8–9): 602–610. doi : 10.1016/S0014-827X(98)00076-7 . hdl : 11577/2470046 . ISSN 0014-827X . PMID 10081825 .
- ^ a b Caffieri, S .; Lucchini, V.; Rodighiero, P.; Miolo, G.; Dall'Acqua, F. (listopad 1988). „3,4 i 4',5'-fotocykloprzewody między 4'-metyloangelicyną a tyminą z DNA”. Fotochemia i fotobiologia . 48 (5): 573–577. doi : 10.1111/j.1751-1097.1988.tb02866.x . ISSN 0031-8655 . PMID 3241830 . S2CID 32844266 .
- ^ Dall'Acqua, F.; Marciani S.; Ciavatta, L.; Rodighiero, G. (1971). „Tworzenie wiązań krzyżowych między niciami w fotoreakcjach między furanokumarynami a DNA” . Zeitschrift für Naturforschung B . 26 (6): 561–569. doi : 10.1515/znb-1971-0613 . PMID 4397973 .
- ^ Dall'Acqua, F.; Martelli, P. (luty 1991). „Fotouczulające działanie furokumaryn na składniki błony i wynikające z tego zdarzenia wewnątrzkomórkowe”. Journal of Photochemistry and Photobiology B: Biologia . 8 (3): 235–254. doi : 10.1016/1011-1344(91)80082-S . ISSN 1011-1344 . PMID 1904925 .
- ^ a b Caffieri, S .; Daga, A.; Vedaldi, D.; Dall'Acqua, F. (1988-12-01). „Fotoaddycja angelicyny do estru metylowego kwasu linolenowego”. Journal of Photochemistry and Photobiology B: Biologia . 2 (4): 515–521. doi : 10.1016/1011-1344(88)85080-2 . ISSN 1011-1344 . PMID 3150003 .
- ^ Veronese, FM; Bevilacqua, R; Schiavon, O; Rodighiero, G. (1979). „Interakcja lek-białko: wiązanie furokumaryn z białkami osocza”. Il Farmaco; Edycja naukowa . 34 (8): 716–25. ISSN 0430-0920 . PMID 467637 .
- ^ Veronese, FM; Schiavon, O.; Bevilacqua, R.; Bordin, F.; Rodighiero, G. (1982-07-01). „Fotoinaktywacja enzymów przez liniowe i kątowe furokumaryny”. Fotochemia i fotobiologia . 36 (1): 25–30. doi : 10.1111/j.1751-1097.1982.tb04335.x . ISSN 1751-1097 . PMID 6287507 . S2CID 42986954 .
- ^ Veronese, FM; Schiavon, O.; Bevilacqua, R.; Bordin, F.; Rodighiero, G. (1981-09-01). „Wpływ psoralenów i angelicyn na białka w obecności promieniowania UV-a”. Fotochemia i fotobiologia . 34 (3): 351–354. doi : 10.1111/j.1751-1097.1981.tb09369.x . ISSN 1751-1097 . PMID 7280051 .
- ^ „Karta danych dotyczących bezpieczeństwa materiału” (PDF) . Sigma-Aldrich .
- ^ ab E. Gorgus, C. Lohr, N. Raquet , S. Guth i D. Schrenk. Limetyna i furokumaryny w napojach zawierających soki lub ekstrakty cytrusowe . Toksykologia żywności i substancji chemicznych, 48(1):93–98, 2010.
- ^ BV Davidov A. Ya. Potapenko, VL Suchorukow. Porównanie działania fotouczulającego skórę 8-metoksypsoralenu i angelicyny . Experientia 40, strony 264–265, 1982.
- ^ abc Christiane Lohr, Nicole Raquet i Dieter Schrenk. Zastosowanie koncepcji względnych sił fotomutagennych do wybranych furokumaryn w komórkach V79 . Toksykologia in vitro, 24(2):558–566, 2010.
- ^ b Alley , Amanda (sierpień 1987). „Pasternak i furokumaryny”. Toksykologia żywności i substancji chemicznych . 25 (8): 634–635. doi : 10.1016/0278-6915(87)90033-0 .
- ^ a b Baumgart, Annette; Schmidt, Melanie; Schmitz, Hans-Joachim; Schrenk, Dieter (15 lutego 2005). „Naturalne furokumaryny jako induktory i inhibitory cytochromu P450 1A1 w hepatocytach szczura”. Farmakologia biochemiczna . 69 (4): 657–667. doi : 10.1016/j.bcp.2004.11.017 . PMID 15670584 .