Proteaza romboidalna
| Romboidalna | |||||||||
|---|---|---|---|---|---|---|---|---|---|
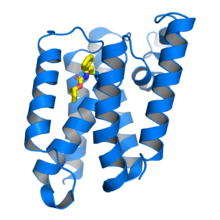
proteaza romboidalna Escherichia coli GlpG w kompleksie z inhibitorem beta-laktamu (żółty) związanym z katalityczną resztą seryny . od .
| |||||||||
| Identyfikatory | |||||||||
| Symbol | Romboid | ||||||||
| Pfam | PF01694 | ||||||||
| Klan Pfam | CL0207 | ||||||||
| InterPro | IPR002610 | ||||||||
| MEROPY | S54 | ||||||||
| SCOP2 | 144092 / ZAKRES / SUPFAM | ||||||||
| Nadrodzina OPM | 165 | ||||||||
| Białko OPM | 2ic8 | ||||||||
| |||||||||
Proteazy romboidalne to rodzina enzymów , które występują u prawie wszystkich gatunków. Są proteazami : przecinają łańcuch polipeptydowy innych białek. To rozszczepienie proteolityczne jest nieodwracalne w komórkach i jest ważnym rodzajem regulacji komórkowej. Chociaż proteazy są jedną z najwcześniejszych i najlepiej zbadanych klas enzymów, romboidy należą do znacznie później odkrytego typu: proteaz wewnątrzbłonowych . Cechą charakterystyczną proteaz wewnątrzbłonowych jest to, że ich miejsca aktywne są ukryte w dwuwarstwie lipidowej błony komórkowe i rozszczepiają inne białka transbłonowe w swoich domenach transbłonowych . Około 30% wszystkich białek ma domeny transbłonowe, a ich regulowane przetwarzanie często ma poważne konsekwencje biologiczne. W związku z tym romby regulują wiele ważnych procesów komórkowych i mogą być zaangażowane w szeroki zakres chorób człowieka.
Proteazy wewnątrzbłonowe
Romboidy to wewnątrzbłonowe proteazy serynowe . Innymi typami proteaz wewnątrzbłonowych są aspartylowe i metaloproteazy . Rodzina prezenilin i peptydów sygnałowych podobnych do peptydaz , które są wewnątrzbłonowymi proteazami aspartylowymi, rozszczepiają substraty , które obejmują receptor Notch i białko prekursorowe amyloidu , które jest zaangażowane w chorobę Alzheimera . Rodzina proteaz site- 2 , które są wewnątrzbłonowymi metaloproteazami, regulują między innymi biosyntezę cholesterolu i reakcje stresowe u bakterii . Różne rodziny proteaz wewnątrzbłonowych są ewolucyjnie i mechanicznie niepowiązane, ale istnieją wyraźne wspólne motywy funkcjonalne, które je łączą. Romboidy są prawdopodobnie najlepiej scharakteryzowaną klasą.
Historia
Romboidy zostały po raz pierwszy nazwane na cześć mutacji muszki owocowej Drosophila , odkrytej w słynnym badaniu genetycznym, które doprowadziło do Nagrody Nobla dla Christiane Nüsslein-Volhard i Erica Wieschausa . Na tym ekranie znaleźli szereg mutantów o podobnych fenotypach: „spiczaste” embrionalne szkielety głów. Każdemu z nich nazwali spiczaste imię – jeden był romboidalny. Początkowo zauważono to, ponieważ mutacja zakłóciła rozwój, później analiza genetyczna wykazała, że ta grupa genów była członkami receptora naskórkowego czynnika wzrostu (EGF) szlak sygnałowy, a ten romb był potrzebny do wygenerowania sygnału, który aktywuje receptor EGF. Rozwikłanie molekularnej funkcji rombu zajęło nieco więcej czasu, ale połączenie genetyki i technik molekularnych doprowadziło do odkrycia, że Drosophila i inni członkowie rodziny byli pierwszymi znanymi wewnątrzbłonowymi proteazami serynowymi.
Funkcjonować
Romboidy zostały po raz pierwszy odkryte jako proteazy, które regulują sygnalizację receptora EGF u Drosophila . Uwalniając zewnątrzkomórkową domenę czynnika wzrostu Spitz, z jego transbłonowego prekursora, romboidalny wyzwala sygnalizację. Od tego czasu zaproponowano wiele innych ważnych funkcji biologicznych.
- Później wykazano, że Rhomboid-1 Drosophilas reguluje sen dzięki nowej funkcji już odkrytego mechanizmu.
- Chociaż mniej ugruntowane niż u Drosophila , istnieją pewne dowody na to, że romboidy mogą uczestniczyć w sygnalizacji czynnika wzrostu u ssaków, w tym u ludzi. Byli również zaangażowani w efryny , rozszczepienie trombomoduliny białka przeciwzakrzepowego i gojenie się ran .
- Wszystkie eukarionty mają romboid mitochondrialny . Wykazano, że u drożdży kontroluje to funkcję i morfologię mitochondriów poprzez regulację fuzji błony poprzez rozszczepienie podobnej do dynaminy GTPazy zwanej Mgm1p, ortologu ludzkiego OPA1 . U Drosophila mitochondrialny romboid (Rhomboid-7) reguluje również fuzję błony mitochondrialnej. Wydaje się, że Drosophila Opa1 i Rhomboid-7 mają taki sam związek jak u drożdży. Również u ssaków funkcja mitochondriów jest zaburzona u mutantów PARL , romboid mitochondrialny, ale zakres funkcji jest bardziej złożony. PARL reguluje przebudowę cristae mitochondriów , bierze udział w śmierci komórek i metabolizmie , a coraz więcej jest dowodów na jego ważną rolę w chorobie Parkinsona ;
- Romboidy pasożytów Apicomplexan (w tym Plasmodium , czynnik wywołujący malarię i Toxoplasma ) są używane do zmiany położenia między przyczepem do komórki docelowej a wejściem, a większość adhezyn wytwarzanych przez mikronem jest uwalniana z mikronemu przez romboidy. Romboidy są również zaangażowane w patogeniczność innych pasożytów. w Toxoplasma niektóre serpiny hamują romboidy.
- Romboid w bakterii Gram-ujemnej Providencia stuartii jest wymagany do funkcjonowania mechanizmu translokacji białka bliźniaczej argininy (TAT).
- Romboidy kontrolują sygnalizację receptora EGF u Caenorhabditis elegans, podobnie jak u Drosophila .
Struktura
Romboidy były pierwszymi proteazami wewnątrzbłonowymi, dla których rozwiązano strukturę krystaliczną o wysokiej rozdzielczości. Struktury te potwierdziły przewidywania, że rdzeń romboidów składa się z sześciu domen transbłonowych, a miejsce katalityczne zależy od diady katalitycznej seryny i histydyny. Struktury wyjaśniły również, w jaki sposób reakcja proteolityczna, która wymaga cząsteczek wody, może zachodzić w hydrofobowym środowisku dwuwarstwy lipidowej: jedna z głównych tajemnic proteaz wewnątrzbłonowych. Miejsce aktywne proteazy romboidalnej znajduje się we wgłębieniu hydrofilowym, w zasadzie dostępnym dla wody z roztworu zbiorczego. Zaproponowano jednak, że może istnieć mechanizm pomocniczy ułatwiający dostęp cząsteczek wody do diady katalitycznej na dnie miejsca aktywnego w celu zapewnienia wydajności katalitycznej.
Miejsce aktywne proteazy romboidalnej jest chronione z boku od dwuwarstwy lipidowej przez jej sześć składowych helis przezbłonowych, co sugeruje, że dostęp substratu do romboidalnego miejsca aktywnego jest regulowany. Jednym z obszarów niepewności była droga dostępu do substratu . Początkowo proponowano wprowadzanie substratów między segmenty transbłonowe (TMS) 1 i 3, ale obecne dowody silnie wspierają alternatywny punkt dostępu, pomiędzy TMS 2 i 5. Za tym poglądem przemawia również fakt, że mutacje w TMS 5 mają jedynie marginalny wpływ na stabilność termodynamiczną rombu, w przeciwieństwie do innych regiony cząsteczki. Całkiem niedawno, pierwsza w historii struktura kokrystaliczna proteazy wewnątrzbłonowej - wersji romboidalnej proteazy GlpG Escherichia coli - i peptydu pochodzącego z substratu związanego w miejscu aktywnym potwierdza i rozszerza ten model dostępu do substratu i zapewnia implikacje dla mechanizmu innych białek z nadrodziny romboidalnej. [ potrzebne źródło ] GlpG E. coli jest niezwykłe ze względu na niskie powinowactwo wiązania enzym/substrat . Szczegóły, w jaki sposób substrat TMS może być rozpoznawany przez romb, są jednak nadal niejasne. Niektórzy autorzy proponują, aby dostęp do podłoża wymagał dużego ruchu poprzecznego TMS 5 w celu otwarcia rdzenia rombu. Zamiast tego inne raporty sugerują, że duży ruch boczny TMS 5 nie jest wymagany, i sugerują, że powierzchnia TMS 2 i 5 służy raczej jako „wewnątrzbłonowy egzozyt” pośredniczący w rozpoznawaniu substratu TMS. Ortolog romboidalny w D. suzukii to Dsuz\DS10_00004507.
Specyficzność enzymatyczna
Romboidy nie rozszczepiają wszystkich domen transbłonowych. W rzeczywistości są one wysoce specyficzne i mają ograniczoną liczbę substratów. Większość znanych dotychczas naturalnych substratów romboidalnych to białka z pojedynczą domeną transbłonową typu 1, z ich końcami aminowymi w przedziale luminalnym/zewnątrzkomórkowym. Jednak ostatnie badania sugerują, że białko błonowe typu 2 (tj. o przeciwnej topologii: koniec aminowy jest cytoplazmatyczny), a nawet wieloprzebiegowe białka błonowe mogą działać jako substraty romboidalne. Specyfika romboidów leży u podstaw ich zdolności do kontrolowania funkcji w szerokim zakresie procesów biologicznych, a z kolei zrozumienie, co sprawia, że określona domena transbłonowa staje się podłożem romboidalnym, może rzucić światło na funkcję romboidalną w różnych kontekstach.
Wstępne prace wykazały, że romboidy uznają niestabilność transbłonowej alfa-helisy w miejscu rozszczepienia za główną determinantę substratu. Niedawno odkryto, że romboidalne podłoża są definiowane przez dwa oddzielne elementy: domenę transbłonową i motyw sekwencji pierwszorzędowej w niej lub bezpośrednio do niej przylegającej. Ten motyw rozpoznawania kieruje, gdzie podłoże jest rozszczepiane, co może wystąpić w obrębie domeny transbłonowej lub tuż poza nią, w regionie przybłonowym. W pierwszym przypadku reszty destabilizujące helisę poniżej substratu TMS są również niezbędne do wydajnego rozszczepienia. Szczegółowa analiza kinetyki enzymów faktycznie wykazała, że interakcje motywu rozpoznawania z romboidalnym miejscem aktywnym determinują k kot rozszczepiania podłoża. Zasady rozpoznawania substratu TMS przez romboidy pozostają słabo poznane, ale liczne dowody wskazują, że romboidy (a być może także inne proteazy wewnątrzbłonowe ) w jakiś sposób rozpoznają strukturalną elastyczność lub dynamikę domeny transbłonowej ich substratów. Pełne zrozumienie związanych z tym zasad biofizycznych i strukturalnych będzie wymagało charakterystyki strukturalnej kompleksu romboidalnego z pełnym podłożem transbłonowym. Jako pierwszy krok w kierunku tego celu, niedawna struktura kokryształu enzymu w kompleksie z peptydem zawierającym substrat zawierający inhibitor oparty na mechanizmie wyjaśnia strukturalnie obserwowane preferencje sekwencji motywów rozpoznawania w substratach romboidalnych i zapewnia znaczny postęp w obecnym zrozumienie specyficzności romboidalnej i mechanizmu białek z rodziny romboidalnej.
W niektórych bakteriach Gram-ujemnych , w tym Shewanella i Vibrio , znaleziono do trzynastu białek z GlyGly-CTERM, C-końcową domeną homologii składającą się z motywu bogatego w glicynę, wysoce hydrofobowej helisy transbłonowej i skupiska reszt zasadowych. Ta domena wydaje się być sekwencją rozpoznawaną przez rombosortazę, gałąź rodziny proteaz romboidalnych, ograniczoną tylko do tych bakterii z domeną GlyGly-CTERM.
Znaczenie medyczne
, zakażeniu pasożytami że zależą od romboidów, znajduje odzwierciedlenie w dowodach na to, że romboidy odgrywają rolę w różnych chorobach, w tym w raku , i cukrzycy . [ Potrzebne źródło ] Należy jednak zauważyć, że nie ma jeszcze ustalonego przypadku, w którym dokładne znaczenie medyczne zostałoby w pełni potwierdzone.
Nie zgłoszono jeszcze żadnych leków modulujących aktywność romboidalną, chociaż ostatnie badania zidentyfikowały małocząsteczkowe inhibitory oparte na mechanizmach, które mogą stanowić podstawę do przyszłego opracowywania leków.
Rodzina romboidalna
Wydaje się, że proteazy romboidalne są konserwatywne u wszystkich eukariotów i ogromnej większości prokariotów . Analiza bioinformatyczna podkreśla, że niektórym członkom rodziny romboidalnej brakuje reszt aminokwasowych niezbędnych do proteolizy, co sugeruje, że nie mogą rozszczepiać substratów. Te „pseudoproteazy” obejmują podrodzinę nazwaną iRhoms (znaną również jako RHBDF1 i RHBDF2 ). iRhoms może promować degradację związaną z ER (ERAD) ligandów receptora EGF u Drosophila , zapewniając w ten sposób mechanizm regulacji aktywności receptora EGF w mózgu. Oznacza to, że organizmy wielokomórkowe wykorzystują podstawowy mechanizm kontroli jakości komórek do regulowania sygnalizacji między komórkami. U myszy iRhoms są kluczowymi opiekunami handlu wymaganymi do eksportu ER ADAM17 / TACE i jego dojrzewania. iRhomy są zatem wymagane do TNF-alfa i EGF , co czyni je wysoce atrakcyjnymi medycznie.
Analiza filogenetyczna wskazuje, że romboidy są w rzeczywistości członkami większej romboidalnej nadrodziny lub klanu, który obejmuje białka derlin , również zaangażowane w ERAD.
Kinetoplastydy mają niezwykle mały repertuar rodziny romboidalnej, u Trypanosoma brucei XP 001561764 i XP 001561544 oraz u T. cruzi XP 805971, XP 802860 i XP 821055.
Różne białka rodziny romboidalnej są niezbędne dla wirulencji i ruchliwości Toxoplasma gondii , w tym TgMIC2, TgMIC6, różne warianty AMA1, w tym TgAMA1, TgROM1, TgROM4 i TgROM5.
trypanosomów mają TimRhom I i TimRhom II (dwóch romboidalnych członków rodziny z dezaktywowaną funkcją proteolityczną) w translokazach presekwencji. Trudność w znalezieniu większego podobieństwa do krewnych eukariotycznych lub bakteryjnych może oznaczać, że były one częścią pierwotnego progenitorowego mitochondrialnego. Pokrewne romboidy mogą być białkami transportującymi błonę w systemach ERAD i SELMA.
iRhoms
iRhomy są białkami romboidalnymi, ale nie są proteazami. Podobnie jak romboidy, po raz pierwszy odkryto je u Drosophilae . Jednak w przeciwieństwie do romboidów, iRhomy hamują sygnalizację EGFr. Myszy z nokautem dla iRhom2 mają poważny upośledzenie odporności.
Dalsza lektura
Linki zewnętrzne
- „Podsumowanie rodziny S54 (Romboidalna rodzina)” . MEROPY .
- „EC 3.4.21.105” . Expasy . SIB Szwajcarski Instytut Bioinformatyki.