Iminoglicynuria
| Iminoglicynuria | |
|---|---|
| Inne nazwy | Rodzinna iminoglicynuria |
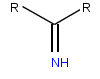 | |
| Imina , grupa funkcyjna występująca w iminokwasach | |
| Specjalność |
Endokrynologia |
Iminoglicynuria jest autosomalnym recesywnym zaburzeniem transportu kanalikowego nerki, wpływającym na reabsorpcję aminokwasu glicyny oraz iminokwasów proliny i hydroksyproliny . Powoduje to nadmierne wydalanie z moczem wszystkich trzech kwasów ( -uria oznacza „w moczu”).
Iminoglicynuria jest rzadkim i złożonym zaburzeniem, związanym z wieloma mutacjami genetycznymi , które powodują defekty zarówno w nerkowym, jak i jelitowym systemie transportu glicyny i iminokwasów.
Iminokwasy zazwyczaj zawierają iminową grupę funkcyjną zamiast grupy aminowej występującej w aminokwasach. Prolina jest uważana i zwykle określana jako aminokwas, ale w przeciwieństwie do innych ma drugorzędową aminę. Ta cecha, unikalna dla proliny, identyfikuje prolinę również jako iminokwas. Hydroksyprolina to kolejny iminokwas, powstały w wyniku naturalnie występującej hydroksylacji proliny.
Prezentacja
Podstawową cechą iminoglicynurii jest obecność glicyny i iminokwasów w moczu. W przeciwnym razie uważa się, że jest to stosunkowo łagodne zaburzenie, chociaż objawy związane z zaburzeniami metabolizmu proliny i glicyny spowodowane złym wchłanianiem mogą występować w przypadku iminoglicynurii. Należą do nich encefalopatia , upośledzenie umysłowe , głuchota , ślepota , kamienie nerkowe , nadciśnienie i zanik mięśnia sercowego .
Atrofia bezkręgowa jest dziedzicznym schorzeniem zwyrodnieniowym siatkówki i naczyniówki , czasami towarzyszącym stanowi metabolicznemu hiperornitynemii . Obecność atrofii bezkręgowców z iminoglicynurią wynika z niedoboru proliny w tkankach naczyniówkowo-siatkówkowych , podczas gdy procesy stojące za hiperornitynemią zakłócają szlak metaboliczny od ornityny do proliny, co zmienia katabolizm ornityny, a także powoduje obniżenie poziomu proliny. Tak więc atrofię wirową można znaleźć w obu zaburzeniach, z niedoborem proliny jako cechą podstawową.
Kolejnym zaburzeniem wpływającym na reabsorpcję glicyny i iminokwasów jest hiperglicynuria, podobna do iminoglicynurii i uważana za postać heterozygotyczną . Gdy towarzyszy jej określony typ kamieni nerkowych (kamica nerkowa), czasami określa się ją jako „iminoglicynurię typu II”.
Genetyka

Uważa się, że iminoglicynuria jest dziedziczona autosomalnie recesywnie. Oznacza to, że wadliwy gen odpowiedzialny za zaburzenie znajduje się w autosomie , a dziedziczenie wymaga dwóch kopii wadliwego genu — po jednej od każdego z rodziców. Rodzice osoby z zaburzeniem dziedziczonym autosomalnie recesywnie oboje są nosicielami jednej kopii wadliwego genu, ale zwykle nie doświadczają żadnych oznak ani objawów tego zaburzenia. [ potrzebne źródło ]
Niedziedziczna przyczyna nadmiernego wydalania proliny i glicyny z moczem, podobna do występującej w iminoglicynurii, jest dość powszechna u noworodków w wieku poniżej sześciu miesięcy. Czasami określany jako iminoglicynuria noworodków, jest spowodowany niedorozwojem mechanizmów transportu o wysokim powinowactwie w obrębie obwodu nerkowego, w szczególności PAT2, SIT1 i SLC6A18. Stan koryguje się z wiekiem. Jednak w przypadkach, gdy utrzymuje się to po okresie dzieciństwa, można podejrzewać wrodzoną hiperglicynurię lub iminoglicynurię.
Patofizjologia
Glicyna, prolina i hydroksyprolina mają wspólne mechanizmy wchłaniania zwrotnego w kanalikach nerkowych , funkcję specyficzną dla kanalików proksymalnych . Zarówno reabsorpcja, jak i absorpcja glicyny i iminokwasów zachodzi odpowiednio w kanaliku proksymalnym lub nabłonku rąbka szczoteczkowego jelita . Bardziej selektywny transport proliny i innych iminokwasów jest napędzany na poziomie molekularnym przez ssaków , trafnie znany jako system IMINO.
Chociaż nie ustalono żadnej pojedynczej mutacji genetycznej jako przyczyny iminoglicynurii; kilka mutacji wpływających na mechanizmy transportu wspólne dla glicyny, proliny i hydroksyproliny, a także te, które selektywnie transportują glicynę lub iminokwasy, w tym system IMINO, są związane z zaburzeniem. W połączeniu czynniki te dadzą zmienny fenotyp dla iminoglicynurii w zależności od obecnych mutacji. Jednak pomimo roli, jaką jelitowe wchłanianie glicyny i iminokwasów może odgrywać w iminoglicynurii, pierwotna wada zaburza ich transport nerkowy i reabsorpcję. Jest to oczywiste, ponieważ dziedziczna iminoglicynuria może występować klinicznie bez zajęcia jelit.
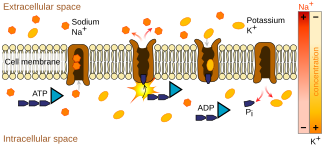
U ssaków, w tym ludzi , transport aminokwasów i iminokwasów ze światła (wnętrza) jelita lub kanalików proksymalnych nerki do komórek odbywa się przez błonę rąbka szczoteczkowego nabłonka (wilgotna, ciasno upakowana wyściółka komórkowa wielu tkanek i narządy ciała). Tutaj kotransportery takie jak sód czy chlor (wchodzące w skład systemu kotransporterów Na-K-Cl ) sprzęgają się z aminokwasami lub iminokwasami na poziomie molekularnym i transportują je przez specyficzne integralne białka błonowe , które tworzą kanały jonowe , które znajdują się w błonie komórkowej . Z komórek wchłonięte lub ponownie wchłonięte aminokwasy i iminokwasy ostatecznie docierają do krwi. Wchłanianie odnosi się do ogólnego procesu zachodzącego w jelicie zamiast normalnego rozkładu białek w trawieniu, podczas gdy wchłanianie zwrotne odnosi się do procesu zachodzącego w proksymalnym kanaliku nerkowym w celu odzyskania aminokwasów i iminokwasów, które zostały odfiltrowane z krwi przez kłębuszki nerkowe . [ potrzebne źródło ]
Te formy transportu wymagają energii, ponieważ transportowane produkty zwykle poruszają się w kierunku przeciwnym do wyższego gradientu stężeń . Ten proces, zwany transportem aktywnym , czerpie energię z ATP i innych systemów kotransportu związanych z ATP , które wytwarzają energię, takich jak pompa sodowo-potasowa . [ potrzebne źródło ]
Mechanizm
Podstawowym defektem związanym z iminoglicynurią jest homozygotyczna (recesywna) mutacja genu SLC36A2 (PAT2). Jedno z kilku białek transportujących błony z rodziny transporterów aminokwasów w rozpuszczonych nośnikach , PAT2 jest transporterem nerkowym o wysokim powinowactwie glicyny, proliny i hydroksyproliny, który okazał się wadliwy w obu allelach gdy u osobnika występuje iminoglicynuria. Kontrastuje to z faktem, że gdy tylko jeden allel PAT2 jest wadliwy, zamiast iminoglicynurii będzie obecna hiperglicynuria. Odkrycia te określają iminoglicynurię jako homozygotyczną postać hiperglicynurii, przy czym ta pierwsza ma wyższy stopień wydalania glicyny i iminokwasów z moczem, co koreluje z mutacjami w obu allelach.
Inną mutację podejrzewaną o przenoszenie fenotypu iminoglicynurii można znaleźć w genie SLC36A1 (PAT1). Zidentyfikowany jako jelitowy transporter glicyny i iminokwasów o niskim powinowactwie, PAT1 współpracuje z nerkowym wymieniaczem sodowo-wodorowym NHE3 ( SLC9A3 ). Ponieważ wchłanianie i reabsorpcja glicyny, proliny i hydroksyproliny zachodzi również przez PAT1, uważa się, że odgrywa inną rolę w wyrażaniu fenotypu złego wchłaniania iminoglicynurii. Ostatnie doniesienia sugerują jednak bardziej zmniejszoną rolę PAT1 w niektórych przypadkach zaburzenia.
Chociaż PAT2 jest silnie wskazany jako główny mutagen odpowiedzialny za iminoglicynurię, stwierdzono, że zmienność fenotypu jest spowodowana trzema modyfikującymi mutacjami genetycznymi. Uważa się, że najważniejszym z nich jest system IMINO.
Zdefiniowany jako zależny od sodu transporter proliny, który nie jest hamowany przez alaninę , system IMINO, uważany za utworzony przez gen SLC6A20 (SIT1), jest kluczowym mechanizmem transportowym ssaków, odpowiedzialnym zarówno za resorpcję zwrotną w nerkach, jak i wchłanianie jelitowe proliny i innych iminokwasów, takich jak jak hydroksyprolina i pipekolan. Sekwencja mRNA dla SIT1 ulega ekspresji w wielu częściach przewodu pokarmowego , w tym w żołądku , dwunastnicy , jelicie czczym , jelicie krętym , jelicie ślepym i okrężnica . Występuje również w nerkach , naczyniówce optycznej i częściach ośrodkowego układu nerwowego, takich jak mózg i komórki mikrogleju .
Zmniejszona penetracja to zjawisko, w którym w pełni odziedziczona cecha genetyczna, taka jak choroba lub zaburzenie, nie wykazuje oczekiwanego fenotypu. Zgłaszano to w niektórych przypadkach iminoglicynurii. W tym przypadku uważa się, że system IMINO odgrywa rolę w zmniejszonej penetracji iminoglicynurii poprzez kompensację złego wchłaniania iminokwasów związanego konkretnie z mutacjami PAT2. I odwrotnie, uważa się, że mutacje SIT1 powodują pełną ekspresję iminoglicynurii w niektórych przypadkach, w których heterozygotyczne mutacje PAT2 byłyby w przeciwnym razie wystarczające tylko do wywołania hiperglicynurii.
Uważa się, że dwa inne systemy transportowe odgrywają kolejne role w iminoglicynurii, gdy występują w nich mutacje. Neutralny transporter aminokwasów SLC6A19 (wpływający na glicynę , prolinę i inne obojętne aminokwasy, takie jak cysteina i tryptofan ), związany z chorobą Hartnupa , odgrywa rolę w iminoglicynurii jako modyfikator mutacji PAT2, a także bezpośrednio wpływa na niego działanie SIT1. Transporter specyficzny dla glicyny, SLC6A18 , ma również wpływ na fenotyp iminoglicynurii poprzez łączenie lub kompensację niepowodzeń transportu glicyny.
Podsumowując, iminoglicynuria jest wyrażana głównie przez homozygotyczne mutacje transportera nerkowego PAT2, podczas gdy ogólny fenotyp iminoglicynurii może być modyfikowany przez normalną lub wadliwą aktywność SIT1 (IMINO), SLC6A19 i SLC6A18 .