Teikoplanina
 | |
| Dane kliniczne | |
|---|---|
| Wymowa |
/ ˌ t aɪ k oʊ ˈ p l eɪ n ɪ n / TY -koh- PLAY -nin |
| Nazwy handlowe | Targocid |
| AHFS / Drugs.com | Międzynarodowe nazwy leków |
| Kategoria ciąży |
|
Drogi podania |
Dożylnie , domięśniowo |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Biodostępność | 90% (podany komunikator internetowy ) |
| Wiązanie białek | 90% do 95% |
| Metabolizm | Zero |
| Okres półtrwania w fazie eliminacji | 70 do 100 godzin |
| Wydalanie | Nerki (97% bez zmian) |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| Bank Leków | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEMBL | |
| NIAID ChemDB | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Dane chemiczne i fizyczne | |
| Formuła | Zmienny |
| Masa cząsteczkowa | 1564,3 do 1907,7 g/mol |
| Temperatura topnienia | 260 ° C (500 ° F) (rozkład) |
| |
|
| |
Teikoplanina jest antybiotykiem stosowanym w profilaktyce i leczeniu ciężkich zakażeń wywołanych przez bakterie Gram-dodatnie , w tym oporne na metycylinę Staphylococcus aureus i Enterococcus faecalis . Jest to półsyntetyczny antybiotyk glikopeptydowy o spektrum działania zbliżonym do wankomycyny . Jej mechanizm działania polega na hamowaniu syntezy ściany komórkowej bakterii.
Teikoplanina jest sprzedawana przez firmę Sanofi-Aventis pod nazwą handlową Targocid . Inne nazwy handlowe obejmują Ticocin sprzedawany przez firmę Cipla (Indie).
Wykazano, że doustna teikoplanina jest skuteczna w leczeniu rzekomobłoniastego zapalenia jelita grubego i biegunki związanej z Clostridium difficile , ze skutecznością porównywalną z wankomycyną.
Uważa się, że jego siła wynika z długości łańcucha węglowodorowego.
Teikoplanina jest wytwarzana przez tzw. „rzadką” aktynobakterię Actinoplanes teichomyceticus ATCC 31121, należącą do rodziny Micromonosporaceae . Ścieżka biosyntezy prowadząca do teikoplaniny oraz obwód regulacyjny regulujący biosyntezę były w ostatnich latach intensywnie badane, co pozwoliło na zbudowanie zintegrowanego modelu biosyntezy.
Dane dotyczące wrażliwości
Teikoplanina celuje w syntezę peptydoglikanu, dzięki czemu jest skutecznym środkiem przeciwbakteryjnym przeciwko bakteriom Gram-dodatnim, w tym Staphylococci i Clostridium spp. Poniżej przedstawiono dane dotyczące wrażliwości MIC dla kilku istotnych medycznie patogenów:
- Clostridium difficile : 0,06 μg/ml - 0,5 μg/ml
- Staphylococcus aureus : ≤0,06 μg/ml - ≥128 μg/ml
- Staphylococcus epidermidis : ≤0,06 μg/ml - 32 μg/ml
Chemia
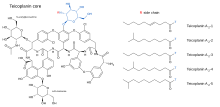
teikoplaniną sprzedawana przez firmę Sanofi Aventis Ltd) jest w rzeczywistości mieszaniną kilku związków, pięciu głównych (nazwanych teikoplaniną od A2-1 do A2-5 ) i czterech drugorzędnych ( nazwanych od RS - 1 do RS - 4 ). Wszystkie teikoplaniny mają ten sam glikopeptydowy , określany jako teikoplanina A 3-1 dwa — skondensowaną strukturę pierścieniową , z którą łączą się węglowodany ( mannoza i N -acetyloglukozamina ) są dołączone. Główne i drugorzędne składniki zawierają również trzecie ugrupowanie węglowodanowe — β- D -glukozaminę — i różnią się jedynie długością i konformacją przyłączonego do niego łańcucha bocznego .
Struktury rdzenia teikoplaniny i łańcuchów bocznych, które charakteryzują pięć głównych związków teikoplaniny, przedstawiono poniżej.

Teikoplanina odnosi się do kompleksu powiązanych produktów naturalnych wyizolowanych z bulionu fermentacyjnego szczepu Actinoplanes teichomyceticus , składających się z grupy pięciu struktur. Struktury te posiadają wspólny aglikon lub rdzeń, składający się z siedmiu aminokwasów związanych wiązaniami peptydowymi i eterowymi, tworząc układ czterech pierścieni. Te pięć struktur różni się tożsamością łańcucha bocznego acylu tłuszczowego przyłączonego do cukru. Pochodzenie tych siedmiu aminokwasów w biosyntezie teikoplaniny badano za pomocą magnetycznego rezonansu jądrowego 1H i 13C . Badania wskazują na aminokwasy 4-Hpg , 3-Cl-Tyr i 3-chloro-β-hydroksytyrozyna pochodzą od tyrozyny, a aminokwas 3,5-dihydroksyfenyloglicyna (3,5-Dpg) pochodzi od octanu. Teikoplanina zawiera 6 aminokwasów niebiałkowych i trzy reszty cukrowe, N -acylo-β-D-glukozaminę, N -acetylo-β-D-glukozaminę i D-mannozę.
Klaster genów
Badanie klastra genetycznego kodującego biosyntezę teikoplaniny zidentyfikowało 49 domniemanych otwartych ramek odczytu (ORF) zaangażowanych w biosyntezę, eksport, oporność i regulację związku. Trzydzieści pięć z tych ORF jest podobnych do tych znalezionych w innych klastrach genów glikopeptydowych. Funkcja każdego z tych genów została opisana przez Li i współpracowników. Podsumowanie układu i celu genu pokazano poniżej.
Układ genów . Geny są ponumerowane. Litery L i R oznaczają kierunek transkrypcji. Obecność symbolu * oznacza, że gen znajduje się po NRP, które są reprezentowane przez A, B, C i D. Na podstawie rysunku z: Li, TL.; Huang, F.; Haydock, SF; Mironenko, T.; Leadlay, PF; Spencer, JB Chemistry & Biology. 2004, 11, s. 109.
[11-L] [10-L] [9-P] [8-P] [7-P] [6-P] [5-P] [4-L][3-L] [2-L] [1-R] [AR] [BR] [CR] [DR] [1*-R] [2*-R] [3*-R] [4*-R] [5*-R] [6* -R] [7*-R] [8*-R] [9*-R] [10*-R] [11*-R] [12*-R] [13*-R] [14*-R ] [15*-R] [16*-R] [17*-R] [18*-R] [19*-R] [20*-R] [21*-R] [22*-R] [ 23*-P] [24*-P] [25*-P] [26*-P] [27*-P] [28*-P] [29*-P] [30*-R][31* -R] [32*-L] [33*-L] [34*-P]
| Enzym wytwarzany przez sekwencję genów | Białka regulatorowe | Inne enzymy | Odporne enzymy | Enzymy biosyntezy Β-hydroksy-tyrozyny i 4-hydroksy-fenyloglicyny | Transferazy glikozylowe | Syntetazy peptydowe | oksygenazy P450 | Halogenaza | Enzymy biosyntezy 3,5-dihydroksyfenyloglicyny |
| Geny | 11, 10, 3, 2, 15*, 16*, 31* | 9, 8, 1*, 2*, 4*, 11*, 13*, 21*, 26*, 27*, 30*, 32*, 33*, 34* | 7, 6, 5 | 4, 12*, 14*, 22*, 23*, 24*, 25*, 28*, 29* | 1, 3*, 10* | A, B, C, D | 5*, 6*, 7*, 9* | 8* | 17*, 18*, 19*, 20*, 23* |
Synteza szkieletu heptapeptydowego
Szkielet heptapeptydowy teikoplaniny składa się z nierybosomalnych syntetaz peptydowych (NRPS) TeiA, TeiB, TeiC i TeiD. Razem składają się one z siedmiu modułów, z których każdy zawiera pewną liczbę domen, przy czym każdy moduł jest odpowiedzialny za włączenie pojedynczego aminokwasu. Moduły 1, 4 i 5 aktywują L-4-Hpg jako aminoacylo-AMP, moduły 2 i 6 aktywują L-Tyr, a moduły 3 i 7 aktywują L-3,5-Dpg. Aktywowane aminokwasy są kowalencyjnie związane z NRPS jako tioestry przez kofaktor fosfopantetenowy, który jest przyłączony do domeny peptydylowego białka nośnikowego (PCP). Aminokwasy związane z enzymem są następnie łączone wiązaniami amidowymi w wyniku działania domeny kondensacyjnej (C).
Heptapetyd teikoplaniny zawiera 4 D-aminokwasy, powstałe w wyniku epimeryzacji aktywowanych L-aminokwasów. Każdy z modułów 2, 4 i 5 zawiera domenę epimeryzacji (E), która katalizuje tę zmianę. Moduł 1 nie zawiera domeny E i proponuje się, aby epimeryzacja była katalizowana przez domenę C. W sumie sześć z siedmiu wszystkich aminokwasów szkieletu teikoplaniny składa się z aminokwasów niebiałkowych lub zmodyfikowanych. Jedenaście enzymów jest koordynacyjnie indukowanych w celu wytworzenia tych sześciu wymaganych reszt. Teikoplanina zawiera dwie chlorowane pozycje, 2 (3-Cl-Tyr) i 6 (3-Cl-β-Hty). Halogenaza Tei8* katalizuje halogenowanie obu reszt tyrozynowych. Chlorowanie zachodzi na poziomie aminoacylo-PCP podczas biosyntezy, przed fenolowym sprzęganiem oksydacyjnym, przy czym substratem chlorowania może być tyrozyna lub β-hydroksytyrozyna. Następuje również hydroksylacja reszty tyrozynowej modułu 6 in trans podczas składania szkieletu heptapeptydowego.
Modyfikacja po utworzeniu szkieletu heptapeptydowego
Po utworzeniu szkieletu heptapeptydowego cyklizuje się liniowy związek pośredni związany z enzymem. Badania dysrupcji genów wskazują, że oksygenazy cytochromu P450 są enzymami przeprowadzającymi reakcje sprzęgania. Domena X w końcowym module NRPS jest wymagana do rekrutacji enzymów oksygenazy. OxyB tworzy pierwszy pierścień przez sprzęganie reszt 4 i 6, a następnie OxyE sprzęga reszty 1 i 3. OxyA łączy reszty 2 i 4, po czym następuje utworzenie wiązania CC między resztami 5 i 7 przez OxyC. , że regioselektywność i atropoizomeru tych prawdopodobnych reakcji sprzęgania jednoelektronowego wynikają z wymagań fałdowania i orientacji częściowo usieciowanych substratów w miejscu aktywnym enzymu. Reakcje sprzęgania przedstawiono poniżej.
Wykazano, że po utworzeniu aglikonu heptpeptydowego zachodzi specyficzna glikozylacja. Do glikozylacji aglikonu teikoplaniny wymagane są trzy oddzielne transferazy glikozylowe. Tei10* katalizuje dodanie GlcNAc do reszty 4, a następnie deacetylację przez Tei2*. Łańcuch acylowy (wytworzony w wyniku działania Tei30* i Tei13*) jest następnie dodawany przez Tei11*. Tei1 następnie dodaje drugą GlcNAc do grupy β-hydroksylowej reszty 6, po czym następuje mannozylacja reszty 7 katalizowana przez Tei3*.
