Tikarcylina
 | |
| Dane kliniczne | |
|---|---|
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a685037 |
| Kategoria ciąży |
|
Drogi podania |
Dożylny |
| Kod ATC | |
| Status prawny | |
| Status prawny |
|
| Dane farmakokinetyczne | |
| Wiązanie białek | 45% |
| Okres półtrwania w fazie eliminacji | 1,1 godziny |
| Wydalanie | Nerkowy |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| Bank Leków | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA | 100.047.451 |
| Dane chemiczne i fizyczne | |
| Formuła | C 15 H 16 N 2 O 6 S 2 |
| Masa cząsteczkowa | 384,42 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Tikarcylina jest karboksypenicyliną . Może być sprzedawany i stosowany w połączeniu z kwasem klawulanowym jako tikarcylina/kwas klawulanowy . Ponieważ jest penicyliną, należy również do większej klasy beta-laktamowych . Jego głównym zastosowaniem klinicznym jest antybiotyk do wstrzykiwań w leczeniu Gram-ujemnych , zwłaszcza Pseudomonas aeruginosa i Proteus vulgaris . Jest również jednym z niewielu antybiotyków zdolnych do leczenia Stenotrophomonas maltophilia .
Jest dostarczany w postaci białego lub bladożółtego proszku. Jest dobrze rozpuszczalny w wodzie, ale powinien być rozpuszczany tylko bezpośrednio przed użyciem, aby zapobiec degradacji.
Został opatentowany w 1963 roku.
Mechanizm akcji
Antybiotyczne właściwości tikarcyliny wynikają z jej zdolności do zapobiegania sieciowaniu peptydoglikanu podczas syntezy ściany komórkowej , gdy bakterie próbują się dzielić , powodując śmierć komórki. [ potrzebne źródło ]
Tikarcylina, podobnie jak penicylina , zawiera pierścień β-laktamowy, który może zostać przecięty przez beta-laktamazy , co powoduje inaktywację antybiotyku. Te bakterie, które mogą eksprymować β-laktamazy, są zatem oporne na antybiotyki β-laktamowe. Ze względu, przynajmniej częściowo, na wspólny pierścień β-laktamowy, tikarcylina może powodować reakcje u pacjentów uczulonych na penicylinę. Tikarcylina jest również często łączona z inhibitorem β-laktamazy , takim jak kwas klawulanowy ( co-ticarclav ). [ potrzebne źródło ]
Inne zastosowania
W biologii molekularnej tikarcylina jest stosowana jako alternatywa dla ampicyliny do testowania wychwytu genów markerowych przez bakterie. Zapobiega powstawaniu kolonii satelitarnych, które powstają, gdy ampicylina rozpada się w pożywce. Jest również stosowany w biologii molekularnej roślin do zabijania Agrobacterium , który jest używany do dostarczania genów do komórek roślinnych.
Dawkowanie i podawanie
Tikarcylina nie wchłania się po podaniu doustnym, dlatego należy ją podawać we wstrzyknięciu dożylnym lub domięśniowym.
Nazwy handlowe i preparaty
- Ticarcillin: Ticar był wcześniej sprzedawany przez Beecham , a następnie SmithKline Beecham do 1999 r., kiedy to połączył się z Glaxo, tworząc GlaxoSmithKline ; nie jest już dostępny w Wielkiej Brytanii. Dystrybucja w USA zakończyła się w 2004 roku. Ticar został zastąpiony przez Timentin.
Jednak Timonin zawiera kwas klawulanowy w przeciwieństwie do Ticar
- Tikarcylina/klawulanian : Timentin w Australii, Wielkiej Brytanii i Stanach Zjednoczonych był sprzedawany przez firmę Beecham, a następnie GlaxoSmithKline.
- Dostępny w Indiach jako TICANTROL (TICARCILLIN/ klawulanian) sprzedawany przez SCUTONIX LIFESCIENCES, Bombaj
Synteza
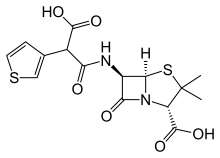
Karbenicylina jest stosowana w klinice przede wszystkim ze względu na jej niską toksyczność i przydatność w leczeniu zakażeń dróg moczowych wywołanych przez wrażliwe gatunki Pseudomonas . Jego niska siła działania, niska aktywność doustna i podatność na bakteryjne beta-laktamazy sprawiają, że jest podatny na zastąpienie przez środki bez tych deficytów. Jednym z pretendentów w tym wyścigu jest tikarycylina. Jego pochodzenie zależało od dobrze znanego faktu, że dwuwartościowa siarka jest z grubsza równoważna grupie winylowej (por. metiopropamina , sufentanyl , pizotylina itp.).
Jedna synteza rozpoczęła się od wytworzenia estru monobenzylowego kwasu 3-tienylomalonowego, przekształcenia go w chlorek kwasowy za pomocą SOCl2 i kondensacji z kwasem 6-aminopenicylanowym (6-APA ) . Hydrogenoliza (Pd/C) zakończyła syntezę tikarcyliny.