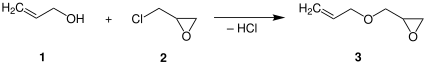Eter allilowo-glicydylowy

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
2-{[(Prop-2-en-1-ylo)oksy]metylo}oksiran |
|
| Inne nazwy 2-[(Alliloksy)metylo]oksiran 1-alliloksy-2,3-epoksypropan Eter allilu glicydylu [(2-propenyloksy)metylo]oksiran |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.003.131 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C6H10O2 _ _ _ _ _ | |
| Masa cząsteczkowa | 114,144 g·mol -1 |
| Wygląd | Bezbarwna ciecz |
| Zapach | przyjemny |
| Gęstość | 0,97 g/ml (20°C) |
| Temperatura topnienia | −100°C; −148 ° F; 173 k |
| Temperatura wrzenia | 154°C; 309 ° F; 427 k |
| 14% (20°C) | |
| Rozpuszczalność w rozpuszczalnikach organicznych | mieszalny (aceton, toluen, oktan) |
| Ciśnienie pary | 2 mmHg (20°C) |
|
Współczynnik załamania światła ( n D )
|
1.4348 (20°C) |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
trujący, lekko drażniący |
| Etykietowanie GHS : | |
| Niebezpieczeństwo | |
| H226, H351, H341, H332, H302, H335, H315, H318, H317, H412 | |
| Punkt zapłonu | 57°C; 135 ° F; 330 tys |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LC 50 ( mediana stężenia )
|
270 ppm (mysz, 4 godz.) 670 ppm (szczur, 8 godz.) |
| NIOSH (limity ekspozycji na zdrowie w USA): | |
|
PEL (dopuszczalny)
|
10 ppm (45 mg/ m3 ) |
|
REL (zalecane)
|
TWA 5 ppm (22 mg/m 3 ) ST 10 ppm (44 mg/m 3 ) [skóra] |
|
IDLH (bezpośrednie zagrożenie)
|
50 str./min |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Eter alliloglicydylowy jest związkiem organicznym stosowanym w klejach i uszczelniaczach oraz jako monomer w reakcjach polimeryzacji . Jest formalnie produktem kondensacji alkoholu allilowego i glicydolu poprzez wiązanie eterowe . Ponieważ zawiera zarówno alkenową , jak i epoksydową , każdą grupę można poddać selektywnej reakcji, aby uzyskać produkt, w którym druga grupa funkcyjna pozostaje nienaruszona do przyszłych reakcji.
Przygotowanie
AGE jest wytwarzany komercyjnie przez eteryfikację alkoholu allilowego epichlorohydryną . Chlorowodór , produkt uboczny ich kondensacji, usuwa się zasadą .
AGE można również zsyntetyzować przez mono- epoksydację eteru diallilowego.
Diepoksydacja drugiego alkenu dałaby eter diglicydylowy .
Eter allilowo-glicydylowy jest chiralny . Większość dróg daje mieszaninę racemiczną . Epoksydacja za pomocą monooksygenazy przebiega enancjoselektywnie .
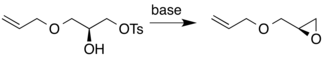
Alternatywnie, nukleofilowa cyklizacja chiralności drugorzędowego alkoholu na pierwszorzędowy tosylan daje chiralny produkt epoksydowy.
Używa
Eter alliloglicydylowy stosowany jest w klejach i uszczelniaczach oraz jako monomer do różnego rodzaju preparatów polimerowych.
Reakcje
Polimeryzacja
Jako związek dwufunkcyjny , grupę alkenową lub grupę epoksydową można poddać selektywnej reakcji z wytworzeniem produktu, w którym druga grupa funkcyjna pozostaje nienaruszona do przyszłych reakcji. Na przykład jeden z nich może być użyty do polimeryzacji liniowej, a drugi do sieciowania .
Rodnikowa polimeryzacja części propylenowej w obecności akrylanu metylu daje kopolimer blokowy o wysokiej zawartości epoksydu. Podobnie można go stosować do produkcji poliwinylokaprolaktamu jako przenoszącego łańcuch .
nukleofilowa grup epoksydowych daje materiał, który ma taki sam szkielet jak glikol polietylenowy , z łańcuchami bocznymi eteru allilowego . Dodatkowe eterowe miejsca Lewisa zmieniają transport jonów w polimerze, a także wpływają na przejściowe sieciowanie międzyłańcuchowe i temperaturę zeszklenia w obecności jonów metali. Te właściwości sugerują, że materiał może mieć zastosowanie jako alternatywny elektrolit do akumulatorów litowo-jonowych . Alkeny można przekształcić w krótkie oligomery glikolu polietylenowego, aby jeszcze bardziej zwiększyć zdolność wiązania jonów i poprawić właściwości otrzymanego materiału.
Kopolimery blokowe z tlenkiem etylenu tworzą micele , które mogą być przydatne do zamykania innych cząsteczek w ramach systemu dostarczania leków . Alkeny tych struktur makrocząsteczkowych można również usieciować poprzez polimeryzację rodnikową.
kwasem Lewisa kopolimeryzacja z dwutlenkiem węgla również daje materiał poliwęglanowy z allilowymi łańcuchami bocznymi, który można dalej opracować.
Hydrosililowanie
Zamiast polimeryzacji grupa alkenowa może ulegać reakcji hydrosililowania z siloksanami w obecności kwasu chloroplatynowego jako katalizatora. Podobnie jak reakcje polimeryzacji, ta reakcja również pozostawia nienaruszony epoksyd. Dzięki tej reakcji eter alliloglicydylowy znajduje zastosowanie jako półprodukt w produkcji powłok silanowych do zastosowań elektrycznych.