Całkowita synteza witaminy B 12
Całkowita synteza złożonej biocząsteczki witaminy B 12 została przeprowadzona na dwa różne sposoby przez współpracujące ze sobą grupy badawcze Roberta Burnsa Woodwarda na Harvardzie i Alberta Eschenmosera na ETH w 1972 r. Osiągnięcie to wymagało wysiłku co najmniej 91 badaczy ze stopniem doktora (Harvard: 77, ETH: 14) i 12 dr. studentów (na ETH) z 19 różnych krajów przez okres prawie 12 lat. Projekt syntezy wywołał i obejmował poważną zmianę paradygmatu w dziedzinie syntezy produktów naturalnych .
Cząsteczka

Witamina B 12 , C 63 H 88 CoN 14 O 14 P, jest najbardziej złożoną ze wszystkich znanych witamin . Jego struktura chemiczna została określona przez rentgenowską analizę struktury krystalicznej w 1956 roku przez grupę badawczą Dorothy Hodgkin ( Oxford University ) we współpracy z Kennethem N. Truebloodem z UCLA i Johnem G. White'em z Princeton University . Rdzeniem cząsteczki jest korynowa , azotowa czterokleszczowy system ligandów. Jest to biogenetycznie spokrewnione z porfirynami i chlorofilami , ale różni się od nich pod ważnymi względami: w szkielecie węglowym brakuje jednego z czterech mezowęgli między pięcioczłonowymi pierścieniami, przy czym dwa pierścienie (A i D, ryc. 1) są bezpośrednio połączone przez pojedyncze wiązanie węgiel-węgiel . System chromoforu Corrin jest zatem niecykliczny i rozszerza się tylko w trzech pozycjach mezo, zawierając trzy winylogiczne jednostki amidynowe . Ustawieni na obrzeżach makrocyklu pierścieniem jest osiem grup metylowych i cztery łańcuchy boczne kwasu propionowego i trzy łańcuchy octowe . Dziewięć atomów węgla na obrzeżach corriny to centra chirogenne . Czterokleszczowy, jednozasadowy ligand corriny jest skoordynowany równikowo z trójwartościowym jonem kobaltu , który zawiera dwa dodatkowe ligandy osiowe .
kilka naturalnych wariantów struktury B12 , które różnią się tymi ligandami osiowymi. W samej witaminie kobalt ma cyjanową na górnej stronie płaszczyzny korynowej ( cyjanokobalamina ), a pętlę nukleotydową na drugiej. Ta pętla jest połączona na swoim drugim końcu z obwodową propionową grupą amidową w pierścieniu D i składa się z elementów strukturalnych pochodzących od aminopropanolu , fosforanu , rybozy i 5,6-dimetylobenzimidazolu . Jeden z atomów azotu imidazolu pierścień jest osiowo skoordynowany z kobaltem, a pętla nukleotydowa tworzy w ten sposób dziewiętnastoczłonowy pierścień. Wszystkie grupy karboksylowe łańcucha bocznego są amidami.
Kwas kobyrynowy, jedna z naturalnych pochodnych witaminy B 12 , nie ma pętli nukleotydowej; w zależności od natury dwóch ligandów osiowych, zamiast tego wyświetla swoją funkcję kwasu propionowego w pierścieniu D jako karboksylan (jak pokazano na ryc. 1) lub kwas karboksylowy (z dwoma ligandami cyjankowymi w kobalcie).
Dwie syntezy
Struktura witaminy B 12 była pierwszym naturalnym produktem o niskiej masie cząsteczkowej , który został określony na podstawie analizy rentgenowskiej, a nie degradacji chemicznej. Tak więc, chociaż ustalono strukturę tego nowego typu złożonej biomolekuły , jej chemia pozostała zasadniczo nieznana; badanie tej chemii stało się jednym z zadań syntezy chemicznej witaminy . W latach 60. synteza tak wyjątkowo złożonej i unikalnej struktury stanowiła główne wyzwanie na pograniczu badań nad syntezą organicznych produktów naturalnych.
Już w 1960 roku grupa badawcza biochemika Konrada Bernhauera w Stuttgarcie odtworzyła witaminę B12 z jednej z jej naturalnie występujących pochodnych, kwasu kobyrynowego, poprzez stopniową konstrukcję pętli nukleotydowej witaminy. Praca ta polegała na częściowej syntezie witaminy B 12 z naturalnego produktu zawierającego wszystkie elementy strukturalne witaminy B 12 z wyjątkiem nukleotydu pętla. Dlatego jako cząsteczkę docelową dla całkowitej syntezy witaminy B 12 wybrano kwas kobyrynowy .
Wspólna praca grup badawczych na Harvardzie i na ETH zaowocowała dwiema syntezami kwasu kobyrynowego, obie przeprowadzone jednocześnie w 1972 r., Jedna na Harvardzie, a druga na ETH. „Współpraca konkurencyjna” tej wielkości, obejmująca 103 doktorantów i naukowców ze stopniem doktora, łącznie prawie 177 osobolat, jest jak dotąd wyjątkowa w historii syntezy organicznej . Te dwie syntezy są misternie ze sobą powiązane chemicznie, ale zasadniczo różnią się sposobem, w jaki centralna makrocykliczna konstruowany jest system ligandów koryna. Obie strategie są wzorowane na dwóch modelowych syntezach koryna opracowanych w ETH. W pierwszym, opublikowanym w 1964 r., uzyskano konstrukcję chromoforu korynowego poprzez połączenie składnika AD ze składnikiem BC poprzez kondensacje iminoestru / enaminy -C,C- , przy czym ostateczne zamknięcie pierścienia koryna zostało osiągnięte między pierścieniami A i B. Druga modelowa synteza, opublikowana w 1969 r., Badała nowy fotochemiczny proces cykloizomeryzacji w celu stworzenia bezpośredniego połączenia pierścienia A / D jako ostatecznego zamknięcia pierścienia koryna między pierścieniami A i D.
Podejście A/B do syntezy kwasu kobyrowego było realizowane wspólnie i zrealizowane w 1972 roku na Harvardzie. Połączył bicykliczny składnik Harvard AD ze składnikiem ETH BC i zamknął makrocykliczny pierścień korynowy między pierścieniami A i B. Podejście A/D do syntezy osiągnięto w ETH i zakończono w tym samym czasie co A/B podejście również w 1972, sukcesywnie dodaje pierścienie D i A do składowej BC podejścia A/B i osiąga zamknięcie pierścienia Corrina między pierścieniami A i D. Ścieżki obu syntez spotkały się we wspólnym półproduktie korynoidowym. The ostatnie etapy od tego związku pośredniego do kwasu kobyrowego zostały ponownie przeprowadzone wspólnie w dwóch laboratoriach, przy czym każda grupa pracowała odpowiednio z materiałem przygotowanym według własnego podejścia.
Streszczenie współpracy Harvard/ETH
Początki
Woodward i Eschenmoser rozpoczęli projekt chemicznej syntezy witaminy B 12 niezależnie od siebie. Grupa ETH rozpoczęła w grudniu 1959 roku modelowe badanie sposobu syntezy systemu ligandów corrina. W sierpniu 1961 roku grupa z Harvardu zaczęła bezpośrednio atakować narastanie struktury B 12, celując w najbardziej złożoną część cząsteczki B 12 , „zachodnia połowa”, która zawiera bezpośrednie połączenie między pierścieniami A i D (komponent AD). Już w październiku 1960 roku grupa ETH rozpoczęła syntezę prekursora pierścienia B witaminy B 12 .
Na początku postęp na Harvardzie był szybki, dopóki nieoczekiwany stereochemiczny przebieg etapu tworzenia pierścienia centralnego nie przerwał projektu. Rozpoznanie przez Woodwarda stereochemicznej zagadki, która wyszła na jaw dzięki irytującemu zachowaniu jednego z jego starannie zaplanowanych etapów syntezy, stało się, zgodnie z jego własnymi pismami, częścią rozwoju, który doprowadził do powstania zasad symetrii orbitalnej .
Po 1965 roku grupa z Harvardu kontynuowała prace nad komponentem AD według zmodyfikowanego planu, używając (-) -kamfory jako źródła pierścienia D.
Łączenie sił: podejście A/B do syntezy kwasu kobyrowego
Do 1964 roku grupa ETH dokonała pierwszej syntezy modelu corriny , a także przygotowania prekursora pierścienia B jako części konstrukcji samej cząsteczki B12 . Ponieważ niezależny postęp obu grup w kierunku ich długoterminowego celu był tak wyraźnie komplementarny, Woodward i Eschenmoser postanowili w 1965 roku połączyć siły i odtąd wspólnie realizować projekt syntezy B12, planując wykorzystanie konstrukcji liganda ( pierścień sprzężenie komponentów) strategia modelu systemu ETH.
Do 1966 roku grupie ETH udało się zsyntetyzować składnik BC („wschodnia połowa”) poprzez połączenie ich prekursora pierścienia B z prekursorem pierścienia C. Ten ostatni został również przygotowany na Harvardzie z (-)-kamfory za pomocą strategii wymyślonej i zastosowanej wcześniej przez A. Peltera i JW Cornfortha w 1961 r. W ETH synteza składnika BC obejmowała wdrożenie C, C- reakcja kondensacji poprzez skurcz siarczkowy . Ta nowo opracowana metoda okazała się stanowić ogólne rozwiązanie problemu konstruowania charakterystycznych elementów strukturalnych chromoforu koryńskiego, winylogicznych układów amidynowych łączących cztery pierścienie obwodowe.
Na początku 1967 roku grupa z Harvardu dokonała syntezy modelowego składnika AD, z niezróżnicowanym łańcuchem bocznym f, mającym funkcję estru metylowego, podobnie jak wszystkie inne łańcuchy boczne. Od tego czasu obie grupy systematycznie wymieniały się próbkami swoich połówek docelowej struktury korynoidów. Do 1970 roku wspólnie połączyli niezróżnicowany składnik AD Harvarda ze składnikiem BC ETH, tworząc dicyjano-kobalt(III)-5,15-bisnor-heptametylo-kobyrynian 1 (ryc. 4). Grupa ETH zidentyfikowała ten całkowicie syntetyczny półprodukt korynoidowy poprzez bezpośrednie porównanie z próbką wyprodukowaną z naturalnej witaminy B12 .
ustalono warunki reakcji dla wymagających procesów sprzęgania C/D i cyklizacji A/B metodą skurczu siarczkowego. Te dla sprzęgania C/D zostały z powodzeniem zbadane w obu laboratoriach, lepsze warunki były te znalezione na Harvardzie, podczas gdy metoda zamykania pierścienia A/B poprzez wewnątrzcząsteczkową wersję skurczu siarczkowego została opracowana w ETH . Później wykazano na Harvardzie, że zamknięcie pierścienia A/B można również osiągnąć przez tio -iminoestru/enaminy.
Na początku 1971 roku grupa z Harvardu dokonała syntezy końcowego składnika AD, zawierającego grupę karboksylową łańcucha bocznego f w pierścieniu D, odróżnioną od wszystkich funkcji karboksylowych jako grupę nitrylową (jak pokazano na 2 na ryc . 4 ; zob . także rys. 3 ). Część A/D struktury B 12 obejmuje najbardziej skomplikowaną konstytucyjnie i konfiguracyjnie część cząsteczki witaminy; jego synteza jest uważana za apoteozę sztuki Woodwarda w całkowitej syntezie produktów naturalnych.
Alternatywne podejście do syntezy kwasu kobyrowego
Już w 1966 roku grupa ETH zaczęła badać, ponownie w systemie modelowym, alternatywną strategię syntezy koryny, w której pierścień koryna byłby zamknięty między pierścieniami A i D. Projekt został zainspirowany możliwym istnieniem nieznany dotąd proces reorganizacji obligacji. To – jeśli istnieje – umożliwiłoby budowę kwasu kobyrowego z jednego materiału wyjściowego. Co ważne, hipotetyczny proces, interpretowany jako implikujący dwa kolejne przegrupowania, został formalnie objęty nowymi klasyfikacjami reaktywności przegrupowań sigmatropowych i elektrocyklizacji zaproponowanymi przez Woodwarda i Hoffmanna w kontekście ich zasad symetrii orbitalnej !
Do maja 1968 roku grupa ETH wykazała w badaniu modelowym, że przewidywany proces, fotochemiczna cykloizomeryzacja A/D-seco-corrinate → corrinate, faktycznie istnieje. Po raz pierwszy stwierdzono, że proces ten przebiega z kompleksem Pd, ale wcale nie z odpowiednimi kompleksami Ni(II)- lub kobaltu(III)-A/D-seco-corrinate. Poszło również gładko w kompleksach jonów metali, takich jak cynk i inne fotochemicznie obojętne i luźno związane jony metali. Te po zamknięciu pierścienia można łatwo zastąpić kobaltem. Odkrycia te otworzyły drzwi do tego, co ostatecznie stało się fotochemicznym podejściem A/D do syntezy kwasu kobyrowego.
Począwszy od jesieni 1969 roku ze składnikiem BC podejścia A/B i prekursorem pierścienia D przygotowanym z enancjomeru materiału wyjściowego prowadzącego do prekursora pierścienia B, doktorant Walter Fuhrer potrzebował mniej niż półtora lat na przełożenie fotochemicznego modelu syntezy koryny na syntezę dicyjano-kobaltu(III)-5,15-bisnor-a,b,d,e,g-pentametylo-kobyrynianu-c-N,N-dimetyloamidu-f - nitrylu 2 ( rys. 4 ), pospolity korynoid pośredni na drodze do kwasu kobyrowego. Na Harvardzie ten sam średniozaawansowany 2 uzyskano mniej więcej w tym samym czasie przez połączenie zróżnicowanego pierścienia D składnika Harvard AD (dostępnego wiosną 1971 r.) ze składnikiem ETH BC, stosując metody kondensacji opracowane wcześniej przy użyciu niezróżnicowanego składnika AD.
Tak więc, wiosną 1971 roku, stały się dostępne dwie różne drogi do pospolitego korynoidu pośredniego 2 ( ryc. 4 ) wzdłuż drogi do kwasu kobyrowego, jedna wymagająca 62 etapów chemicznych ( podejście Harvard/ETH A/B ), druga 42 ( ETH podejście A/D ). W obu podejściach cztery obwodowe pierścienie pochodziły z enancjomerycznie czystych prekursorów posiadających prawidłowy sens chiralności , co pozwalało ominąć główne problemy stereochemiczne w tworzeniu układu ligandów. W budowie skrzyżowania A/D przez A/D-secocorrin → corrin należało spodziewać się powstania dwóch diastereoizomerów A/D. Zastosowanie kadmu(II) jako koordynującego jonu metalu doprowadziło do bardzo wysokiej diastereoselektywności na korzyść naturalnego trans -izomeru A/D.
Gdy struktura korynowa została utworzona za pomocą dowolnego podejścia, trzy centra CH- chirogenne na obrzeżach przylegających do układu chromoforowego okazały się podatne na epimeryzację z wyjątkową łatwością. Wymagało to rozdzielenia diastereoizomerów po większości etapów chemicznych na tym zaawansowanym etapie syntezy. Na szczęście mniej więcej w tym czasie w chemii analitycznej opracowano technikę wysokociśnieniowej chromatografii cieczowej (HPLC) . HPLC stała się nieodzownym narzędziem w obu laboratoriach; jego użycie w B 12 Projekt, zapoczątkowany przez Jakoba Schreibera z ETH, był najwcześniejszym zastosowaniem tej techniki w syntezie produktów naturalnych.
Wspólne ostatnie kroki
Ostateczna konwersja wspólnego korynoidu pośredniego 2 (ryc. 6) z dwóch podejść do docelowego kwasu kobyrynowego wymagała wprowadzenia dwóch brakujących grup metylowych w pozycjach mezo chromoforu koryny między pierścieniami A/B i C/D, jak również przekształcenie wszystkich peryferyjnych grup karboksylowych w ich formę amidową, z wyjątkiem krytycznego karboksylu w łańcuchu bocznym pierścienia D (patrz rys. 6). Etapy te były wspólnie badane w ściśle równoległy sposób w obu laboratoriach, grupa z Harvardu przy użyciu materiału wyprodukowanego metodą A/B, grupa ETH przygotowana w ten sposób metodą fotochemiczną A/D.
Pierwsza decydująca identyfikacja całkowicie syntetycznego półproduktu na drodze do kwasu kobyrowego została przeprowadzona w lutym 1972 roku za pomocą krystalicznej próbki całkowicie syntetycznego dicyjano-kobaltu(III)-heksametylo-kobyrynianu-f-amidu 3 ( ryc . 6), znalezionego być identyczne we wszystkich danych z krystaliczną próbką przekaźnikową wykonaną z witaminy B12 przez metanolizę do cobesteru 4 , po której następuje częściowa amonoliza i oddzielenie powstałej mieszaniny. W czasie, gdy Woodward ogłosił „Całkowitą syntezę witaminy B 12 " na konferencji IUPAC w New Delhi w lutym 1972 całkowicie syntetyczna próbka f-amidu została wykonana w ETH metodą fotochemiczną A/D, podczas gdy pierwsza próbka syntetycznego kwasu kobyrowego, zidentyfikowana z naturalnym kobyrykiem został uzyskany na Harvardzie przez częściową syntezę z materiału przekaźnikowego f-amidu pochodzącego z B 12. Tak więc osiągnięciem Woodwarda i Eschenmosera w tym czasie były, ściśle mówiąc, dwie formalne całkowite syntezy kwasu kobyrowego, jak również dwie formalne całkowita synteza witaminy.
W późniejszym okresie 1972 roku dwa krystaliczne epimery całkowicie syntetycznego dicyjano-kobaltu(III)-heksametylo-kobyrynianu-f- amidu 3 , jak również dwa krystaliczne epimery całkowicie syntetycznego f-nitrylu, wszystkie przygotowane za pomocą obu metod syntetycznych, zostały dokładnie zidentyfikowane chromatograficznie i spektroskopowo z odpowiednimi substancjami pochodzącymi z B12 . Na Harvardzie kwas kobyrynowy był następnie wytwarzany również z całkowicie syntetycznego f-amidu 3 przygotowanego metodą A/B. Wreszcie, w 1976 roku na Harvardzie, całkowicie syntetyczny kwas kobrynowy został przekształcony w witaminę B 12 drogą zapoczątkowaną przez Konrada Bernhauera .
Rekord publikacji
W ciągu prawie 12 lat, jakie zajęło obu grupom osiągnięcie celu, zarówno Woodward, jak i Eschenmoser okresowo relacjonowali etap wspólnego projektu w wykładach, niektóre z nich ukazały się drukiem. Woodward omówił podejście A/B w wykładach opublikowanych w 1968 i 1971 r., których kulminacją było ogłoszenie „Total Synthesis of Vitamin B 12 ” w New Delhi w lutym 1972 r., opublikowane w 1973 r. Ta publikacja i wykłady o tym samym tytule Woodward dostarczone w drugiej połowie roku 1972 ograniczają się do podejścia A/B syntezy i nie omawiają podejścia ETH A/D.
Eschenmoser omówił wkład ETH w podejście A / B w 1968 r. Na 22. konferencji Fundacji Roberta A. Welcha w Houston, a także w swoim wykładzie stulecia RSC z 1969 r . „Roads to Corrins”, opublikowanym w 1970 r. Przedstawił fotochemiczny ETH Podejście A/D do syntezy B 12 na 23. IUPAC Kongres w Bostonie w 1971 r. Grupa Zürich ogłosiła zakończenie syntezy kwasu kobyrowego metodą fotochemicznego A/D w dwóch wykładach wygłoszonych przez doktorantów Maaga i Fuhrera na spotkaniu Szwajcarskiego Towarzystwa Chemicznego w kwietniu 1972 r., Eschenmoser wygłosił wykład „Całkowita synteza witaminy B 12 : szlak fotochemiczny” po raz pierwszy jako wykład Wilsona Bakera na Uniwersytecie w Bristolu, Bristol/Wielka Brytania 8 maja 1972 r.

Ponieważ do 1977 r. nie ukazała się wspólna pełna publikacja syntez dokonanych przez grupy Harvard i ETH (ogłoszona i spodziewana w), artykuł opisujący ostateczną wersję fotochemicznego podejścia A/D, dokonanego już w 1972 r., został opublikowany w 1977 r. w Science. Ten artykuł jest rozszerzonym tłumaczeniem na język angielski artykułu, który ukazał się już w 1974 roku w Naturwissenschaften, na podstawie wykładu wygłoszonego przez Eschenmosera 21 stycznia 1974 roku na spotkaniu Zürcher Naturforschende Gesellschaft. Cztery dekady później, w 2015 roku, ten sam autor ostatecznie opublikował serię sześciu pełnych artykułów opisujących prace grupy ETH nad korynem synteza. Część I serii zawiera rozdział zatytułowany „The Final Phase of the Harvard/ETH Collaboration on the Synthesis of Vitamin B 12 ”, w którym opisano wkład grupy ETH we wspólne prace nad syntezą witaminy B 12 w latach 1965–1965 1972 są rejestrowane.
Cała praca ETH jest szczegółowo udokumentowana w publicznie dostępnym dokumencie Ph.D. prace magisterskie, prawie 1900 stron, wszystkie w języku niemieckim. Wkłady 14 badaczy ETH ze stopniem doktora zaangażowanych w syntezę kwasu kobyrynowego są w większości zintegrowane z tymi tezami. Szczegółowe prace eksperymentalne na Harvardzie zostały udokumentowane w raportach 77 zaangażowanych badaczy ze stopniem doktora, o łącznej objętości ponad 3000 stron.
Reprezentatywne przeglądy dwóch podejść do chemicznej syntezy witaminy B 12 zostały szczegółowo opublikowane przez AH Jackson i KM Smith, T. Goto, RV Stevens, KC Nicolaou i EG Sorensen, podsumowane przez J. Mulzer i D. Riether oraz GW Craig, oprócz wielu innych publikacji, w których omawiane są te epokowe syntezy.
Podejście Harvard / ETH do syntezy kwasu kobyrynowego: droga do wspólnego korynoidu pośredniego poprzez zamknięcie pierścienia A / B-koryny
W podejściu A/B do kwasu kobyrowego, składnik Harvard AD był sprzężony ze składnikiem ETH BC między pierścieniami D i C, a następnie zamknięty do koryny między pierścieniami A i B. Oba te krytyczne etapy zostały wykonane przez C, Sprzęganie C poprzez skurcz siarczkowy , nowy typ reakcji opracowany w syntezie składnika BC w ETH. Składnik AD został zsyntetyzowany na Harvardzie z prekursora pierścienia A (przygotowanego z achiralnych materiałów wyjściowych) i prekursora pierścienia D przygotowanego z (-) - kamfory . Do zbadania warunków sprzężenia wykorzystano modelową składową AD; ten składnik różnił się od składnika AD stosowanego w końcowej syntezie tym, że miał jako grupę funkcyjną w łańcuchu bocznym pierścienia D f grupę estru metylowego ( podobnie jak wszystkie inne łańcuchy boczne) zamiast grupy nitrylowej .
| Harwardzka synteza składników AD dla podejścia A/B |
|---|
|
Synteza prekursora pierścienia A Punktem wyjścia do syntezy prekursora pierścienia A był metoksydimetylo-indol H-1 zsyntetyzowany przez kondensację zasady Schiffa z m-anizydyny i acetoiny . Reakcja z odczynnikiem Grignarda jodku propargilu dała racemiczną propargiloindoleninę rac - H -2 ; zamknięcie pierścienia do aminoketonu rac - H-3 zostało spowodowane przez BF 3 i HgO w MeOH poprzez związek pośredni rac - H-2a ( dodatek elektrofilowy ) z dwiema grupami metylowymi zmuszonymi do związku cis z powodów kinetycznych i termodynamicznych. Rozdzielanie racemicznego aminoketonu na dwa enancjomery . Reakcja rac - H-3 z (-)- izocyjanianem etylu pozwoliła na wydzielenie przez krystalizację jednej z dwóch powstałych diastereoizomerycznych pochodnych mocznika (druga nie krystalizuje). Traktowanie racemicznego ketonu rac - H-3 (lub ługów macierzystych z poprzedniej krystalizacji) (+)-izocyjanianem etylu dało enancjomer pierwszej pochodnej mocznika . Pirolityczny rozkład każdej z tych pochodnych mocznika prowadził do enancjomerycznie czystych aminoketonów, pożądanego (+)-H-3 i (-)-H-3 . „Nienaturalny” (-)-enancjomer (-)-H-3 został użyty do określenia konfiguracji absolutnej ; w różnych późniejszych etapach (-) -H-3 i pochodzące od niego enancjomery pośrednie zastosowano jako związki modelowe w eksperymentach eksploracyjnych. Woodwarda napisał o nienaturalnym enancjomerze „nasze doświadczenie było takie, że jest to prawie jedyny rodzaj badań modelowych, które uważamy za całkowicie wiarygodne”. Wyznaczenie konfiguracji absolutnej prekursora pierścienia-A (+)-H-3. Do tego oznaczenia użyto lewoskrętnego („nienaturalnego”) enancjomeru aminoketonu (-)-H-3 w celu zaoszczędzenia cennego materiału: acylowanie grupy aminowej (-)-H-3 chlorkiem chloroacetylu , następnie działając na produkt H-3a w t -butanolanem potasu t - butanolu otrzymano tetracykliczny keto-laktam H-3b . Jego ketokarbonyl przekształcono w grupę metylenową przez odsiarczanie ditioketalu H -3b niklem Raneya , otrzymując laktam H- 3c . Zniszczenie pierścienia aromatycznego przez ozonolizę , polegające na utracie funkcji karboksylowej na drodze spontanicznej dekarboksylacji , doprowadziło do bicyklicznego kwasu laktamokarboksylowego H-3d . Materiał ten zidentyfikowano z produktem H-3h pochodzącym z (+)-kamfory , mający taką samą budowę i konfigurację absolutną, jak pokazano we wzorze H-3d . Materiał do tej identyfikacji H-3d zsyntetyzowano z (+)-kamfory w następujący sposób: kwas cis -izoketopinowy H-3e , otrzymany z (+)-kamfory ustaloną drogą opisaną w literaturze, przekształcono przez odpowiedni chlorek , azydek i izocyjanian do metylouretanu H -3f . Po potraktowaniu t -butanolanem potasu w t -butanolu, a następnie KOH, H-3f został przekształcony w H-3h , wyraźnie za pośrednictwem półproduktu H-3g . Tożsamość dwóch próbek H-3d i H-3h otrzymanych dwiema opisanymi drogami pozwoliła ustalić konfigurację absolutną (+)-H-3 , enancjomeru prekursora pierścienia-A. Synteza prekursora pierścienia-D z (-)-kamfory (-)-kamforę nitrozowano w pozycji α grupy karbonylowej, otrzymując oksym H-4 , rozszczepienie Beckmanna dało poprzez odpowiedni nitryl amid H-5 . Degradacja Hofmanna przez pośrednią aminę i zamknięcie jej pierścienia doprowadziło do powstania laktamu H-6 . Konwersja jego N -nitrozopochodnej H-7 dała związek diazowy H-8 . Rozkład termiczny H-8 wywołał migrację metylu z wytworzeniem cyklopentenu H-9 . Redukcja do H-10 ) ( LiAlH4 , utlenianie ( kwas chromowy ) do aldehydu H-11 , reakcja Wittiga ( karbometoksymetylenotrifenylofosforan ) do H-12 i hydroliza grupy estrowej ostatecznie dały kwas trans -karboksylowy H-13 . Sprzęganie prekursorów pierścienia A i pierścienia D z „pentacyklonem” N -acylowanie tricyklicznego aminoketonu (+)-H-3 chlorkiem H-14 kwasu karboksylowego H-13 dało amid H-15 , który potraktowany t -butanolanem potasu w t -butanolu stereoselektywnie dał pentacykliczny keto-laktam H -16 poprzez wewnątrzcząsteczkową reakcję Michaela , która kieruje wskazane atomy wodoru w trans względem siebie. W oczekiwaniu na redukcję brzozy aromatycznych pierścienia, wymagane były grupy ochronne dla dwóch karbonylowych grup funkcyjnych H -16 , jedna dla ketonowej grupy karbonylowej jako ketal H-17 , a druga dla karbonylu laktamu jako wysoce czułego eteru enolowego H-20 . Tę ostatnią ochronę osiągnięto przez traktowanie H-17 solą Meerweina (tetrafluoroboran trietyloksoniowy) z wytworzeniem soli iminowej H-18 , a następnie konwersję do ortoamidu H-19 ( NaOMe /MeOH), a na koniec wydalenie jednej cząsteczki metanolu przez ogrzewanie w toluenie. Brzozowa redukcja H-20 ( lit w ciekłym amoniaku , t -butanol, THF ) dała tetraen H-21 . Traktowanie kwasem w dokładnie kontrolowanych warunkach doprowadziło najpierw do pośredniego dionu z podwójnym wiązaniem w pozycji β, γ, który przesunął się do pozycji sprzężonej w dionie H-22 , nazwanego pentacyklonenem . Od „pentacyklonu” do „kornorsteronu” Grupa zabezpieczająca ketal etylenowy w pentacyklononie H-22 została przekształcona w grupę ketonową H-23 przez katalizowaną kwasem hydrolizę . Dioksym powstały głównie w reakcji diketonu H-23 z chlorkiem hydroksyloamoniowym był regioselektywnie hydrolizowany ( kwas azotawy /kwas octowy ) do pożądanego monooksymu H-24 . To jest oksym sterycznie bardziej utrudniony grupa ketonowa, której atom azotu ma stać się azotem docelowego pierścienia D cząsteczki. Kluczowe znaczenie ma konfiguracja podwójnego wiązania monooksymowego, gdzie grupa hydroksylowa zajmuje pozycję z mniejszą zawadą przestrzenną. Wiązania podwójne C,C zarówno pierścienia cyklopentenu, jak i pierścienia cykloheksenonu w H-24 zostały następnie rozszczepione przez ozonolizę (ozon w 80 °C w MeOH, kwasie nadjodowym ) i utworzona grupa karboksylowa została zestryfikowana CH 2 N 2 ) do diketonu H-25 . Jakiś wewnątrzcząsteczkowa kondensacja aldolowa jednostki 1,5-dikarbonylowej w MeOH z użyciem octanu pirolidyny jako zasady, a następnie tosylowanie grupy hydroksylowej oksymu dała pochodną cykloheksenonu H-26 . Druga ozonoliza w wilgotnym octanie metylu , a następnie traktowanie kwasem nadjodowym i CH2N2 dała H - 27 . Przegrupowanie Beckmanna (MeOH, polistyrenosulfonian sodu, 2 godziny, 170 ° C) wytwarzane regioselektywnie laktam H-27a (nie wyizolowany), który reagował dalej w kaskadzie kondensacji amina-karbonyl → kondensacja aldolowa do tetracyklu H-28 , zwanego α-kornorsteronem , implikując go jako „kamień węgielny” w syntezie pożądanego składnika AD. Ten związek wymaga silnie alkalicznych warunków, aby otworzyć swój pierścień laktamowy , ale odkryto, że pomniejszy izomer , również wyizolowany z mieszaniny reakcyjnej, β-kornorsteron H-29 , z wielką łatwością ulega otwarciu pierścienia laktamowego w warunkach alkalicznych. Strukturalnie te dwa izomery różnią się jedynie orientacją bocznego łańcucha kwasu propionowego w pierścieniu A: izomer β ma bardziej stabilną orientację trans tego łańcucha w stosunku do sąsiedniego łańcucha kwasu octowego utworzonego po otwarciu pierścienia laktamowego. Równowaga α-kornorsteronu H-28 przez ogrzewanie w mocnej zasadzie, a następnie zakwaszanie i traktowanie diazometanem , doprowadziło do wyodrębnienia czystego β-kornorsteronu H-29 z 90% wydajnością. Prawidłowa konfiguracja absolutna sześciu przylegających do siebie centrów asymetrii w β-kornorsteronie została potwierdzona przez rentgenowską analizę struktury krystalicznej bromo-β-kornorsteronu o „nienaturalnej” konfiguracji. Synteza składnika AD przenoszącego grupę funkcyjną kwasu propionowego w pierścieniu D jako grupę metoksykarbonylową (model składnika AD) Traktowanie β-kornorsteronu H-29 metanolowym roztworem HCl rozszczepiło pierścień laktamowy i wytworzyło pochodną eteru enolowego o nazwie hesperimina H-30u . Ozonoliza do aldehydu H-32u , redukcja grupy aldehydowej za pomocą NaBH4 ostatecznie w MeOH do pierwszorzędowego alkoholu H-33u i konwersja grupy hydroksylowej przez odpowiedni mesylan dała bromek H-34u . Stanowi to modelowy składnik AD, ten z niezróżnicowaną grupą funkcyjną kwasu propionowego w pierścieniu D (tj. mający grupę estru metylowego, jak wszystkie inne łańcuchy boczne). Synteza składnika AD przenoszącego funkcję kwasu propionowego w pierścieniu D jako grupę nitrylową Konwersja β-kornorsteronu H-29 do właściwego składnika AD H-34 zawierającego karboksylową grupę funkcyjną pierścienia D łańcucha bocznego kwasu propionowego jako grupy nitrylowej , różniącej się od wszystkich innych grup metoksykarbonylowych, obejmowała następujące etapy: traktowanie H -29 z metanolowym roztworem tiofenolu i HCl dało pochodną fenylotioenoloeteru H-30 , która po ozonolizie w niskiej temperaturze dała odpowiedni tioester - aldehyd H-31 a po potraktowaniu ciekłym amoniakiem, amid H-32 . Redukcja grupy aldehydowej za pomocą NaBH4 do H -33 , mesylacja pierwszorzędowej grupy hydroksylowej bezwodnikiem metanosulfonowym w warunkach, które również przekształcają pierwszorzędową grupę amidową w pożądaną grupę nitrylową i wreszcie zastąpienie grupy metanosulfonyloksylowej przez bromek, w wyniku czego powstaje AD- składnik H-34 z grupą funkcyjną kwasu propionowego w pierścieniu D jako nitryl, różniący się od wszystkich innych takich łańcuchów bocznych. |
| Sprzężenie komponentów Harvard AD z komponentem ETH BC |
|---|
|
Budowa chromoforu koryńskiego z jego trzema jednostkami winyloamidowej amidyny stanowi – poza bezpośrednim połączeniem pojedynczym wiązaniem między pierścieniami A i D – główne wyzwanie dla wszelkich prób syntezy witaminy B 12 . Pierwsze podejście do całkowitej syntezy witaminy B 12 wprowadzone przez firmę Cornforth został przerwany, gdy stanął przed zadaniem sprzęgania zsyntetyzowanych prekursorów pierścieni. Sprzężenie komponentów Harvard AD z komponentem ETH BC wymagało szeroko zakrojonych prac eksploracyjnych, pomimo wiedzy zdobytej w modelach syntezy ETH mniej złożonych (tj. mniej podstawionych peryferyjnie) corrinów. To, co można nazwać epickim zaangażowaniem w formalne utworzenie zaledwie dwóch obligacji C, C, trwało od początku 1967 roku do czerwca 1970 roku. Zarówno na ETH, jak i na Harvardzie, szeroko zakrojone badania modelowe dotyczące sprzężenia uproszczonych analogów enaminoidowych składnika AD z imino- i tioiminoestrową pochodną (pierścienia C) pełnoprawnego składnika BC konsekwentnie wykazały, że sprzężenie Komponenty Harvarda i ETH z trudem można było uzyskać metodą, która okazała się tak skuteczna w syntezie prostszych koryt, a mianowicie przez międzycząsteczkową kondensację enamino-imino(lub tio-imino)estru. Wyniki tych badań modelowych zadecydowały ostateczną typ struktury składnika Harvard AD: struktura zdolna do działania jako składnik sprzężenia C/D poprzez skurcz siarczku poprzez sprzęganie alkilowe , tj. bromek H-34u . Ta metoda została już wdrożona przez grupę ETH w syntezie składnika BC . szeroko zakrojone poszukiwania optymalnych warunków, najpierw dla sprzężenia C/D składnika AD ze składnikiem ETH BC E-19 , a następnie warunków późniejszego wewnątrzcząsteczkowego zamknięcia pierścienia koryna A/B , używając f-niezróżnicowanego modelu AD-component H-34u jako modelu. W wyniku prac Yoshito Kishi z Harvardu i Petera Schneidera z ETH, ostatecznie znaleziono na Harvardzie optymalne warunki dla sprzężenia C/D, podczas gdy pierwsza i najbardziej niezawodna metoda zamknięcia pierścienia Corrin pomiędzy pierścieniami A i B został opracowany w ETH. Procedury sprzęgania C/D i zamykania pierścieni korygujących A/B opracowane w tej serii modeli zostały później zastosowane do odpowiednich etapów w serie f-zróżnicowane jako części syntezy kwasu kobyrowego. Synteza dicyjano-kobaltu(III)-5,15-bisnor-a,b,c,d,e,f,g-heptametylo-kobyrynianu z niezróżnicowanego modelu pierścienia-D Składnik AD Sprzężenie DC/C. Kluczowym problemem na tym etapie była labilność głównego produktu sprzęgania, tioeteru HE-35u , izomeryzującego do innych tioeterów początkowo niepodatnych na skurcz siarczkowy w powtarzalnej procedurze z akceptowalną wydajnością. Indukowany przez t -butanolan potasu w THF/ t -butanolu w ściśle kontrolowanych warunkach, przy ścisłym wykluczeniu powietrza i wilgoci, model AD-komponent H-34u płynnie reagował z BC-komponentem E-19 , dając produkt sprzęgania z mostkami siarki HE-35u , nazwany „tioeterem typu I”, z zasadniczo ilościową wydajnością. Jednak produkt ten można było wyizolować tylko w bardzo dokładnie kontrolowanych warunkach, ponieważ niezwykle łatwo równoważy się (np. chromatografia lub śladowe ilości kwasu trifluorooctowego w roztworze chlorku metylenu) do bardziej stabilnego izomerycznego tioeteru HE-36u (tioeteru typu II), który zawiera , w przeciwieństwie do tioeteru typu I, system π stabilizowanej koniugatywnie winylogicznej amidyny. W zależności od warunków jeszcze inny izomer HE-37u (tioinny typ III). Rozpoczynając od takich mieszanin produktów sprzęgania, BF3 w ETH stwierdzono, że różne warunki (np. kompleks metylo-rtęć, , trifenylofosfina ) indukują (poprzez HE-38u ) etap skurczu do HE-39u z umiarkowaną wydajnością. Ponieważ wybór rozpuszczalnika okazał się kluczowy, optymalną procedurą na Harvardzie było ogrzewanie tioinnego typu II HE-36u w sulfolanie w obecności 5,3 równoważnika kwasu trifluorooctowego i 4,5 równoważnika tris-(β-cyjanoetylo)-fosfiny w temperaturze 60°C przez 20 godzin, wytwarzając HE-39u z wydajnością do 85%. Później odkryto, że nitrometan może być również stosowany jako rozpuszczalnik. Zamknięcie pierścienia A/B. Problem zamknięcia pierścienia koryna między pierścieniami A i B został rozwiązany na dwa różne sposoby, jeden opracowany w ETH, drugi realizowany na Harvardzie. Obie metody odpowiadają procedurom opracowanym wcześniej w syntezie kompleksów metali oraz wolnych ligandów prostszych koryn. W badaniach nad procedurami zamykania pierścieni dla znacznie bardziej podstawionego półproduktu A/B-seco-corrinoid HE-39u , grupa ETH skupiła się na wewnątrzcząsteczkowej wersji utleniającej metody skurczu siarczków, ostatecznie prowadząc do dicyjano-kobaltu (III )-kompleks HE48u . Ten pierwszy całkowicie syntetyczny związek korynoidowy został zidentyfikowany za pomocą odpowiedniej próbki pochodzącej z witaminy B12 . Na Harvardzie wykazano, że zamknięcie makrocyklu korryny można również zrealizować metodą kondensacji tioiminoestru/enaminy. Wszystkie opisane tutaj reakcje musiały być przeprowadzane na bardzo małą skalę, z „… najwyższym rygorem wykluczenia tlenu z mieszanin reakcyjnych”, a większość z nich również przy ścisłym wykluczeniu wilgoci i światła, co wymagało bardzo wysokich standardów ekspertyz eksperymentalnych. Główną przeszkodą w osiągnięciu zamknięcia pierścienia A/B-corrin było odsłonięcie wysoce niestabilnego egzocyklicznego wiązania podwójnego metylenu pierścienia B, które ma tendencję do izomeryzacji z dużą łatwością do bardziej stabilnej, niereaktywnej pozycji endocyklicznej. Problem został rozwiązany w ETH przez stwierdzenie, że traktowanie związku pośredniego tiolakton-tiolaktam HE-40u (otrzymanego z HE-39u w reakcji z P 2 S 5 ) dimetyloaminą w suchym MeOH (temperatura pokojowa, z wyłączeniem powietrza i światła) płynnie otwiera się pierścień tiolaktonowy w pierścieniu B, tworzący się przez eliminację H2 S egzocykliczne wiązanie podwójne metylidenu, jak również grupa dimetyloaminoamidowa w łańcuchu bocznym kwasu octowego. Warunki te są wystarczająco łagodne, aby zapobiec tautomeryzacji wiązania podwójnego do termodynamicznie bardziej stabilnej pozycji izomerycznej w pierścieniu. Natychmiastowa konwersja kompleksem Zn-nadchloran-heksa(dimetyloformamid) w metanolu do kompleksu cynku HE-41u , a następnie sprzęganie oksydacyjne (0,05 mM roztwór I 2 / KI w MeOH, 3 h) dało HE-42u . Skurcz siarczkowy (trifenylofosfina, kwas trifluorooctowy, 85°C, z wyłączeniem powietrza i światła), a następnie ponowne tworzenie kompleksów z Zn(ClO4 ) 2 ( KCl, MeOH, diizopropyloamina ) doprowadziło do powstania kompleksu chloro-cynkowego HE-43u . Wolna sól koryniowa utworzona po CoCl2 potraktowaniu HE-43u kwasem trifluorooctowym w acetonitrylu została ponownie skompleksowana z bezwodnym w THF do kompleksu dicyjano-kobaltu(III) HE-44u . Przekształcenie grupy dimetyloaminoamidowej w bocznym łańcuchu kwasu octowego pierścienia B w odpowiednią grupę metyloestrową ( O -metylacja tetrafluoroboranem trimetyloksoniowym , a następnie rozkład soli iminowej wodnym roztworem NaHCO 3 ) dała całkowicie syntetyczny 5,15-bisnor- kobyrynian heptametylu HE-48u . Próbkę krystaliczną HE-48u zidentyfikowano za pomocą widm UV/VIS , IR i ORD z odpowiednią próbką krystaliczną pochodzącą z witaminy B12 Później na Harvardzie zamknięcie pierścienia A / B-corrin osiągnięto również przez przekształcenie związku pośredniego tiolaktonu-tiolaktamu HE-40u w tiolakton-tioiminoester HE-45u przez S -metylację siarki tiolaktamowej (MeHgOi-Pr, następnie tetrafluoroboran trimetyloksoniowy) . Produkt HE-45u poddano działaniu dimetyloaminy (jak w wariancie ETH), tworząc wysoce nietrwałą pochodną metylidenową HE-46u , którą następnie przekształcono bezwodnym CoCl 2 w THF do kompleksu dicyjano-kobaltu(III) HE-47u , substrat gotowy do zamknięcia pierścienia (A⇒B) przez kondensację tioiminoestru/enaminy. Dokładne poszukiwania na Harvardzie warunków reakcji doprowadziły do procedury (KO- t -Bu, 120 ° C, dwa tygodnie), która dała kompleks corriny HE-44u , identyczny z HE-44u iz ogólną wydajnością porównywalną z HE-44u uzyskanym przez ETH wariant procedury skurczu siarczkowego. Ponieważ w modelowych syntezach Corrina taka kondensacja C,C wymagała indukcji mocną zasadą, jej zastosowanie w substracie zawierającym siedem grup metylowych nie było bezproblemowe; w a zastosowano łagodniejsze warunki reakcji. Synteza dicyjano-kobaltu(III)-5,15-bisnor-a,b,d,e,g-pentametylo-kobyrynianu-c- N,N -dimetyloamidu-f-nitrylu (powszechnego półproduktu korrynoidu) z pierścienia- D-zróżnicowana składowa AD Składnik AD H-34 ze swoją grupą funkcyjną kwasu propionowego w pierścieniu D, różniącą się od wszystkich innych karboksylowych grup funkcyjnych jako grupa nitrylowa, stał się dostępny na Harvardzie wiosną 1971 r. W wyniku wszechstronnych prac badawczych przeprowadzonych z modelem AD -component na Harvardzie i ETH, łącząc właściwy komponent AD H-34 z komponentem BC E-19 trzema operacjami H-34 + E-19 →→ HE-36 → HE-39 . Zamknięcie pierścienia corriny osiągnięto w sekwencji HE-39 (P 2 S 5 , ksylen , γ-pikolina ) → HE-40 → HE-41 → HE-42 → HE-43 (ogólna wydajność „około 60 %”), i wreszcie do kompleksu kobaltu HE-44 . Reakcje w tej sekwencji oparto na procedurach opracowanych w serii modeli niezróżnicowanych . Dostępne były dwie metody zamknięcia pierścienia A/B: oksydacyjna skurcz siarczkowy w kompleksie cynku, po której następuje wymiana cynku na kobalt (ETH) lub alkilatywna odmiana harwardzka skurczu siarczkowego, kondensacja tioiminoestrowa / enaminowa kompleks kobaltu (ulepszone warunki reakcji: diazabicyklononanon w DMF, 60°C, kilka godzin). Woodward preferował tę pierwszą: „… metoda utleniania jest nieco lepsza, ponieważ jest stosunkowo łatwiejsza do odtworzenia…”. Kompleks korynowy dicyjano-kobalt(III)-5,15-bisnor-pentametylo-kobyrynian-c- N,N -dimetyloamid-f-nitrylu HE-44 przejął rolę wspólnego korynoidu pośredniego w dwóch podejściach do kwasu kobyrowego synteza: HE-44 ≡ E-37 . Ze względu na dużą labilność konfiguracyjną CH chirogennych centrów C-3, C-8 i C-13 na obrzeżach liganda w środowisku zasadowym lub kwaśnym, rozdział metodą HPLC była niezbędna do wyizolowania, oczyszczenia i scharakteryzowania czystych diastereoizomerów tego i kolejnych półproduktów korynoidów. |
| Przygotowanie prekursora pierścienia C z (+)-kamfory przez grupę z Harvardu |
|---|
|
Materiałem wyjściowym do syntezy prekursora pierścienia C był (+)- kamforochinon H-35 , który został przekształcony w kwas acetoksy-trimetylocykloheksenokarboksylowy H-36 przez BF3 . w bezwodniku octowym , reakcja zapoczątkowana przez Manasse'a i Samuela w 1902 r ,, zastosowane już z powodzeniem w poprzedniej syntezie prekursora pierścienia C przez Peltera i Cornfortha. Po konwersji H-36 do amidu H-37 nastąpiła jego ozonoliza do nadtlenku H-38 , który został zredukowany do keto- sukcynoimid H-46 przez cynk i MeOH. Traktowanie metanolowym roztworem HCl dało laktam H-40 , a następnie termiczną eliminację metanolu do prekursora pierścienia C H-41. Stwierdzono, że jest on identyczny z prekursorem pierścienia C E-13 przygotowanym inną drogą w ETH. |
Podejście ETH do syntezy kwasu kobyrynowego: droga do wspólnego korynoidu pośredniego poprzez zamknięcie pierścienia A/D-corrin
W podejściu A/D do syntezy kwasu kobyrowego cztery prekursory pierścienia (prekursor pierścienia C tylko formalnie) wywodzą się z dwóch enancjomerów jednego wspólnego chiralnego materiału wyjściowego. Wszystkie trzy winylogiczne amidynowe , które łączą cztery obwodowe pierścienie, zostały skonstruowane metodą skurczu siarczkowego , przy czym składnik BC – już przygotowany do podejścia A/B – służył jako półprodukt. Fotochemiczna cykloizomeryzacja A/D-secocorrin → corrina, w wyniku której pierścień koryny został zamknięty między pierścieniami A i D, jest nowym procesem, ukierunkowanym i występującym w badaniu modelowym ( por. Figa. 2 ).
| Synteza komponentu ETH BC (część podejścia A/B oraz A/D) |
|---|
|
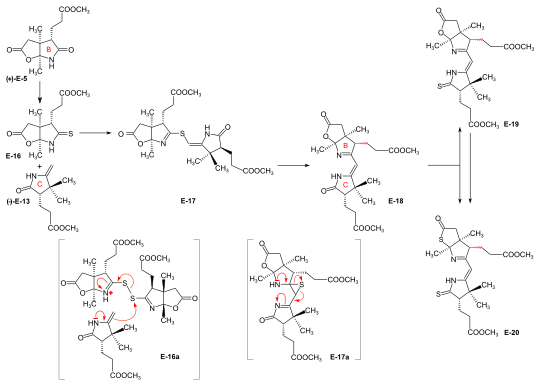
Syntezy prekursora pierścienia B Przeprowadzono dwie syntezy prekursora pierścienia-B (+)-E-5 ; dalej stosowano ten wychodzący z 2-butanonu. Opracowano dwie ścieżki konwersji prekursora pierścienia B w prekursor pierścienia C (+)-E-5 → (-)-E-13 ≡ H-41 , jedną w ETH i jedną na Harvardzie. Te konwersje okazały się niewystarczające do wytworzenia dużych ilości prekursora pierścienia C. Jednak ścieżka opracowana w ETH posłużyła do określenia konfiguracji absolutnej prekursora pierścienia B. Masowe ilości prekursora pierścienia C do produkcji komponentu BC w ETH przygotowano w Harvard z (+)-kamfory drogą pierwotnie opracowaną przez Peltera i Cornfortha . Prekursor pierścienia B z 2-butanonu i kwasu glioksylowego. Kondensacja aldolowa między 2-butanonem i kwasem glioksalowym przez traktowanie stężonym kwasem fosforowym ) dała stereoselektywnie kwas ( trans )-3-metylo-4-okso-2-pentenowy E-1 . Reakcja Dielsa-Aldera E -1 z butadienem w benzenie w obecności SnCl 4 dała racemat chiralnego adduktu Dielsa-Aldera E-2 , który został rozdzielony na enancjomery przez sekwencyjne tworzenie soli z (-)- i (+)- 1-fenyloetyloaminą . Centra chirogenne (+)- enancjomeru (+)-E-2 posiadały konfigurację absolutną pierścienia B w witaminie B12 . Utlenianie tego (+)-enancjomeru kwasem chromowym w acetonie w obecności kwasu siarkowego dało dilakton (+)-E-3 pośredniego kwasu trikarboksylowego E-3a . Termodynamiczna kontrola tworzenia dilaktonu prowadzi do konfiguracji cis złącza pierścieniowego. Wydłużenie łańcucha bocznego kwasu octowego (+)-E-3 w reakcji Arndta-Eisterta (poprzez odpowiedni chlorek kwasowy i diazoketon) dało dilakton (+)-E-4 . Traktowanie (+)-E-4 NH 3 w MeOH w temperaturze pokojowej utworzyło podwójną mieszaninę izomerycznych laktamów - laktonów w stosunku 2:1, z prekursorem pierścienia-B (+)-E-5 dominujący (wyizolowany z wydajnością 55%). Izomeryczny laktam-lakton można izomeryzować do (+)-E-5 przez traktowanie metanolowym roztworem HCl. Alternatywna synteza racemicznego prekursora pierścienia B z estru Hagemanna: implementacja przegrupowania amidacetalu-Claisena. Potrzebnych było pięć etapów, aby przekształcić estrowy rac Hagemanna - E-6 w racemat formy laktam-lakton rac - E-5 prekursora pierścienia-B. Produkt etapu C-metylacji rac - E-6 → rac - E-7 ( NaH , CH 3 I ) oczyszczono poprzez jego krystaliczny oksym . Cis - hydroksy-ester (konfiguracja zabezpieczona przez utworzenie laktonu) NaBH4 powstały w etapie redukcji rac - E-7 → rac - E-8 ( ) musiał zostać oddzielony od izomeru trans . Przegrupowanie termiczne rac - E-8 → rac - E-9 stanowi realizację przegrupowania amidacetalu -Claisena w syntezie organicznej, precedens przegrupowania ortoestru-Claisena Johnsona i irlandzkiego estru-enolanu . Ozonoliza ( O 3 /MeOH, HCOOH / H 2 O 2 ) estru N,N -dimetyloamidu rac - E-9 dała kwas dilaktonowy rac - E-10 , z którego dwie reakcje doprowadziły do powstania laktamu-laktonu metylowego estru rac - E- 7 , racemat prekursora pierścienia-B (+)-E-7 . Wyznaczanie konfiguracji absolutnej prekursora (+)-pierścienia-B poprzez jego konwersję do prekursora (+)-pierścienia-C Konwersja prekursora pierścienia B do prekursora pierścienia C opierała się na redukcyjnej dekarbonylacji tiolaktonu E-12 chloro-tris-(trifenylofosfino)rodem(I) . Traktowanie metanolowego roztworu prekursora pierścienia-B (+)-E-5 diazometanem w obecności katalitycznych ilości metanolanu sodu , a następnie termiczna eliminacja metanolu, dało metylidenolaktam E-11 , który został przekształcony w tiolakton E -12 z płynem H 2 S zawierający katalityczną ilość kwasu trifluorooctowego . Ogrzewanie E-12 w toluenie z kompleksem Rh(I) dało prekursor pierścienia-C (-)-E-13 oprócz odpowiedniej pochodnej cyklopropanu E-14 . Stwierdzono , że prekursory pierścienia C przygotowane tą drogą iz (+)-kamfory na Harvardzie są identyczne: (-) -E-13 ≡ H-41 . Ozonoliza prekursora pierścienia-C (-)-E-13 dała pochodną sukcynimidu (-)-E-15 . Stwierdzono, że ten sukcynoimid ma identyczną budowę i skręcalność optyczną (tj. konfigurację) z odpowiednim sukcynoimidem pochodzącym z pierścienia C witaminy B12 , wyizolowanym po ozonolizie krystalicznego heptametylo-kobyrynianu (cobester) otrzymanego z witaminy B12 . Podejście przyjęte na Harvardzie do konwersji prekursora pierścienia B w prekursor pierścienia C opierało się na fotochemicznej degradacji grupy karboksylowej łańcucha bocznego kwasu octowego, wychodząc z (+) -E-7 przygotowanego w ETH. Sprzężenie prekursorów pierścienia B i pierścienia C z komponentem BC. Implementacja metody skurczu siarczkowego C,C-kondensacji Metoda kondensacji iminoestru /enaminy C,C- do konstruowania winylogicznego układu amidynowego, opracowana w modelowych badaniach nad syntezą koryny , całkowicie zawiodła w próbach stworzenia docelowego wiązania C,C pomiędzy prekursorem pierścienia-B (+)-E- 5 z prekursorem pierścienia-C (-)-E-13 z wytworzeniem składnika BC E-18 . Problem został rozwiązany przez „wewnątrzcząsteczkową” procesu tworzenia wiązań między elektrofilowym (tio)iminoestrowym węglem a nukleofilowy węgiel metylidenowy układu enaminy poprzez najpierw utleniające połączenie tych dwóch centrów mostkiem siarkowym, a następnie utworzenie wiązania C, C przez obecnie wewnątrzcząsteczkową kondensację tio- iminoestru/enaminy z jednoczesnym przeniesieniem siarki do tiofilu. Konwersja laktamu (+)-E-5 do odpowiedniego tiolaktamu E-16 (P 2 S 5 ), utlenianie E-16 nadtlenkiem benzoilu w obecności prekursora pierścienia-C (-)-E-13 (otrzymanego w Harvard drogą Cornforth), a następnie ogrzewanie produktu reakcji E-17 w fosforynie trietylu (zarówno jako rozpuszczalnik, jak i tiofil) dało składnik BC E-18 jako (nierozdzielona) mieszanina dwóch epimerów (w odniesieniu do konfiguracji propionowego łańcucha bocznego w pierścieniu B) z wydajnością do 80 %. Ujęte w nawiasy wzory na schemacie reakcji ilustrują rodzaj mechanizmu działającego w procesie: E-16a = pierwotne sprzężenie E-12 i E-10 z E-13 ; E-17a = ekstruzja atomu siarki (przechwyconego przez tiofil) do E-14 , gdzie pozostawia się otwartą kwestię, czy ten ostatni proces zachodzi na etapie episiarczku. Ta koncepcja reakcji rozwinęła się na tym etapie, nazwana skurczem siarczkowym , okazało się, że umożliwia budowę wszystkich trzech mostków mezo-węglowych ligandu korynowego witaminy w obu podejściach syntezy. Przekształcenie bicyklicznego laktonu-laktamu E-18 P2S5 / temperaturze w odpowiedni tiolakton-tiolaktam E-20 przeprowadzono przez ogrzewanie z 4 -metylopirydyną w ksylenie w 130°C; łagodniejszy stan wytworzył tiolaktam-lakton E-19 , używany do sprzęgania ze składnikami Harvard AD . |
| Sprzęganie składnika BC z prekursorami pierścienia-D i pierścienia-A |
|---|
|
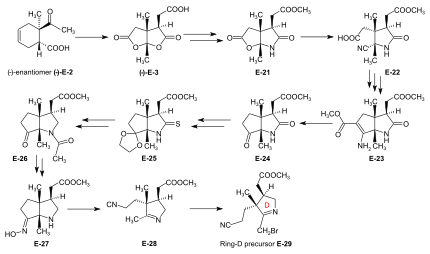
Synteza prekursora pierścienia-D dla podejścia A/D Materiał wyjściowy na prekursor pierścienia-D, (-)- enancjomer kwasu dilaktonokarboksylowego (-)-E-3 , przygotowano z (-)-enancjomeru adduktu Dielsa -Aldera (-)-E -2 przez utlenianie kwasem chromowym /kwasem siarkowym w acetonie. Traktowanie (-)-E-3 NH 3 w MeOH dało kwas laktonowo-laktamowy, który estryfikowano diazometanem do estru E-21 , którego pierścień laktonowy otwarto za pomocą KCN w MeOH, otrzymując E-22 . Konwencjonalne warunki reakcji Arndta-Eisterta ( SOCl 2 : chlorek kwasowy, następnie CH 2 N 2 w THF: diazoketon, potraktowane Ag 2 O w MeOH) doprowadziły do – nieprzewidzianego, ale użytecznego – zamknięcia pierścienia pierwotnie utworzonego łańcucha wydłużony ester poprzez udział grupy cyjanowej jako sąsiedniego elektrofilu , dający bicykliczną pochodną enaminoestrową E-23 . Hydroliza wodnym roztworem HCl, której towarzyszyła dekarboksylacja i ponowna estryfikacja diazometanem dała keto-laktam-ester E-24 . Po ketalizacji ( (CH 2 OH) 2 , CH(OCH 3 ) 3 , TsOH ) E-24 i konwersji tego estru laktamowego do tiolaktamu E-25 ( P 2 S 5 ) następowało redukujące usuwanie siarki za pomocą Raneya nikiel , acetylacja grupy aminowej i hydrolizę ketalu (AcOH) z wytworzeniem E-26 . Zostało to NH2OH /HCl przekształcone przez deacetylację grupy aminowej HCl, a następnie potraktowanie , MeOH/ NaOAc w oksym E-27 . Fragmentacja Beckmanna (HCl, SOCl 2 w CHCl 3 , N-polistyrylo-piperydyna) tego oksymu E-27 dała imino-nitryl E-28 , który potraktowany bromem (w MeOH, buforze fosforanowym pH 7,5, -10°C) dało prekursor pierścienia-D E-29 . Konwersja prekursora pierścienia B do prekursora pierścienia A dla podejścia A/D Prekursor pierścienia A (-)-E-31 wymagany w podejściu A/D jest bliską pochodną prekursora pierścienia B (+)-E-5 . Jej otrzymanie z (+)-E-5 wymagało otwarcia grupy laktonowej ( KCN w MeOH), następnie ponownej estryfikacji diazometanem do E-30 , następnie przekształcenia grupy laktamowej w grupę tiolaktamową za pomocą P 2 S 5 do wydajność (-)-E-31 . Sprzęganie składnika BC z prekursorami pierścienia-D i pierścienia-A Najskuteczniejszym sposobem przyłączenia dwóch pierścieni D i A do składnika BC E-18 było bezpośrednie przekształcenie E-18 w jego pochodną tiolaktam- tiolaktonu E-20 , a następnie przejście przez pierwszy prekursor pierścienia sprzęgającego-D E-29 do pierścienia C, a następnie prekursora pierścienia A E-31 do pierścienia B, obie metodą skurczu siarczkowego. Poszukiwanie warunków reakcji dla tych przywiązań było znacznie ułatwione dzięki pracom eksploracyjnym przeprowadzonym na dwóch skurczu siarczków w badaniu modelu podejścia A/B . Przyłączenie prekursora pierścienia-D E-29 do tiolaktamu pierścienia-C w E-20 przez skurcz siarczkowy poprzez sprzęganie alkilowe ( t -BuOK w t -BuOH/THF, tris-(β-cyjano-etylo)-fosfina/ CF 3 COOH w sulfolanie ) dało B/C/D-sesqui-corrinoid E-32 . Aby przyłączyć prekursor pierścienia A E-31 , pierścień B E-32 indukowano, aby odsłonić swoje egzocykliczne podwójne wiązanie metylenowe przez traktowanie dimetyloaminą w MeOH (metodą opracowaną przez Schneidera) tworząc E-33 , który poddano następującej kaskadzie operacji: jodowanie ( N -jodosukcynoimid , CH 2 Cl 2 , 0°), sprzęganie z siarką tiolaktamową prekursora pierścienia-A E-31 [(CH 3 ) 3 Si] 2 N-Na w benzenie/ t -BuOH), kompleksowanie (Cd(ClO 4 ) 2 w MeOH), traktowanie trifenylofosfiną /CF 3 COOH we wrzącym benzenie (skurcz siarczkowy) i wreszcie ponowne kompleksowanie z Cd(ClO 4 ) 2 / N,N -diizopropyloetyloamina w benzenie/MeOH). Te sześć operacji, wszystkie przeprowadzone bez wyodrębniania związków pośrednich , dały kompleks A/D-seco-corrin E-34 w postaci mieszaniny obwodowych epimerów (rozdzielalnych metodą HPLC ) z ogólną wydajnością 42-46%. |
| Zamknięcie pierścienia A/D-corrin przez fotochemiczną cykloizomeryzację A/D-seco-corrin → corrina |
|---|
|
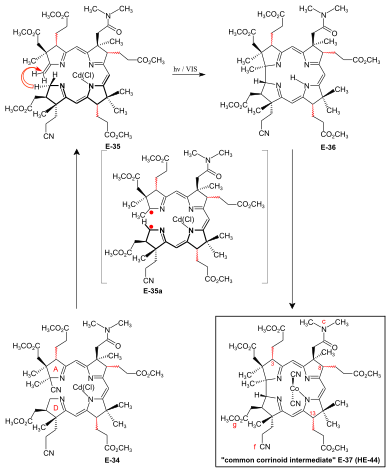
Zamknięcie pierścienia A/D-corrin przez fotochemiczną cykloizomeryzację A/D-seco-corrin→corrin do dicyjano-kobaltu(III)-5,15-bisnor-a,b,d,e,g-pentametylo-kobyrynian-c - N,N -dimetyloamid-f-nitryl (powszechny związek korynoidowy) Warunki i przesłanki ostatecznego zamknięcia (A⇒D) -pierścieni corrina zostały przejęte z szeroko zakrojonych badań modelowych corrina. Problemy specyficzne dla syntezy kwasu kobyrowego, które należało rozwiązać, to: możliwe utworzenie dwóch diastereoizomerycznych połączeń A/D- trans w zamknięciu pierścienia, odsłonięcie wiązania podwójnego metylidenu w pierścieniu A A/D-seco-corrin E-34 w nietrwałym kompleksie Cd i epimeryzowalność obwodowych centrów stereogenicznych C-3, C-8 i C-13 przed i po zamknięciu pierścienia. W zastosowaniu tego nowatorskiego procesu w podejściu A/D syntezy kwasu kobyrowego reakcja przebiegała najefektywniej i z najwyższą stereoselektywnością cewki na korzyść naturalnego złącza A/D- trans w kadmie A/D-seco-corrin złożony. Traktowanie kompleksu Cd E-34 jako mieszaniny epimerów obwodowych z 1,8-diazabicyklo(5.4.0)undek-7-enem w sulfolanie w temperaturze 60 °C pod ścisłą ochroną przed światłem w celu bezpośredniej eliminacji grupy cyjanowej w pierścieniu A a następnie ponowne potraktowanie Cd(ClO 4 ) 2 , doprowadziły do powstania labilnego kompleksu A/D-seco-corrin E-35 jako mieszaniny obwodowych epimerów. Zostało to bezpośrednio poddane kluczowemu etapowi, fotochemicznej reakcji zamknięcia pierścienia przy rygorystycznym wykluczeniu powietrza: światła widzialnego, pod argonem , MeOH, AcOH, 60°C. Produktem zamknięcia pierścienia A/D był wolny ligand corriny E- 36 , ponieważ pierwotnie powstały Cd-corrinate – w przeciwieństwie do Cd- seco -corrinate E-35 – rozkłada się w środowisku reakcji. Corrin E-36 został natychmiast skompleksowany ( CoCl 2 , KCN , powietrze, H 2 O, CH 2 Cl 2 ) i ostatecznie wyizolowany ( chromatografia grubowarstwowa ) jako mieszanina epimerów obwodowych z wydajnością 45-50 % w ciągu czterech operacji: wspólny korrinoid pośredni dicyjano- kompleks kobaltu (III) E-37 ≡ HE-44 . HPLC tej mieszaniny E-37 wykazała obecność sześciu epimerów o naturalnej spiralności ligandu (Σ 95%, widma CD ), w tym 26% naturalnego diastereomeru 3α,8α,13α i równą ilość jego C-13 neo -epimer 3α,8α,13β. Dwie frakcje HPLC (Σ 5%) zawierały diastereoizomery z nienaturalną helikalnością liganda, jak pokazano na widmach odwrotnych CD. Mieszaniny produktów z kilku takich cykloizomeryzacji połączono w celu rozdziału metodą preparatywnej HPLC i pełnej charakterystyki 14 wyizolowanych diastereoizomerów E-37 (z 16 teoretycznie możliwych, w odniesieniu do helikalności i centrów epimerycznych C-3, C-8, C-13). W serii analitycznej mieszaninę epimerów kadmu-seco-kompleksu E-35 rozdzielono metodą HPLC (w ciemności) na naturalny diastereoizomer chloro-kadmu-3α,8α,13α-A/D-seco-corrinate (ααα) -E-35 i cztery inne frakcje epimerów Po napromieniowaniu i po kobaltowaniu (ααα)-E-35 wytworzył E-37 z wydajnością 70-80% jako zasadniczo podwójną mieszaninę głównie epimeru 3α,8α,13α, oprócz niektórych Epimer 3α,8α,13β. Powstało mniej niż 1% frakcji o nienaturalnej spirali (HPLC, UV/VIS , CD ). Z mechanicznego punktu widzenia fotochemiczna cykloizomeryzacja A/D-seco-corrin corrina polega na sigmatropowym przesunięciu α-wodoru w pozycji CH 2 C -19 w pierścieniu D do pozycji CH 2 grupy metylidenowej w pierścieniu A w tryplecie wzbudzonym stan , tworząc przejściowy 15-centrowo-16-elektronowy układ π (patrz E-35a na ryc. 27 ), który zapada się antarafacjalnie między pozycjami C-1 i C-19 do układu corriny. Selektywność cewki zamknięcia pierścienia na korzyść naturalnej spiralności ligandu Corrin jest interpretowana jako odnosząca się do różnicy w zawadzie przestrzennej między łańcuchem kwasu g-metoksykarbonylooctowego w pierścieniu D i regionem metylidenowym pierścienia A w dwóch możliwych konfiguracjach spiralnych cewek kompleksu A/D-seco-corrin (ryc. 28). |
ETH/Harvard: wspólnie zrealizowane ostatnie kroki od wspólnego korynoidu pośredniego do kwasu kobyrowego
Ostatnie kroki od wspólnego korynoidu półproduktu E-37/HE-44 do kwasu kobyric E-44/HE-51 zostały przeprowadzone wspólnie przez dwie grupy i równolegle, grupa ETH pracowała z materiałem wyprodukowanym metodą A/D , a grupa z Harvardu z podejściem A/B . Tym, czego faktycznie dokonały te dwie grupy, były wspólne końcowe etapy dwóch różnych syntez.
Zadania w tej końcowej fazie projektu polegały na regioselektywnym wprowadzeniu grup metylowych w dwóch pozycjach mezo C-5 i C-15 E-37/HE-44 , a następnie przekształceniu wszystkich jego peryferyjnych grup karboksylowych w pierwszorzędowe grupy amidowe , z wyjątkiem tego w łańcuchu bocznym f w pierścieniu D, który musiał skończyć jako wolny karboksyl. Te koncepcyjnie proste kroki wykończeniowe okazały się dość skomplikowane w wykonaniu, w tym nieprzewidziane pułapki, takie jak dramatyczna utrata cennego materiału syntetycznego w tak zwanym „Czarnym piątku” (9 lipca 1971).
| Wprowadzenie grup metylowych w dwóch pozycjach mezo |
|---|
|
To wprowadzenie grup metylowych mogłoby opierać się na badaniach eksploracyjnych na modelowych corrinach, jak również na eksploracyjnych eksperymentach przeprowadzonych w ETH na kobesterze i jego (c→C-8)-laktonie pochodnej. Eter chlorometylobenzylowy alkilował pozycję mezo C-10 kobesteru, ale nie pozycję odpowiedniego laktonu , różnica w zachowaniu odzwierciedla różnicę w zawadzie przestrzennej wywieranej na pozycję mezo C-10 przez sąsiednie podstawniki. Odkrycie to zadecydowało o wyborze substratu do wprowadzenia grup metylowych w pozycjach mezo C-5 i C-10 E-37/HE-44 . W tej końcowej fazie syntezy HPLC ponownie okazała się absolutnie niezbędna do rozdzielania, izolowania, charakteryzowania, a przede wszystkim identyfikacji czystych izomerów kompleksów dicyjano-kobaltu(III) pochodzenia zarówno całkowicie, jak i częściowo syntetycznego. Pierwszym krokiem było przekształcenie grupy c- N,N -dimetylokarboksyamidowej E-37/HE-44 w pochodną (c→C-8)-laktonu E-38/HE-45 przez działanie jodem /AcOH powodujące jodowanie przy C-8, a następnie wewnątrzcząsteczkowe O -alkilowanie grupy karboksyamidowej do soli iminiowej , która hydrolizuje do laktonu. Ta laktonizacja prowadzi do cis . Reakcja (c→C-8)-laktonu E-38/HE-45 z eterem chlorometylobenzylowym w acetonitrylu w obecności LiCl dał oprócz monoadduktu addukt bis-benzyloksy E-39/HE-46 . W przypadku potraktowania tiofenolem powstała bis-fenylotio-pochodna E-40/HE-47 . Traktowanie niklem Raneya w MeOH nie tylko uwolniło dwie grupy metylowe w pozycjach mezo, ale także redukcyjnie otworzyło pierścień laktonowy na wolną grupę c-karboksylową w pierścieniu B, tworząc prawidłową konfigurację α w C-8. Estryfikacja c-karboksylu diazometanem dała heksametyloester-f-nitryl E-41/HE-48 . Ze względów sterycznych tylko dominujący C-3 α-epimer (z łańcuchem bocznym C-3 poniżej płaszczyzny pierścienia korynowego) reagował z 5,15- dipodstawionym produktem E-38/H-45 , a zatem reakcja wynosiła do chemicznego rozdziału epimerów C-3. W ulepszonych procedurach opracowanych na Harvardzie później w 1972 r. Odczynnik eter chlorometylowo-benzylowy został zastąpiony przez formaldehyd / sulfolan / HCl w acetonitrylu na etapie alkilowania, a nikiel Raneya na etapie redukcji zastąpiono cynkiem / kwasem octowym, otrzymując E-41 / HE-48 . |
| Dicyjano-kobalt(III)-3α,8α,13α-a,b,c,d,e,g-heksametylo-kobyrynian-f-amid: Identyfikacja z materiałem pochodzącym z witaminy B 12 |
|---|
|
Stężony H 2 SO 4 w temperaturze pokojowej przekształcił grupę nitrylową czystego (3α,8α,13α)-E-41/HE-48 w pierwszorzędową grupę f- amidową E-42/HE-49 , oprócz częściowej epimeryzacji w C -13; alternatywna procedura selektywnej konwersji f-nitryl → f-amid ( BF 3 w CH 3 COOH), opracowana później na Harvardzie, przebiegała bez epimeryzacji w C-13. Próbka krystaliczna 3α,8α,13α-epimeru dicyjano-kobaltu (III)-a,b,c,d,e,g-heksametylo-kobyrynianu-f-amidu E-42/HE- 49 , wyizolowany za pomocą HPLC, był pierwszym całkowicie syntetycznym związkiem pośrednim zidentyfikowanym chromatograficznie i spektroskopowo z próbką przekaźnikową wykonaną z witaminy B 12 . W pozostałych etapach syntezy istotną rolę odgrywała jedynie epimeryzacja na C-13, przy czym 13α to konfiguracja naturalnych korynoidów, a 13β to neoepimery witaminy B 12 i jej pochodnych; można je łatwo rozdzielić metodą HPLC. W ciągu 1972 roku w obu laboratoriach przeprowadzono kompleksowe identyfikacje (HPLC, UV/VIS , IR , NMR , CD , widma masowe ) krystalicznych próbek całkowicie syntetycznych półproduktów z odpowiadającymi im związkami pochodzącymi z witaminy B12 : indywidualnie porównano i zidentyfikowano neo -epimer 3α,8α,13α i 3α,8α,13β f-amidu E-42/HE-49 , jak również odpowiednią parę C-13-epimerycznych nitryli E-41/HE-48 . Wszystkie te kompleksy dicyjano-kobaltu(III) są rozpuszczalne w rozpuszczalnikach organicznych, w których zdolność rozdziału metodą HPLC znacznie przewyższa zdolność metod analitycznych działających w wodzie, rozpuszczalniku, w którym miał być zidentyfikowany kwas kobyrowy, i gdzie występuje on w dwóch postaciach: łatwo równoważące kompleksy wodno-cyjanowe, epimeryczne pod względem położenia dwóch nieidentycznych osiowych ligandów Co. Te dokładne identyfikacje całkowicie syntetycznych i częściowo syntetycznych materiałów oznaczają ukończenie obu syntez. Wzajemnie dostarczyli również dowodu struktury dla określonego izomeru konstytucyjnego wyizolowanego z mieszaniny izomerycznych monoamidów powstałych w wyniku częściowej amonolizy kobesteru pochodzącego z B 12 , wstępnie przypisanego jako 3α,8α,13α-f-amid E-42 /HE-49 (patrz rys. 30). |
| Syntetyczny kwas kobrynowy |
|---|
|
Ostateczne zadanie dotarcia do kwasu kobyric z f-amidu E-42/HE-49 wymagało krytycznego etapu hydrolizy pojedynczej grupy amidowej do wolnej grupy karboksylowej bez dotykania żadnej z sześciu grup metoksykarbonylowych na obrzeżach cząsteczki. Ponieważ próby eksploracyjne konwencjonalną metodą hydrolizy amidów poprzez nitrozowanie doprowadziły do szkodliwych reakcji ubocznych na chromoforze , nowy sposób „ hydrolizy ” grupy f-amidowej bez dotykania sześciu grup metylowych został wymyślony i zbadany w ETH: traktowanie f- amid E-42/HE-49 (materiał przekaźnikowy pochodzący z B 12 ) z niezwykłym odczynnikiem α-chloro-propylo-(N-cykloheksylo) -nitronem i AgBF 4 w CH 2 Cl 2 , następnie z HCl w H 2 O/ dioksan , a na końcu z dimetyloaminą w izopropanolu dało f-kwas E-43/HE-50 z 57% wydajnością. Długotrwałe eksperymenty na Harvardzie ostatecznie wykazały, że metoda nitrozowania okazała się skuteczna ( N 2 O 4 , CCl 4 , NaOAc ) i do jeszcze skuteczniejszego wytwarzania grupy f-karboksylowej. Również na Harvardzie zbadano warunki ostatniego etapu, konwersji wszystkich pozostałych grup estrowych w pierwszorzędowe grupy amidowe przez amonolizę . Ciekły amoniak w glikolu etylenowym , w obecności NH 4 Cl i przy braku tlenu, przekształcił f-karboksy-heksametyloester E-43/HE-50 w f-karboksy-heksa-amid E-44/HE-51 (= kobyrowy kwas). Został on wykrystalizowany i wykazano, że zarówno forma α-cyjano-β-aquo, jak i α-aquo-β-cyjano są chromatograficznie i spektroskopowo identyczne z odpowiednimi postaciami naturalnego kwasu kobyrowego. Na Harvardzie transformacja E-43/HE-50 → E-44/HE-51, zaczynając od f-amidu, który otrzymano w drodze całkowitej syntezy metodą A/B. Grupa ETH zadowoliła się odpowiednią konwersją f-amidu → kwasu kobyrowego i późniejszą identyfikacją kwasu kobyrowego, gdzie faktyczny materiał wyjściowy f-amid pochodził z witaminy B12 . |