przegrupowanie Claisena
| przegrupowanie Claisena | |
|---|---|
| Nazwany po | Rainera Ludwiga Claisena |
| Typ reakcji | Reakcja przegrupowania |
| Identyfikatory | |
| Portal Chemii Organicznej | |
| Identyfikator ontologii RSC | |
Przegrupowanie Claisena to potężna reakcja chemiczna tworząca wiązanie węgiel - węgiel , odkryta przez Rainera Ludwiga Claisena . Ogrzewanie eteru allilowo- winylowego zainicjuje przegrupowanie [3,3]-sigmatropowe z wytworzeniem γ,δ-nienasyconego karbonylu, napędzanego egzoenergicznie uprzywilejowanym tworzeniem wiązania CO karbonylu (ΔΔH f = -327 kcalmol -1 ).
Mechanizm
Przegrupowanie Claisena jest egzotermiczną , uzgodnioną (rozszczepienie i rekombinacja wiązań) reakcją pericykliczną . Reguły Woodwarda-Hoffmanna pokazują ponadtwarzową, stereospecyficzną ścieżkę reakcji. Kinetyka jest pierwszego rzędu, a cała przemiana przebiega przez wysoce uporządkowany cykliczny stan przejściowy i jest wewnątrzcząsteczkowa. Eksperymenty krzyżowe eliminują możliwość przegrupowania zachodzącego poprzez mechanizm reakcji międzycząsteczkowej i są zgodne z procesem wewnątrzcząsteczkowym.
W przegrupowaniu Claisena obserwuje się znaczne efekty rozpuszczalnika , w którym rozpuszczalniki polarne mają tendencję do przyspieszania reakcji w większym stopniu. Rozpuszczalniki wiążące wodór dawały najwyższe stałe szybkości. Na przykład etanol /woda dają stałe szybkości 10-krotnie wyższe niż sulfolan . Wykazano, że trójwartościowe odczynniki glinoorganiczne, takie jak trimetyloglin , przyspieszają tę reakcję.
Wariacje
Aromatyczne przegrupowanie Claisena
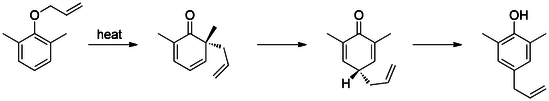
Pierwszym zgłoszonym przegrupowaniem Claisena jest [3,3]-sigmatropowe przegrupowanie eteru fenylo-allilowego do związku pośredniego 1, który szybko tautomeryzuje do 2- allilofenolu .
Meta-substytucja wpływa na regioselektywność tego przegrupowania. Na przykład grupy elektronoakceptorowe (takie jak bromek) w pozycji meta kierują przegrupowanie do pozycji orto (71% produktu orto ), podczas gdy grupy elektronodonorowe (takie jak metoksy) kierują przegrupowanie do pozycji para (69 % paraproduktu ). Dodatkowo obecność orto prowadzi wyłącznie do para-podstawionych produktów przegrupowania (tandemowe przegrupowanie Claisena i Cope'a).
Jeśli aldehyd lub kwas karboksylowy zajmuje pozycje orto lub para , łańcuch boczny allilu wypiera grupę, uwalniając ją odpowiednio jako tlenek węgla lub dwutlenek węgla .
Przegrupowanie Bellusa-Claisena
Przegrupowanie Bellusa-Claisena to reakcja eterów allilowych, amin i tioeterów z ketenami, w wyniku której powstają γ, δ-nienasycone estry, amidy i tioestry. Ta przemiana została nieoczekiwanie zaobserwowana przez Bellusa w 1979 roku poprzez syntezę półproduktu do insektycydu, pyretroidu. Keteny podstawione halogenem (R1 , R2 ) są często stosowane w tej reakcji ze względu na ich wysoką elektrofilowość. Opracowano wiele redukcyjnych metod usuwania powstałych α-haloestrów, amidów i tioestrów. Bellus-Claisen oferuje chemikom syntetycznym wyjątkową okazję do opracowania strategii ekspansji pierścienia.
Przegrupowanie Eschenmosera-Claisena
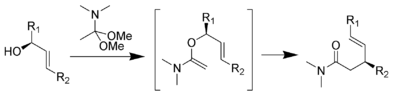
Przegrupowanie Eschenmosera-Claisena przebiega przez ogrzewanie alkoholi allilowych w obecności acetalu dimetylu N , N -dimetyloacetamidu z wytworzeniem γ,δ-nienasyconego amidu. Zostało to opracowane przez Alberta Eschenmosera w 1964 roku. Przegrupowanie Eschenmosera-Claisena zostało wykorzystane jako kluczowy etap w całkowitej syntezie morfiny.
Mechanizm:
Przegrupowanie Irlandia – Claisen
Przegrupowanie Irlandii-Claisena to reakcja karboksylanu allilu z mocną zasadą (taką jak diizopropyloamidek litu ) z wytworzeniem γ, δ-nienasyconego kwasu karboksylowego . Przegrupowanie przebiega przez acetal silyloketenu, który powstaje przez uwięzienie enolanu litu za pomocą chlorotrimetylosilanu. Podobnie jak Bellus-Claisen (powyżej), przegrupowanie Ireland-Claisen może zachodzić w temperaturze pokojowej i wyższej. Acetale E i Z prowadzą odpowiednio do produktów przegrupowanych anty i syn. Istnieje wiele przykładów enancjoselektywnych przegrupowań Irlandii-Claisena znalezionych w literaturze, obejmujących chiralne odczynniki boru i zastosowanie chiralnych środków pomocniczych.
Przegrupowanie Johnsona-Claisena
Przegrupowanie Johnsona-Claisena to reakcja alkoholu allilowego z ortoestrem w celu uzyskania γ, δ-nienasyconego estru . Do katalizowania tej reakcji stosowano słabe kwasy, takie jak kwas propionowy. To przegrupowanie często wymaga wysokich temperatur (100–200 ° C) i może zająć od 10 do 120 godzin. Jednak ogrzewanie wspomagane mikrofalami w obecności glinki KSF lub kwasu propionowego wykazało dramatyczny wzrost szybkości reakcji i wydajności.
Mechanizm:
Przegrupowanie Kazmaiera-Claisena
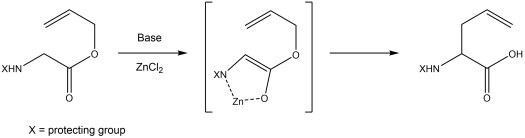
Przegrupowanie Kazmaiera-Claisena to reakcja estru nienasyconego aminokwasu z mocną zasadą (taką jak diizopropyloamidek litu ) i solą metalu w temperaturze –78 ° C z wytworzeniem chelatowanego enolanu jako związku pośredniego. Chociaż do wytworzenia enolanu można stosować różne sole metali, użycie chlorku cynku daje najwyższą wydajność i najlepszą stereospecyficzność. Rodzaj enolanu przegrupowuje się w temperaturze –20 ° C, tworząc aminokwas z allilowym łańcuchem bocznym w pozycji α. Metodę tę opisał Uli Kazmaier w 1993 roku.
Przegrupowanie foto-Claisena
Przegrupowanie Claisena eterów arylowych można również przeprowadzić jako reakcję fotochemiczną . Oprócz tradycyjnego orto otrzymywanego w warunkach termicznych (produkt przegrupowania [3,3]), zmienność fotochemiczna daje również produkt para (produkt [3,5]), alternatywne izomery grupy allilowej (na przykład [ 1,3] i [1,5] produkty) i prostą utratę grupy eterowej, a nawet może przegrupować etery alkilowe oprócz eterów allilowych. Reakcja fotochemiczna zachodzi poprzez stopniowy proces rozszczepiania rodników, po którym następuje tworzenie wiązań, a nie jako skoordynowana reakcja pericykliczna , co w związku z tym daje możliwość uzyskania większej różnorodności możliwych substratów i izomerów produktu. Wyniki [1,3] i [1,5] przegrupowania foto-Claisena są analogiczne do przegrupowania foto-Friesa estrów arylowych i pokrewnych związków acylowych.
Hetero-Claisens
Aza-Claisen
Iminium może służyć jako jedno z ugrupowań związanych wiązaniem pi w przegrupowaniu.
Reakcja Chena-Mappa
Reakcja Chena – Mappa, znana również jako przegrupowanie [3,3]-fosforymidanu lub reakcja Staudingera – Claisena, polega na wstawieniu fosforynu w miejsce alkoholu i wykorzystaniu redukcji Staudingera do przekształcenia go w iminę. Kolejny Claisen jest napędzany faktem, że wiązanie podwójne P=O jest bardziej korzystne energetycznie niż wiązanie podwójne P=N.
Przegrupowanie Overmana
Przegrupowanie Overmana (nazwane na cześć Larry'ego Overmana ) to przegrupowanie Claisena allilowych trichloroacetamidanów w allilowe trichloroacetamidy.
Przegrupowanie Overmana ma zastosowanie do syntezy diaminowych związków wicynolu z 1,2-wicynalnych dioli allilowych.
Obojnacze przegrupowanie Claisena
W przeciwieństwie do typowych przegrupowań Claisena, które wymagają ogrzewania, obojnacze przegrupowania Claisena zachodzą w temperaturze pokojowej lub niższej. Jony acyloamoniowe są wysoce selektywne względem Z - enolanów w łagodnych warunkach .
W naturze
Enzym mutaza choryzmianowa (EC 5.4.99.5) katalizuje przegrupowanie Claisena choryzmatu do prefenanu , związku pośredniego w szlaku biosyntezy prowadzącym do syntezy fenyloalaniny i tyrozyny .
Historia
Odkryta w 1912 r. Przegrupowanie Claisena jest pierwszym zarejestrowanym przykładem przegrupowania [3,3]-sigmatropowego.